芝麻素對人外周血中γδ T細胞體外增殖及殺傷胃癌細胞株BCG-823作用的影響▲
王增慧 張傳禎 吳 倩 劉 煥 湯琳琳 胡 超 馮均軍 陳復興 周忠海 朱 云
(1 徐州醫科大學附屬淮海醫院消化內科,江蘇省徐州市 221004,電子郵箱:wang97yy@163.com;中國人民解放軍陸軍第七十一集團軍醫院2 消化內科,3 麻醉科,4 檢驗-病理科,江蘇省徐州市 221004)
芝麻素是天然的木脂類化合物,在芝麻油和芝麻種子中含量均較高,其藥理作用十分廣泛,如抗氧化、穩定血壓、調節血脂、保護肝臟及抑制腫瘤生長等[1-2]。日本東京大學醫學院所開展的研究證實芝麻素具有抗腫瘤的功效,低濃度的芝麻素飲食可能對肝癌有抑制作用[3],國內也有研究證實芝麻素對肝癌細胞的增殖具有抑制作用[4-5]。近年來,γδ T細胞在抗腫瘤方面的作用逐漸受到國內外學者們的廣泛關注,其主要分布在黏膜及上皮組織內,主要通過主要組織相容性復合物以非限制性方式,以及通過其固有免疫和適應性免疫的輔助作用,來識別及殺傷腫瘤細胞[6-8]。提高γδ T細胞的增殖率及增強其功能,有利于更有效地將γδ T細胞應用于生物學研究以及發揮其臨床抗腫瘤作用。因此,本研究探討芝麻素對人外周血中γδ T細胞體外增殖及殺傷胃癌細胞株BCG-823作用的影響。
1 材料和方法
1.1 實驗材料 GT-T551無血清培養基(日本TAKARA公司,批號:AK2P027);淋巴細胞分離液(中國科學院血液病研究所,批號:LTS1077);芝麻素(Sigma公司,批號:#028M4099V);人胃癌細胞株BCG-823(中國科學院上海細胞庫,編號:BNO0102269);胰蛋白酶(Gibco公司,批號:011020200528);重組人白細胞介素(interleukin,IL)-2(雙鷺藥業,批號:S19991007);異戊烯焦磷酸(美國Sigma-Aldrich公司,批號:SLCB2751);流式細胞儀(美國BD公司,型號:BD-FACSCalibur);酶標儀(上海科華實驗系統有限公司,型號:ST-360);貝克曼自動生化分析儀(美國貝克曼,型號:AU680);細胞計數檢測(cell counting kit-8,CCK-8)試劑(上海碧云天生物技術公司,批號:010919190408);γδ T細胞抗體(美國BD公司,批號:6029567); 穿孔素單抗(eBioscience公司,批號:E020894)、顆粒酶B單抗(eBioscience公司,批號E106781638)、CD107a單抗(eBioscience公司,批號:B181677)、Fix&Perm破膜劑(eBioscience公司,批號:749349340);乳酸脫氫酶試劑 (寧波普瑞柏生物技術公司,批號:LD0359)。
1.2 實驗方法
1.2.1 γδ T細胞的培養及表型鑒定:取5名健康男性志愿者(平均年齡為35周歲)外周血各100 mL,肝素抗凝,各取100 μL抗凝血采用異硫氰酸熒光素標記的γδ T細胞抗體進行標記,用流式細胞儀檢測γδ T細胞的表型。剩下的抗凝血分別采用淋巴細胞分離液分離后吸取單個核細胞層,加入50 mL磷酸緩沖鹽溶液洗滌1遍后,室溫下1 500 r/min離心5 min,棄去上清,沉淀即為獲得的外周血單個核細胞,將加入GT-T551無血清培養基(含誘導γδ T細胞的細胞因子,購自美國Sigma公司)中,調整細胞濃度為1×108個/mL,放入培養瓶后置于37℃、5% CO2培養箱中,每天觀察γδ T細胞生長情況并適量補充培養基;培養10 d后,收集部分γδ T細胞,室溫下1 500 r/min離心5 min,磷酸緩沖鹽溶液洗滌2遍,用異硫氰酸熒光素標記的γδ T細胞抗體進行標記,用流式細胞儀檢測γδ T細胞的表型;當γδ T細胞的表型百分率達到80%以上時方可繼續采用此細胞進行以下實驗。
1.2.2 胃癌細胞株的培養:從液氮中取出BCG-823胃癌細胞株,經復蘇后接種于GT-T551無血清培養基中,置于37℃、5% CO2培養箱中,每天觀察BCG-823胃癌細胞生長情況并適量補充培養基。
1.2.3 CCK-8法檢測γδ T細胞的增殖情況:取培養10 d且生長狀態較好的γδ T細胞接種于96孔板中,每孔培養基200 μL,調整細胞密度為1×105個/孔,加入2 μL不同濃度(濃度分別為0 μg/mL、0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、5.000 μg/mL、10.000 μg/mL、20.000 μg/mL、40.000 μg/mL、80.000 μg/mL、100.000 μg/mL)的芝麻素誘導,設未加細胞及芝麻素組為空白組,0 μg/mL芝麻素為對照組,其余各濃度芝麻素組為實驗組。每個濃度設5個復孔。37℃、5% CO2培養箱中孵育48 h后,每孔加入20 μL CCK-8液,置于37℃、5% CO2培養箱中孵育4~6 h后,測定490 nm波長下各孔的吸光度值,計算細胞增殖率。增殖率=(實驗組吸光度值-空白組吸光度值)/(對照組吸光度值-空白組吸光度值)×100%。
1.2.4 流式細胞儀檢測γδ T細胞中顆粒酶B、穿孔素、CD107a的表達:取培養10 d的γδ T細胞接種于6孔板中,1×108個/孔,選取增殖效果較好的芝麻素濃度(濃度分別為0.156 μg/mL、0.313 g/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL)進行誘導,每個濃度設3個復孔,繼續于37℃、5% CO2培養箱中孵育48 h,收集細胞,用磷酸緩沖鹽溶液洗滌后室溫下1 500 r/min離心5 min,重復2遍,每管分別加入異硫氰酸熒光素標記的γδ T抗體、顆粒酶B單抗、穿孔素單抗、CD107a單抗 ,室溫下避光孵育15 min,磷酸緩沖鹽溶液洗滌后室溫下1 500 r/min離心5 min,重復2遍,用流式細胞儀檢測γδ T細胞中顆粒酶B、穿孔素、CD107a的表達水平。
1.2.5 乳酸脫氫酶釋放法檢測γδ T細胞的殺傷活性:以對數生長期的BCG-823細胞株作為靶細胞,以經不同濃度(分別為0 μg/mL、0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、 5.000 μg/mL、10.000 μg/mL)芝麻素誘導且在37℃、5% CO2培養箱中孵育48 h后的γδ T細胞為效應細胞,其中0 μg/mL的芝麻素為對照組。調整靶細胞濃度為2×105個/mL,調整效應細胞濃度為2×106個/mL,將效靶細胞按體積比為10 ∶1比例混合置于試管中,每個濃度設3個復管。500 r/min離心3 min后置于37℃、5% CO2培養箱中孵育6 h,1 500 r/min離心10 min,吸取上清液,加入乳酸脫氫酶試劑后在生化分析儀上測定各管上清液的活性單位,計算γδ T細胞的殺傷活性。設經各濃度芝麻素誘導后的γδ T細胞與BCG-823細胞混合的試管為測定管,只加BCG-823細胞與培養基的試管為靶細胞自然釋放管,只加γδ T細胞和培養基的試管為效應細胞自然釋放管,BCG-823細胞與乙基苯基聚乙二醇溶液按體積比為10 ∶1混合的試管為靶細胞最大釋放管。γδ T細胞的殺傷活性=(測定管活性單位-效應細胞自然釋放管)/(靶細胞最大釋放管-靶細胞自然釋放管)×100%。
1.3 統計學分析 采用SPSS 16.0軟件進行統計學分析。計量資料以(x±s)表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1 γδ T細胞表型鑒定 培養前外周血中γδ T細胞百分率約為6.14%,培養10 d后外周血中γδ T細胞百分率高達90.34%,見圖1。
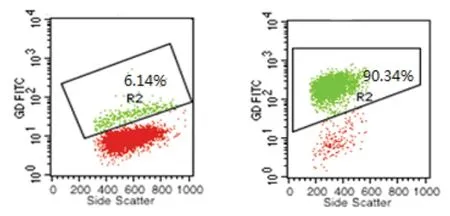
培養前 培養10 d后
2.2 不同濃度芝麻素對γδ T細胞增殖的影響 與對照組相比,0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素組的γδ T細胞增殖率均升高(P<0.05),當芝麻素濃度為1.250 μg/mL時γδ T細胞增殖率最高;而當芝麻素濃度達到5.000 μg/mL以上時,對γδ T細胞的生長起抑制作用。見表1。
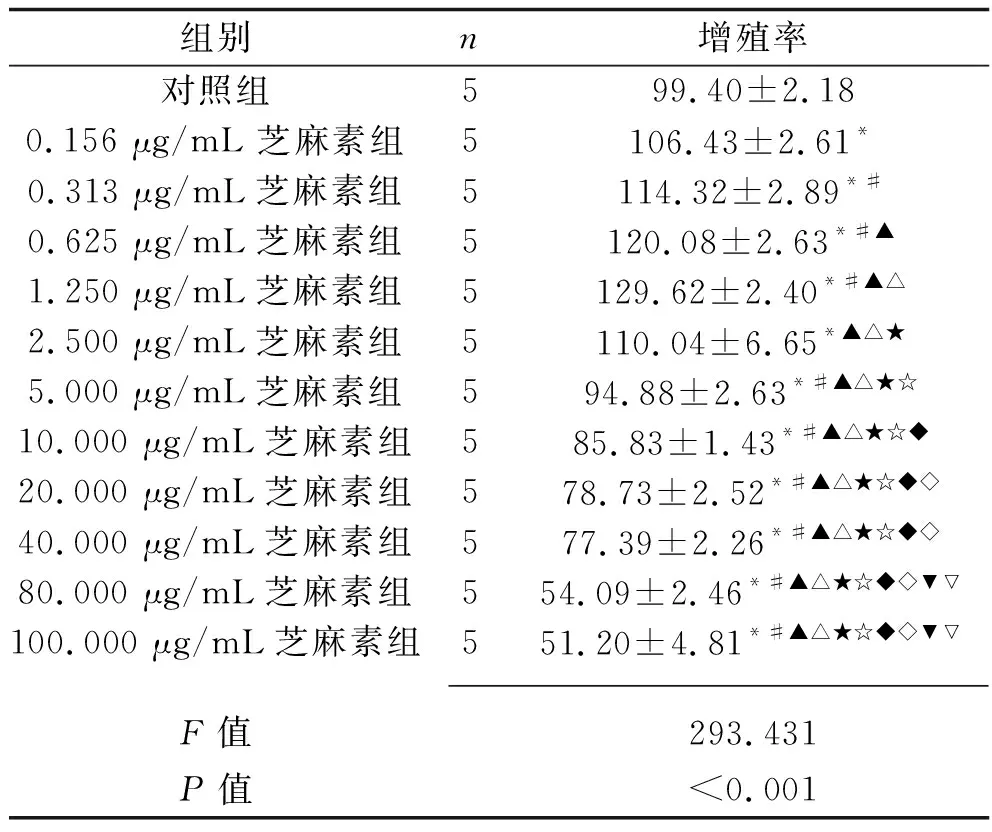
表1 不同濃度芝麻素對γδ T細胞增殖率的影響(x±s,%)
2.3 不同濃度芝麻素對γδ T細胞中顆粒酶B、穿孔素和CD107a表達的影響 0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素組γδ T細胞的顆粒酶B表達水平均高于對照組(均P<0.05),2.500 μg/mL芝麻組的表達水平最高。0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素組γδ T細胞的穿孔素表達水平均高于對照組(均P<0.05),2.500 μg/mL芝麻組的表達水平最高。0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素組 γδ T細胞的CD107a表達水平均高于對照組(均P<0.05)。見表2。
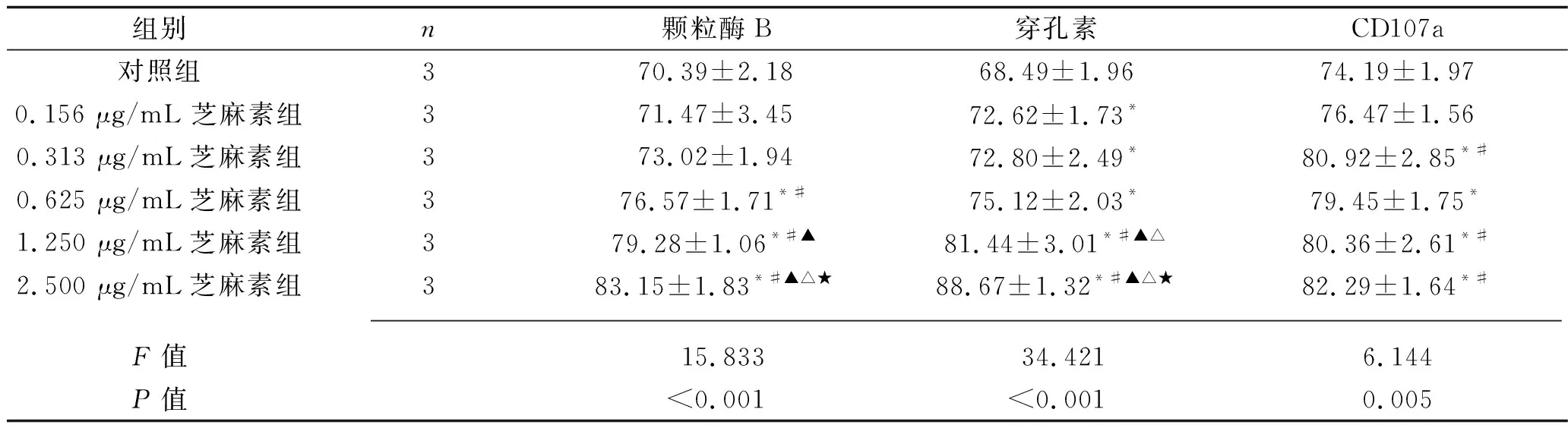
表2 不同濃度芝麻素作用48 h后γδ T細胞中顆粒酶B、穿孔素及CD107a的表達水平(x±s,%)
2.4 不同濃度芝麻作用后γδ T細胞對胃癌細胞BCG-823的殺傷活性 0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、5.000 μg/mL芝麻素作用48 h后,γδ T細胞對胃癌細胞BCG-823的殺傷活性均高于對照組(均P<0.05),且在芝麻素濃度為2.500 μg/mL時對胃癌細胞BCG-823的殺傷活性最高,見表3。
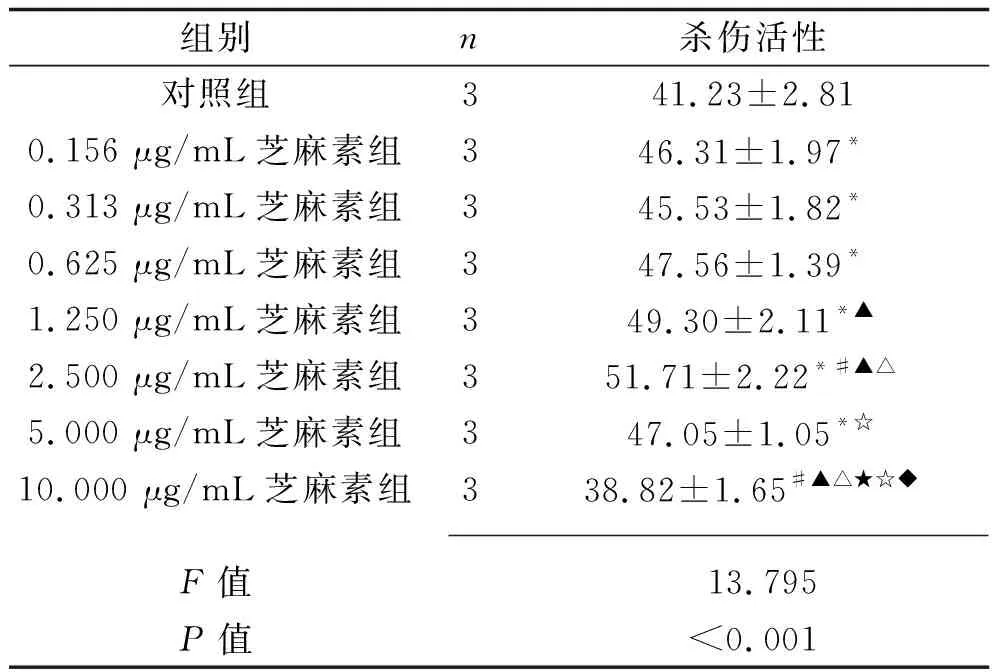
表3 不同濃度芝麻素作用后γδ T細胞對胃癌細胞BCG-823的殺傷活性(x±s,%)
3 討 論
研究證實,芝麻素具有抗氧化、清除自由基、改善脂代謝、降壓降糖、抗癌、殺菌、免疫調節、保肝護腎及神經保護等功效[9-11]。近年來,國內外研究均顯示芝麻素具有抗腫瘤特性,其可通過抑制腫瘤細胞的增殖,引起腫瘤細胞周期阻滯,觸發腫瘤細胞凋亡[6,12-15]。凋亡是由基因調控下游死亡信號誘發的細胞主動程序性死亡,而芝麻素可能通過激活含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)-3、Caspase-8和Caspase-9等通路,誘導腫瘤細胞凋亡[16-17]。
γδ T細胞是存在于人體黏膜組織的固有免疫細胞,具有免疫調節的功能及非特異性免疫的特性,對于人體維持免疫穩態具有重要作用[18]。隨著細胞體外培養技術的成熟,γδ T細胞可單獨使用,或者與其他免疫細胞如記憶T細胞、樹突狀細胞、自然殺傷細胞等聯合應用治療多種腫瘤,且具有較好的療效[7,19]。γδ T細胞主要是通過主要組織相容性復合物,以非限制性的形式特異性識別腫瘤抗原,并釋放顆粒酶、穿孔素來殺傷腫瘤細胞[20]。γδ T細胞還可以通過自然殺傷細胞2族成員D與其配體的相互作用,殺傷具有相應配體的腫瘤細胞[20]。此外,γδ T細胞還可通過穿孔素-顆粒酶途徑、Fas/Fas配體途徑,以及分泌腫瘤壞死因子α、γ-干擾素、IL-12等細胞因子,來發揮其抗腫瘤作用[21]。
學者們在如何提高γδ T細胞的體外培養細胞數量和增強其殺傷功能方面進行了很多研究,證實了IL-15、IL-21、CD28單克隆抗體等生物制劑和一些中藥單體成分可以增強γδ T細胞體外培養的擴增效率及其抗腫瘤細胞毒活性[22-23]。芝麻素是一種木脂類中藥單體成分,但將其應用于體外誘導擴增γδ T細胞以及免疫治療,未見有研究報告。本研究結果顯示,與對照組相比,0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素組的γδ T細胞增殖率均升高(P<0.05),而當芝麻素濃度大于5.000 μg/mL時,對γδ T細胞的生長起抑制作用,提示適當濃度的芝麻素對γδ T細胞的增殖有促進作用,這為將芝麻素作為γδ T細胞免疫調節劑提供了實驗依據。
本研究結果顯示,0.625 μg/mL、1.250 μg/mL、2.500 μg/mL芝麻素組γδ T細胞的顆粒酶B表達水平均高于對照組(P<0.05);0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素組γδ T細胞的穿孔素表達水平均高于對照組(P<0.05);0.313 μg/mL、0.625 μg/mL、1.250 μg/mL及2.500 μg/mL芝麻素組 γδ T細胞的CD107a表達水平均高于對照組(P<0.05);0.156 μg/mL、0.313 μg/mL、0.625 μg/mL、1.250 μg/mL、2.500 μg/mL、5.000 μg/mL芝麻素作用48 h后γδ T細胞對胃癌細胞BCG-823的殺傷活性均高于對照組(P<0.05),提示適宜濃度的芝麻素可能通過上調γδ T細胞中顆粒酶B-穿孔素通路及CD107a的表達,來增強其對腫瘤細胞殺傷活性。
綜上所述,采用適宜濃度的芝麻素誘導人外周血γδ T細胞,可提高γδ T細胞的增殖率及殺傷胃癌細胞BCG-823的功能,機制可能與其上調γδ T細胞的顆粒酶B-穿孔通路和CD107a的表達有關。

