術前CNB診斷DCIS病理組織學低估的危險因素分析
董鑫,彭偉國,王淼,姜亦然,柳迪
(1.北京中醫醫院順義醫院超聲診斷科,北京 101300; 2.北京市順義區婦幼保健院超聲科,北京 101300)
近年來隨著乳腺癌篩查技術的不斷發展及女性主動篩查意識的不斷提高,乳腺導管原位癌(ductal carcinoma in situ,DCIS)在新發乳腺癌中所占比例呈逐年升高趨勢[1]。有資料表明[2],在新發DCIS中有5%~10%伴微浸潤,盡管浸潤程度較低,但仍有1%~14%存在淋巴結轉移,因此準確評估DCIS是否伴有浸潤對治療方案的制訂及預后判斷有重要意義。目前臨床診斷DCIS主要依靠病理組織學活檢,而超聲引導下乳腺空芯針穿刺活檢(core needle biopsy,CNB)是最常用的活檢方式,該方式在超聲引導下實施,準確性高,創傷小,能縮短術前方案制訂時間及麻醉時間,且手術操作采用套管針獲得標本,能有效避免腫瘤細胞脫落引起的種植轉移,患者接受度高[3]。但因術前活檢取材的限制,無法覆蓋所有病變部位,與術后病理診斷仍有一定誤差。國外學者報道提示,術前CNB診斷DCIS出現病理組織學低估現象的比例較高,其中10%~54%的患者最終確診為乳腺浸潤性癌,而腋窩前哨淋巴結活檢陽性率亦接近15%[4]。目前對于DCIS術前病理組織學低估現象發生的影響因素仍存在爭議,國內外尚無統一標準[5-6]。本研究主要分析術前CNB診斷DCIS病理組織學低估的危險因素,以期為客觀判斷術前CNB結果提供參考,現報道如下。
1 資料與方法
1.1一般資料 回顧性分析2015年1月至2020年1月在北京中醫醫院順義醫院就診的經術前CNB診斷的180例單純DCIS患者、64例DCIS合并微浸潤患者及32例DCIS合并可疑微浸潤患者的臨床資料。納入標準:①女性;②術前行CNB診斷且病理組織學診斷為DCIS或DCIS合并微浸潤;③腋窩淋巴結臨床評估陰性;④臨床資料完整。排除標準:①術前病理組織學診斷為浸潤癌;②既往乳腺浸潤癌史;③合并其他類型惡性腫瘤。本研究方案設計符合《赫爾辛基宣言》要求,且患者及家屬均了簽署知情同意書。
1.2方法 查閱病例收集患者年齡、絕經狀態及病理組織學診斷資料。術前CNB檢查和術后切除組織送檢病理,取材面積2 cm×1 cm;組織經石蠟包埋、切片、蘇木精-伊紅染色及免疫組織化學染色后閱片。雌激素受體(estrogen receptor,ER)、孕激素受體(progesterone receptor,PR)及人表皮生長因子受體-2(human epidermal growth factor receptor-2,HER-2)狀態評估均采用免疫組織化學檢測。ER、PR陽性判定標準:鏡下觀察標本細胞核著色細胞占比≥10%,<10%的腫瘤細胞核呈現不同程度著色或完全無著色定義為陰性;HER-2受體陽性判定標準:免疫組織化學評估3+,HER-2受體不確定判定標準為免疫組織化學評估2+,HER-2陰性判定標準為免疫組織化學評估0/1+[7]。乳腺癌微浸潤判定:腫瘤細胞突破基膜并侵犯周圍組織,浸潤灶最大徑≤1 mm,存在多灶性微浸潤時以最大測量徑為依據[8]。
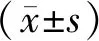
2 結 果
2.1單純DCIS組、DCIS合并微浸潤組及DCIS合并可疑微浸潤組臨床資料比較 三組年齡、絕經狀態、腫瘤直徑分布、HER-2表達比較差異無統計學意義(P>0.05)。三組核分級、ER表達、PR表達、術后病理組織學診斷比較差異有統計學意義(P<0.05),DCIS合并微浸潤組、DCIS合并可疑微浸潤組核分級高的比例高于單純DCIS組(χ2=5.073,P=0.024;χ2=5.570,P=0.018),ER表達陽性、PR表達陽性比例低于單純DCIS組(χ2=4.465,P=0.035;χ2=9.476,P=0.002;χ2=4.371,P=0.036;χ2=8.377,P=0.004),DCIS合并微浸潤組和DCIS合并可疑微浸潤組核分級高、ER表達陽性、PR表達陽性比例比較差異無統計學意義(χ2=0.364,P=0.216;χ2=1.749,P=0.186;χ2=1.394,P=0.238);DCIS合并微浸潤和DCIS合并可疑微浸潤組術后升級為乳腺浸潤癌的比例顯著高于單純DCIS組(χ2=39.861、21.722,均P<0.001),DCIS合并微浸潤和合并可疑微浸潤組術后升級為乳腺浸潤癌的比例比較差異無統計學意義(χ2=0.091,P=0.763);三組術后診斷為乳腺微浸潤癌的比例比較差異無統計學意義(χ2=3.067,P=0.216)。見表1。
2.2單純DICS患者病理組織學診斷結果低估現象發生的單因素分析 術前CNB診斷為單純DICS的患者中,術后病理學診斷為單純DCIS患者101例,設為低估組,乳腺微浸潤癌/乳腺浸潤癌患者79例,設為未低估組。兩組腫瘤發現方式、腫塊是否可觸及、超聲下觀察、ER表達、PR表達比較差異無統計學意義(P>0.05),低估組直徑>3 cm、核分級為高級、HER-2表達陽性比例高于未低估組(P<0.01),見表2。

表1 單純DCIS組、DCIS合并微浸潤組及DCIS合并可疑微浸潤組臨床資料比較

表2 單純DICS患者病理組織學診斷結果低估現象發生的單因素分析 [例(%)]
2.3單純DICS患者病理組織學診斷結果低估現象發生的危險因素分析 將單因素分析中差異有統計學意義的腫瘤直徑(≤3 cm=0,≥3 cm=1)、核分級(低中=0,高=1)、HER-2表達(陰性=0,不確定=1,陽性=2)作為自變量,是否出現術前CNB診斷病理組織學低估為因變量(是=1,否=0),進行Logistic回歸分析,結果顯示,腫瘤直徑>3 cm、核分級高、HER2表達陽性是術前單純DICS患者病理組織學低估現象發生的獨立危險因素(P<0.01),見表3。

表3 單純DICS患者病理組織學低估現象發生的多因素分析
2.4獨立危險因素聯合應用對單純DICS患者病理組織學低估的影響 腫瘤直徑>3 cm、核分級高及HER-2表達陽性的單純DCIS患者病理組織學低估例數高于其他組合,見表4。

表4 獨立危險因素聯合應用對單純DICS患者病理組織學低估的影響
3 討 論
既往研究認為,術前診斷為DCIS病理組織學低估發生的影響因素較為復雜,如出現癥狀、可觸及腫物、腫瘤體積大,影像學可觀察到鈣化/致密腫物影,腫瘤侵犯部位,核分級、HER-2表達、活檢方式等[9-10]。但以上研究中因病例數差異較大、判定標準不一等,部分研究的結論甚至相反。國內外對于術前診斷為DCIS病理組織學低估預測仍無統一標準。
本研究采用超聲引導下CNB檢查,與常規鉬靶X線相比在確定致密型乳腺病灶方面更具優勢,尤其適用于我國女性[11]。考慮到鉬靶X線和磁共振成像檢查所確定病灶與超聲存在一定差異,故本研究中排除鉬靶X線和磁共振成像檢查特征表現。本研究納入180例單純DCIS患者,術后病理組織學診斷升級為乳腺微浸潤癌和乳腺浸潤癌分別為39例(21.67%)和40例(22.22%);DCIS合并微浸潤和DCIS合并可疑微浸潤患者術后病理組織學診斷升級為乳腺浸潤癌分別為42例(65.63%)和20例(62.50%);術前經超聲引導下CNB檢查診斷DCIS伴微浸潤和DCIS可疑微浸潤的患者中,術后病理組織學診斷為單純DCIS的比例較低,故以上病例亦不納入Logistic回歸模型多因素分析。
本研究單因素分析結果顯示,低估組的腫瘤直徑>3 cm、核分級高、HER-2表達陽性的比例高于未低估組;多因素Logistic回歸分析結果顯示,腫瘤直徑>3 cm、核分級高、HER2陽性是術前CNB診斷單純DICS患者病理組織學低估現象發生的獨立危險因素(P<0.01),其中存在腫瘤直徑>3 cm和核分級高者發生病理組織學低估現象風險更高。Yoo等[12]研究發現,組織學分級、腫瘤直徑對預測術前CNB診斷DCIS病理學低估有較大價值;同時有報道認為腫瘤直徑>2 cm即屬于危險因素,而腫瘤直徑>5 cm者病理組織學低估發生風險高于腫瘤直徑>2 cm者,提示腫瘤直徑越大,穿刺取材及診斷結果準確性受限亦越大[13]。基于以上證據認為,腫瘤直徑較大的患者腫瘤穿刺時應考慮增加取材組織數量,以提高診斷結果的準確性。有研究顯示,核分級高是乳腺癌根治切除術中切緣陽性最重要的獨立危險因素,進一步說明高級別DCIS生物學侵襲性較中低級更高,更易出現病理組織學低估現象和區域淋巴結轉移[14-15]。此外,國外多項研究證實HER2過表達與乳腺癌術前活檢病理組織學低估發生密切相關[16-18]。本研究結果顯示,HER2陽性是單純DICS患者病理組織學低估現象發生的獨立危險因素,與上述觀點一致。
本研究將所確定的單純DICS患者術前CNB病理組織學低估獨立危險因素進行組合,其中合并腫瘤直徑>3 cm、核分級高及HER-2表達陽性單純DCIS患者病理組織學低估例數顯著高于其他組合。張春等[19]建議,對于腫瘤直徑>1 cm的乳腺病變應進一步手術切除,以避免CNB漏診;曹威等[20]研究認為核分級高是術前單純DCIS病理學低估的危險因素,本研究結果與上述研究結果一致。因此,合并腫瘤直徑>3 cm、核分級高及HER-2表達陽性的患者治療前推薦先行腋窩淋巴結活檢評估轉移情況。本研究亦存在一定的不足:①屬于單中心、回顧性研究,且納入樣本量較少,無法避免選擇偏倚,可在后續積累更多樣本量進行確證;②研究中因早期病例缺乏遠期隨訪數據,難以對患者遠期預后及預測指標進行評價,仍需更長隨訪數據給予支持。
綜上所述,單純DICS患者術前CNB病理組織學低估現象發生與腫瘤直徑、核分級及HER2受體表達狀態密切相關,對于腫瘤直徑>3 cm、核分級高與HER2表達陽性者術中均需行腋窩前哨淋巴結活檢。

