miR-499-5p靶向調控鈣通道電壓依賴性β1蛋白在慢性心房顫動、心房重構中的作用研究
李世櫻,楊玲英 ,張棟梅,劉 勇
(1.簡陽市人民醫院超聲科,四川 簡陽 641400; 2.昆明醫科大學附屬心血管病醫院,云南 昆明 650000)
心房顫動(Atrial fibrillation,AF)是多種因素造成的心房結構的改變,進而以快速無序的顫動波代替整齊有序的電傳導致使心律失常的一種心血管疾病,簡稱房顫[1]。研究[2]表明房顫導致的心房電活動紊亂,促使患者出現血栓、心力衰竭、心房變性、外周血管栓塞、心動過速性心肌病,甚至缺血性腦卒中等嚴重危及生命的并發癥。目前房顫的發病機制尚未完全闡明,現有的治療手段和藥物不能使所有患者受益。因此尋找預防和控制房顫的手段,開展個體化的靶向治療,在臨床上具有重大意義。小分子RNA(microRNA,miRNA)是一類具有調控功能的內源性非編碼單鏈RNA。研究[3]表明,多種miRNA如miR-1、miR-133等因能調控心臟離子通道、鈣離子結合蛋白、轉運蛋白等相關基因的表達與心房顫動直接相關。近來miR-499-5p在心房顫動患者的表達異常引起關注。崔淯夏等[4]研究表明房顫患者在射頻術后外周血中miR-499-5p的表達明顯降低,推斷miR-499-5p可能成為房顫診斷與治療的靶點,但是就miR-499-5p對房顫影響的機制報道較少。L型鈣通道是細胞進行鈣離子交換的主要途徑。研究[5]顯示L型鈣通道的異常直接導致心臟鈣平衡受損,進而使心房結構發生改變,誘發心房電重構。鈣通道電壓依賴性β1蛋白(Calcium channel voltage-dependent β1protein,CACNβ1)是L型鈣通道蛋白的β亞基。Kumfu等[6]報道提高CACNβ1的表達能明顯改善地中海缺血小鼠的心血管障礙,阻止心房有效不應期(Atrial effective refractory period,AERP)的縮短,抑制心房結構的重構。本研究通過建立心房顫動的動物模型,從心房電重構的角度探討miR-499-5p和 CACNβ1在房顫中的作用,希望為房顫的臨床治療提供一個新的靶向位點。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物:60只新西蘭雄性大白兔,體重2.5~3.2 kg,由我院實驗動物中心從四川大學實驗動物中心采購,動物的使用許可證號:SYXK(川)2018-185。
1.1.2 主要試劑:rAAV9-miR-499-5p-inhibitors、陰性對照rAAV9-miR-499-5p-inhibitors-NC由上海吉瑪生物有限公司設計完成。異氟烷、多聚甲醛采購自Sigma公司;HE試劑盒、JC-1試劑盒購自聯科生物技術公司;蘇木精-伊紅染色(Hematoxylin-eosinstaining,HE)試劑盒購自南京建成生物技術公司;兔抗GAPDH、山羊抗兔IgG采購自美國abcam公司;Western blot試劑盒購自德國Rebstock公司。
1.1.3 主要儀器:Step One Plus熒光定量PCR儀,美國ABI公司產品; Nikon Eclipse Ti-SR熒光顯微鏡,日本尼康公司產品;Bio-rad凝膠成像系統,美國Bio-rad公司產品;TECNAI G2 20電鏡,美國TWIN FEI公司產品。
1.2 實驗方法
1.2.1 模型構建和分組處理:將新西蘭大白兔用隨機數字表法隨機分成四組(n=15):假手術組(sham組)、模型組、miR-499-5p-inhibitors-NC組(對照組)和miR-499-5p-inhibitors組(實驗組)。模型組、對照組、實驗組參照文獻方法[7],將實驗兔以仰臥位固定在手術臺上,常規備皮,沿第3、4肋間,備皮,開胸,逐層剝離,暴露心臟,采用結扎左心耳的方法,將動物心臟起搏器(起搏電壓5 V,起搏頻次600次/min)以及電生理刺激儀測試電極(保證電極導線與心房肌接觸良好)固定在左心房上,引出電極,關胸,縫合傷口。用慶大霉素沖洗起搏器囊袋,并固定在動物背部脊柱旁。將起搏器和起搏電極連接固定,測試電極置于皮下,以測電生理指標。術后所有動物靜脈滴注青霉素抗感染。sham組開胸后只是固定心房電極,不起搏。模型組、對照組、實驗組心房持續起搏3周后(每日對實驗動物進行心電圖檢測,以確保起搏器正常工作),常規喂養一周。術前48 h,對照組和實驗組分別以30 mg/kg劑量心臟冠脈注射[8]rAAV9-miR-499-5p-inhibitors-NC和rAAV9-miR-499-5p-inhibitors,另外兩組大白兔心臟冠脈注射等劑量的PBS緩沖液。實驗過程中,sham組無死亡,模型組動物術中因氣胸導致縱膈擺動死亡2只,對照組動物在復查心電圖中,發現一只因起搏閾值過高未能誘發房顫,實驗組1只術中死亡,2只因起搏器電極脫位未能誘發房顫,因此每組動物均以10只納入實驗觀察。
1.2.2 心臟超聲檢査各組大白兔心臟結構和功能的變化:將實驗動物以異氟烷腹腔注射麻醉,固定于手術臺,心臟彩超檢查心臟功能。記錄左心房最大容積(Left atrial maximal volume,LAVmax),左心房最小容積(Left atrial minimal volume,LAVmin),左心房射血分數(Left atrial ejection fraction,LAEF),左心房內徑(Left atrial diameter,LAD)等數據[9]。
1.2.3 各組實驗大白兔電生理指標AERP和房顫誘發率的測定:實驗兔起搏3周后的AERP以S1S2程序遞減刺激法,輸出電壓的一半為起搏閾值通過電生理刺激儀進行測定150 ms基礎周長時的AERP150,設置S1S2間隔遞減掃描(S1S2=10∶1,步長=10 ms),重復測定3次。以40 ms 周長Brust刺激心房10 s,以2.5倍閾值起搏,房顫持續時間大于1 s為成功誘發房顫,每只實驗動物誘發4次,間隔時長30 s,成功誘發房顫的動物只數與Brust刺激動物總只數的比值即為房顫誘發率[10]。
1.2.4 各組大白兔心肌組織病理學以及超微結構觀察:測試完畢,處死動物,剝離心臟,取出10%心肌組織,常規固定,室溫下,HE染色,上熒光顯微鏡進行觀察。取出10%心肌組織,制成厚度約為2 mm的切片,TECNAI G2 20電鏡下觀察實驗動物心肌細胞超微結構的改變。將余下動物的心臟組織轉入深冷冰箱中待測。
1.2.5 JC-1染色法檢測各組大白兔的心肌細胞線粒體膜電位的變化:從冰箱中分別取出各組動物10%的心肌組織,均漿,裂解,按線粒體提取試劑盒要求提取線粒體,JC-1工作液染色后,封片,鏡檢,Image-Pro Plus 6.0軟件分析圖像,以紅色熒光與綠色熒光的比值來評定各組大白兔心臟組織線粒體膜電位變化。
1.2.6 qRT-PCR檢測miR-499-5p和靶向鈣通道電壓依賴性β1蛋白(CACNβ1)的mRNA的表達:從冰箱中取出各組動物10%的心肌組織,采用常規方法提取心臟標本中組織細胞的總RNA,PCR儀測定目標序列的表達量。目的基因[11]miR-499-5p(上游引物為5’- GACAACATACTGCTAACCGACTC-3’,下游引物為5’- TCACTCTTCACCTGCTCCACTG-3’),CACNβ1的mRNA(上游引物為 5’- TCTACGCAGTGCTTCTTTGCC-3’,下游引物為 5’- AAGGGGGATCTTCAGCTTTAGTA-3’)。
1.2.7 Western blot檢測各組大白兔心肌組織中CACNβ1蛋白的表達:從冰箱中取出各組動物10%的心肌組織,按照常規提取目標蛋白,裂解勻漿器后離心,測定濃度。電泳,轉膜,封閉2 h,加入一抗(均為1∶1000),4 ℃孵育,過夜。次日,洗滌,加入二抗稀釋液(均為1∶10000),顯色,以GAPDH作為內參來表達目的蛋白的相對表達。
1.2.8 熒光素酶報告基因分析:以miR-499-5p mimic和mimic control轉染人胚胎腎細胞(HEK293)細胞,待細胞培養24 h后,洗滌細胞,用含有目的蛋白CACNβ1的3’-非翻譯區(3’-untranslated region,UTR)或突變重組(pGL3-CACNβ1-MUT)載體以及Renilla標準化對照pGL3再次轉染,通過熒光素酶檢測試劑盒(Dual-Glo luciferase assay system)檢測在48 h后測量細胞的熒光強度,對應熒光素酶活性數值為求出螢火蟲熒光素酶/海腎熒光素酶數據比值的平均數。
1.3 統計學方法 數據采用SPSS 16.0統計學軟件進行,作圖工具采用Graphpad 5.01軟件,兩兩組間比較采用t檢驗,P<0.05表示差異具有統計學意義。
2 結 果
2.1 實驗動物的心電圖監測結果以及電生理參數比較 各組大白兔心電圖監測如圖1所示,與sham組相比,模型組的AERP150明顯降低(P<0.05),與模型組相比,抑制miR-499-5p的表達后,實驗組的AERP150明顯升高(P<0.05)。模型組與對照組相比,差異不具有統計意義(P>0.05)。
sham組大白兔為竇性心律,經burst刺激未能誘發心房房顫,模型組以及對照組大白兔經burst刺激后成功誘發房顫(持續時間不短于30 min)房顫誘發率明顯升高(P<0.05),與模型組相比,實驗組的房顫誘發率明顯下降(P<0.05)。模型組與對照組相比,差異不具有統計意義(P>0.05)。

A:sham組;B:模型組;C:對照組;D:實驗組。與sham組相比,*P<0.05;與模型組相比,#P<0.05
2.2 心臟彩超檢測各組大白兔的心功能變化 心臟彩超結果如圖2所示,與sham組相比,模型組左心房的LAD,LAVmax,LAVmin明顯升高(P<0.05),與模型組相比,實驗組動物的LAD、LAVmax、LAVmin明顯降低(P<0.05)。模型組與對照組相比,差異不具有統計學意義(P>0.05)。
2.3 實驗大白兔的心臟損傷病理以及心肌細胞的超微結構觀察 HE染色結果如圖3所示,sham組心肌纖維呈帶狀分布,細胞結構完整,胞核性狀規則的定位于肌纖維中央,間質無水腫情況,細胞連接緊密;模型組、對照組動物心肌纖維排列紊亂,心肌橫紋消失,核質界限不清,核膜破裂,間質水腫明顯;與模型組心肌纖維的排列相比,實驗組明顯規整,肌纖維變性較輕,間質水腫明顯緩解。超微結構結果如圖4所示:sham組心肌細胞結構完整,排列整齊,性狀規整,核膜完整,胞核性狀規整,胞質內線粒體以及肌漿網數量豐富,線粒體嵴結構清晰可辨,無腫脹,無異常;與sham組相比,模型組、對照組動物心肌纖維溶解明顯,胞核明顯擴張,變形明顯,線粒體出現空泡樣變性,嵴結構不規則,或融合、或缺失、或重疊嚴重,胞膜凹陷明顯;實驗組動物的心肌線粒體損傷明顯緩解,嵴結構損傷程度較模型組明顯減輕,心肌纖維排列較為規則,病變程度明顯得到緩解。

A:sham組;B:模型組;C:對照組;D:實驗組。與sham組相比,*P<0.05;與模型組相比,#P<0.05
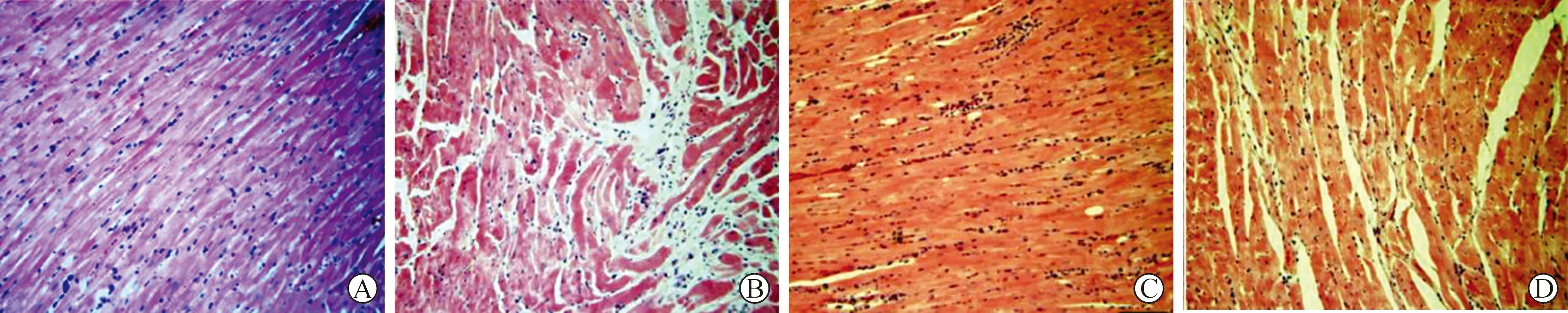
A:sham組;B:模型組;C:對照組;D:實驗組
2.4 JC-1染色法檢測各組大白兔的心肌細胞線粒體膜電位的變化 各組大白兔心肌線粒體膜電位的檢測結果如圖5所示,與sham組相比,模型組動物心肌細胞紅色熒光與綠色熒光的比值明顯降低,說明線粒體膜電位明顯降低(P<0.05);與模型組相比,實驗組大白兔心肌細胞紅色熒光與綠色熒光的比值明顯升高,說明線粒體膜電位明顯升高(P<0.05)。模型組與對照組相比,差異不具有統計意義(P>0.05)。
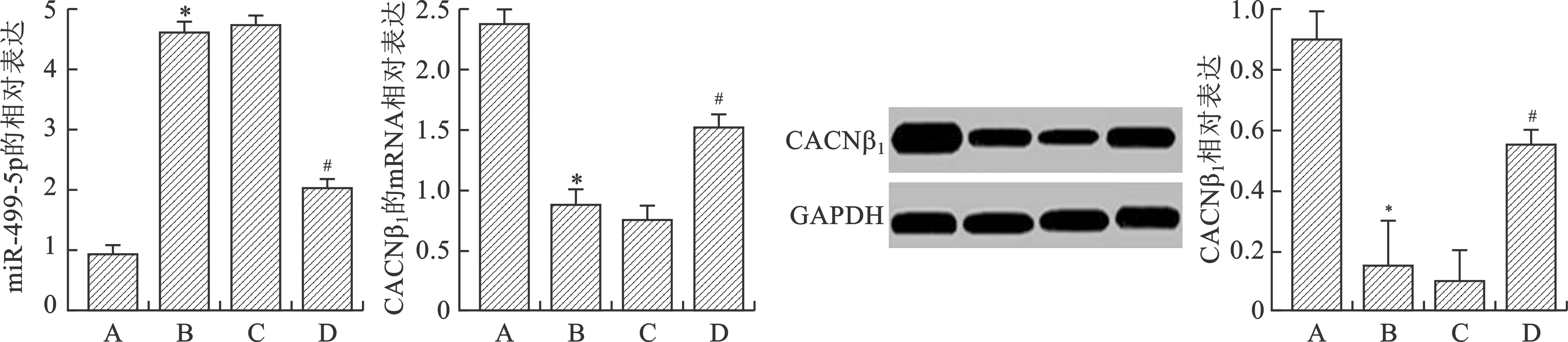
2.5 各組大白兔心肌中miR-499-5p和CACNβ1的mRNA和蛋白的表達情況 各組大白兔心肌中的miR-499-5p和CACNβ1的mRNA和蛋白的表達結果如圖6所示,與正常組相比,模型組miR-499-5p的表達明顯升高,CACNβ1的mRNA和蛋白的表達明顯降低(P<0.05);和模型組相比,實驗組和對照組miR-499-5p的表達明顯降低,CACNβ1的mRNA和蛋白的表達明顯升高(P<0.05)。實驗組和對照組比較,蛋白表達差異無統計學意義(P>0.05)。
2.6 熒光素酶報告基因分析結果 miR-499-5p和CACNβ1的蛋白和mRNA的變化趨勢具有明顯的關聯性,通過生物信息網站(www.microrna.org)上查詢miR-499-5p和CACNβ1存在特異性結合位點。采用雙熒光素酶報告基因分析來觀察兩者的關系結果如圖7示,轉染miR-499-5p后,野生型CACNβ1的熒光素酶活性被抑制(P<0.05),突變型CACNβ1的熒光素酶活性無明顯變化(P>0.05),說明 miR-499-5p能靶向調控CACNβ1的表達。

A:sham組;B:模型組;C:對照組;D:實驗組。與sham組相比,*P<0.05;與模型組相比,#P<0.05
A:sham組;B:模型組;C:對照組;D:實驗組。與sham組相比,*P<0.05;與模型組相比,#P<0.05

圖7 miR-499-5p靶向調控CACNβ1的表達
3 討 論
目前隨著人口老齡化的進程,發病率以及致殘率逐年升高的房顫,成為威脅公眾健康的重要疾病。隨著將導管射頻消融術的出現,房顫的治療技術有了較為明顯的提高,但是其費用昂貴、操作要求嚴格以及設備的限制,難以使所有的患者獲益[12]。房顫的分子生物學機制,闡明其發展歷程,尋求房顫治療的新方案,改善患者的心臟功能,仍是臨床醫師面臨的重大挑戰。
最新的研究顯示[13]心房重構主要是由病理損傷或者負荷改變導致的心臟大小、形狀、組織以及功能等隨之改變,是心房修復、繼發以及代償性疾病的生理病理進程。研究表明心房重構是心房顫動的基礎病理改變。越來越多的實驗證實[14]了miRNA直接參與心房重構的病理學進程。Lan等[15]研究表明作為內源性的調控基因,miR-101通過調控心肌細胞的離子通道蛋白的合成,干預跨膜離子流,影響心肌細胞的觸發活性,進而影響心房的電重構;Yun等[16]研究證實miR-34a能影響膠原纖維的積聚,調控膠原蛋白的表達,影響心房的結構重構。miR-499-5p與心血管疾病的關系引起廣泛關注。Xin等[17]研究表明作為肌球蛋白Myh7b基因家族中成員,miR-499-5p在急性心肌梗死患者的外周血中高表達,過表達的miR-499-5p影響鈉離子通道蛋白的表達,誘發了心房電重構。Silva等[18]研究報道在心肌缺血再灌注損傷大白兔模型中抑制miR-499-5p的表達,能增強心肌細胞中線粒體膜的穩定性,改善動物在損傷中的心臟重構。本研究中冠脈注射rAAV9-miR-499-5p-inhibitors后,實驗組動物的AERP150明顯升高,房顫誘發率明顯下降,動物的心房電重構明顯受限。病理學以及超微結構觀察結果顯示,實驗組動物的心肌損傷以及線粒體損傷明顯緩解,線粒體膜電位有所恢復,證實抑制miR-499-5p的表達后,慢性房顫實驗兔的心房重構有所改善。
L型鈣通道是控制鈣離子進出心肌細胞的電壓依賴性的通道。該通道與心肌細胞的物質與能量代謝中的生理活動密切相關[19]。王增夏等[20]報道作為L型鈣通道的關鍵結構成分,CACNβ1能夠調控心肌細胞的L-鈣電流,直接影響房顫進程。高杰等[21]通過表達譜芯片技術以及miRNA芯片分析顯示與健康成人相比,CACNβ1基因在永久性房顫患者的左房組織中的表達明顯降低。Ling等[22]研究證明CACNβ1和miR-499在對慢性房顫的中具有潛在的臨床診斷價值。本研究從生物信息網站獲知miR-499-5p和CACNβ1之間存在特異性結合位點,雙熒光素酶報告基因分析結果顯示miR-499-5p能靶向調控CACNβ1的表達,并且抑制miR-499-5p的表達后實驗組動物心肌中CACNβ1的表達明顯升高。
綜上所述,miR-499-5p在慢性心房顫動動物模型動物中表達升高,抑制其表達能明顯改善動物的心臟功能,抑制其心房重構,這可能與靶向調控CACNβ1的表達有關。但是如何將miR-499-5p的靶向作用應用到房顫的臨床治療中還需更深入的研究。

