中和滴定曲線解讀
>>>董鴻志
中和滴定曲線是對中和滴定過程定量化、圖形化的表示,曲線上的點幾乎覆蓋了中學常見電解質溶液的各種組成,隱含信息豐富,是高考考查溶液中離子濃度關系和電離常數(shù)、水解常數(shù)的常見題型。
一、中學常見中和滴定曲線形式
中和滴定曲線形式很多,下面列舉幾種常見曲線圖,其中圖1—圖3是基本形式,描述溶液pH值在滴定過程中的變化,當反應完成時會出現(xiàn)pH值突躍。一般說來,堿滴定酸時,如果是多元弱酸,會出現(xiàn)多個pH值突躍(如圖3),且相同濃度下,酸越強,pH值突躍范圍也就越大(如圖2)。圖4—圖6是各種變式中比較重要的,描述滴定過程中兩個相關物理量之間的關系。
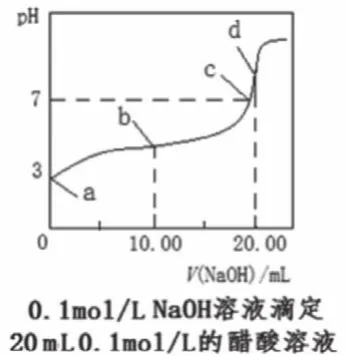
圖1
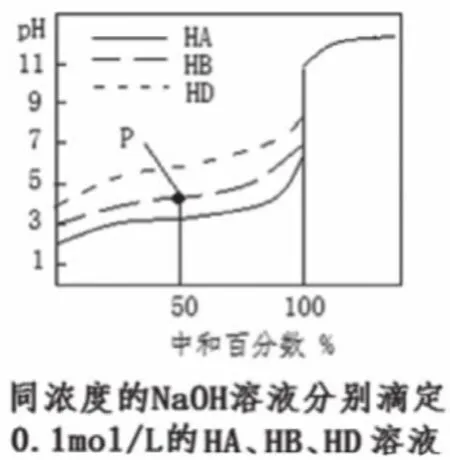
圖2
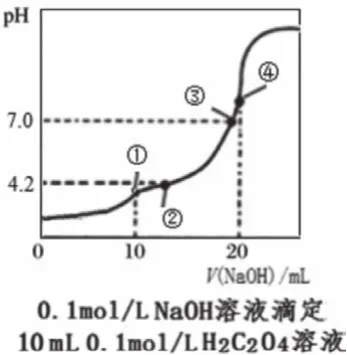
圖3
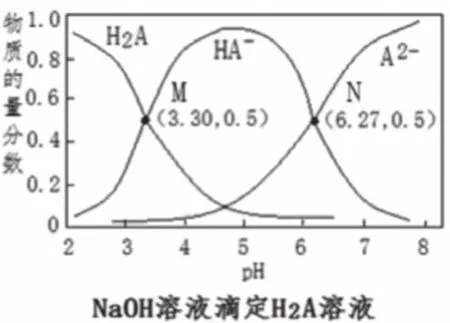
圖4
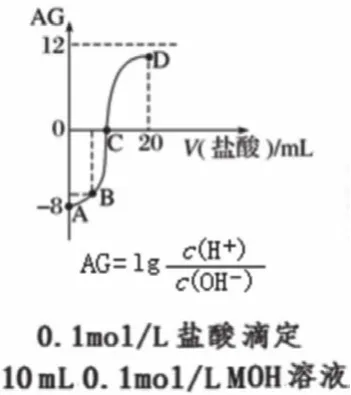
圖5
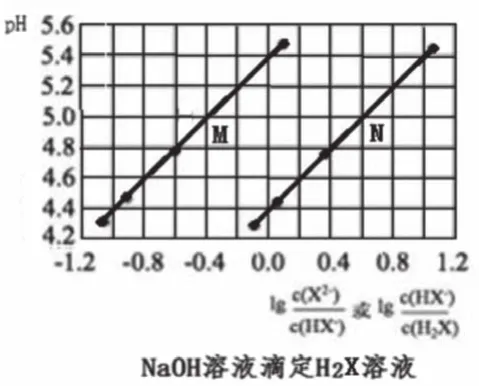
圖6
二、中和滴定曲線的關鍵點分析
1. 起點
此時溶液中溶質是酸(如CH3COOH)或堿(如NH3·H2O)。
根據(jù)起點的pH可以判斷酸或堿的強弱。如圖2中,三種酸HA、HB、HD濃度均為0.1mol/L,但是pH均大于1,說明三種酸均為弱酸,且pH越小,酸性越強,酸性HA>HB>HD;若是堿,則pH越大,堿性越強。
根據(jù)起點溶液pH值,可以計算酸或堿的電離常數(shù)。如計算圖2中HB的電離常數(shù)Ka。
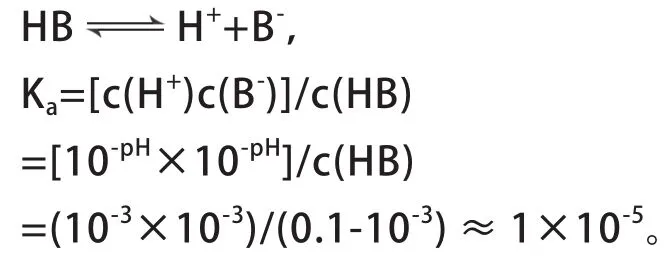
2. 中和點
中和點是恰好反應的點,根據(jù)化學計量數(shù)確定對應的酸堿用量,在圖中找出相應的點,如圖1中的d點、圖3中的④點等。此外,利用滴定反應的特征,也可以根據(jù)溶液溫度最高點、中和百分數(shù)為100%等確定中和點。如果是二元弱酸的滴定,會有兩個中和點,分別對應酸式鹽和正鹽(如圖3中的①點和④點)。需要說明的是,中和點不能通過直接觀察得知,常借助于指示劑的顏色變化來確定反應完成從而終止滴定,指示劑的變色點即為滴定終點,中和點和滴定終點之間有微小誤差。中學階段用滴定曲線進行判斷、計算時,通常忽略誤差。
中和點溶質一般是鹽(如CH3COONa、NH4Cl、NaHA、Na2A等)。
根據(jù)中和點鹽溶液的pH可判定形成鹽的酸、堿的相對強弱,以及溶液中離子濃度的大小關系。如圖2,HA、HB、HD的中和點的pH均大于7,且依次增大,則HA、HB、HD均為弱酸且酸性依次減弱。二元弱酸的滴定中,根據(jù)恰好生成酸式鹽時溶液的pH判斷酸式酸根離子的電離和水解程度的相對大小,如圖3的①點pH<7,判斷出NaHC2O4顯酸性,因此HC2O4-的電離程度大于水解程度,從而判斷溶液中離子濃度的大小。
根據(jù)中和點鹽溶液的pH,可計算水解常數(shù)、電離常數(shù)。如圖1的d點,若pH=m,則c(H+)=10-m,c(OH-)=10m-14,根據(jù)CH3COONa水解反應c(OH-)]/c(CH3COO-)=(10m-14×10m-14)/(0.05-10m-14),Ka=Kw/Kh,代入即可求得。
3. 中性點
中性點是指c(H+)=c(OH-),常溫下pH=7的點,如圖3的③點、圖5的C點。當反應生成可水解的鹽時,中性點常見的溶液組成是鹽與少量弱電解質混合。例如,用同濃度的NaOH溶液滴定CH3COOH溶液,達到中性點時,溶液中溶質為CH3COONa與少量CH3COOH;如果用同濃度的鹽酸滴定NH3·H2O溶液,達到中性點時,溶液中溶質為NH4Cl與少量NH3·H2O。
中性點常用于代入電荷守恒,判斷鹽中的陰陽離子濃度關系。如圖3的③點,根據(jù)c(H+)+c(Na+)=c(OH-)+2c(C2O42-)+c(HCO4-),得出c(Na+)=2c(C2O42-)+c(HCO4-)。
4. 等料點
等料點是指滴定反應完成一半的點,如圖1中的b點、圖2中的P點,此時溶液中的溶質是酸(堿)與鹽等物質的量濃度的混合點。“料”表示“物料”,此點遵循物料守恒,2c(Na+)=c(酸分子)+c(酸根離子)。
根據(jù)此點的pH值,可判斷弱酸(弱堿)的電離與鹽的水解能力的相對大小,再根據(jù)Ka×Kh=Kw,粗略判定電離常數(shù)或水解常數(shù)的大小。
如圖2中的P點,當中和百分數(shù)為50%時,一半的HB被中和生成NaB,還剩余一半的HB,則溶液相當于等物質的量濃度的NaB與HB的混合液。觀察滴定曲線,此時的pH<7,則B-的水解能力小于HB的電離能力,常溫下 Ka(HB)>10-7,此時,c(B-)>c(HB),若要c(B-)=c(HB),NaOH溶液的用量比此點用量略少。反之,假如此時的pH>7,則B-的水解能力大于HB的電離能力,常溫下Ka(HB)<10-7,此時c(B-)<c(HB),若要c(B-)=c(HB),NaOH溶液用量比此點用量略多一點。
5. c(酸根離子)=c(酸分子)的點
像圖1—圖3這樣的滴定曲線基本形式不易表示出此點,一般此點出現(xiàn)于滴定曲線的各種變式中。如圖4的M、N點,圖6中曲線M、N上橫坐標為0的點。
圖6中,橫縱標為0時,M曲線的pH=5.4,N曲線的pH=4.4,分別計算出M曲線對應的Ka=10-5.4,N曲線對應的Ka=10-4.4。根據(jù)二元弱酸Ka1=[c(HX-)c(H+)/c(H2X)] >Ka2=[c(X2-)c(H+)/c(HX-)],則曲線N表示pH與lg[c(HX-)/c(H2X)]的變化關系,曲線M表示pH與lg[c(X2-)/c(HX-)]的變化關系。
三、利用滴定曲線解決電解質溶液問題的思路和方法
中和滴定曲線是解決電解質溶液相關問題的圖形依據(jù),要用好滴定曲線上的關鍵點,從關鍵點獲取有關電解質溶液的相關信息,進行正確的定性和定量判斷,主要有三步:
1. 準確識圖
觀察曲線形式、走向和橫縱坐標,明確曲線的化學意義。
2. 選取關鍵點
觀察曲線中給定數(shù)據(jù)的點,判斷它是滴定曲線上的哪個關鍵點,明確對應的溶液溶質組成和性質特點。
3. 定性、定量判斷
對選取的關鍵點,結合電荷守恒、物料守恒、質子守恒、Ka及Kh的計算式、與對數(shù)相關的數(shù)學計算等,解答相應問題。
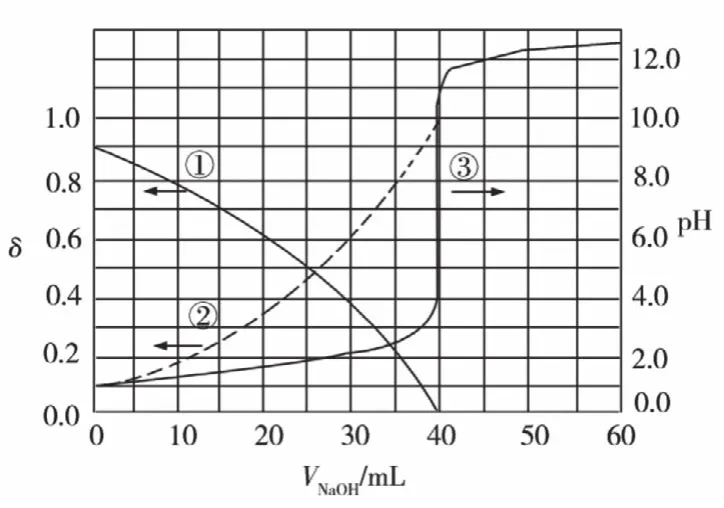
例1.(2020年全國卷I,13題)以酚酞為指示劑,用0.1000 mol·L-1的NaOH溶液滴定20.00 mL未知濃度的二元酸H2A溶液。溶液中,pH、分布系數(shù)δ隨滴加NaOH溶液體積VNaOH的變化關系如下圖所示。
[比如A2-的分布系數(shù):
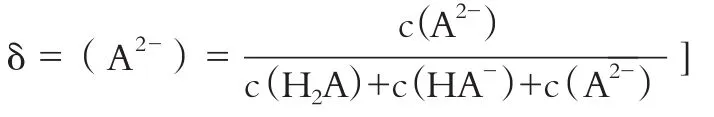
下列敘述正確的是
A.曲線①代表δ(H2A),曲線②代表δ(HA-)
B.H2A溶液的濃度為0.2000 mol·L-1
C.HA-的電離常數(shù)Ka=1.0×10-2
D.滴定終點時,溶液中 c(Na+)< 2c(A2-)+c(HA-)
【答案】C
本題為雙縱坐標的二合一圖像,出現(xiàn)新名詞“分布系數(shù)”,且H2A不同于一般的二元弱酸,是罕見的第一步全電離、第二步部分電離,創(chuàng)新性非常強。但是認真分析發(fā)現(xiàn)其圖像就是圖1與圖4的疊加,其解決過程依然源自對中和滴定曲線的深刻認知,分析過程如下:
步驟一,準確識圖。
觀察圖像,這是將NaOH溶液滴定H2A溶液的滴定曲線及H2A溶液分布系數(shù)的變化合二為一的圖像,是雙縱坐標,左邊為分布系數(shù),右邊是pH。
步驟二,選取關鍵點。
圖中起點(二元酸)、兩條分布系數(shù)曲線的交點(兩微粒濃度相等的點)和滴定終點(二元酸對應的鹽)數(shù)據(jù)清晰,可用于計算。
步驟三,定性、定量判斷。
四個選項圍繞H2A展開,因此,首要問題是判斷H2A是什么樣的二元酸。
從分布系數(shù)看,H2A若是二元強酸,則起點溶液中只存在A2-,現(xiàn)在起點分布系數(shù)顯示有兩種微粒,因此H2A不是二元強酸。從弱酸角度看,如果H2A溶液中存在則起點粒子有三種H2A、HA-、A2-,而起點只給出兩種粒子的分布系數(shù),且隨滴定的進行,到達滴定終點時一種粒子的分布系數(shù)為1,另一種粒子的分布系數(shù)為0,表明只有這兩種粒子,于是我們可以推測H2A第一步全電離,第二步部分電離,兩種粒子是 HA-、A2-。
利用滴定終點,H2A+2NaOH=Na2A+2H2O,V(NaOH)=40mL,計算:
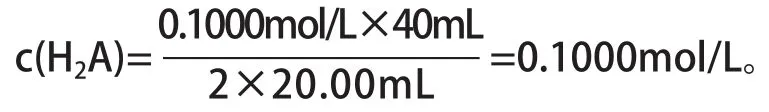
再看起點,pH≈1,且略小,證實上述關于H2A的推測是正確的。
A.滴定時,HA-與OH-反應生成A2-,δ(HA-)隨著NaOH的滴入逐漸減小,在滴定終點幾乎為0,為曲線①;δ(A2-)逐漸增大,在滴定終點接近1,為曲線②。A錯誤。
B.根據(jù)分析,c(H2A)=0.1000mol/L,B錯誤;
D.用酚酞作指示劑,酚酞變色pH范圍為8.2~10,終點時溶液呈堿性,c(OH-)>c(H+),溶液中的電荷守恒為c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),則c(Na+)>2c(A2-)+c(HA-),D錯誤。
綜上所述,運用中和滴定曲線解決溶液中的相關問題,是按照識圖→選點→判斷的思路,緊緊抓住中和滴定曲線的基本知識,根據(jù)各種情況靈活判斷。這種思路和方法,不僅適用于中和滴定,還適用于沉淀滴定、氧化還原滴定、絡合滴定等。

