左乙拉西坦對難治性癲癇幼鼠海馬組織中Slit2、srGAP2 和GAP-43動態表達的影響 ①
王 影,張 洋,劉潔微,趙塔娜,鄒艷紅,聶 磊
(佳木斯大學附屬第一醫院兒科,黑龍江 佳木斯 154003)
癲癇作為一種常見的大腦功能短暫性障礙慢性疾病,其主要是由于人體大腦神經元出現突發性放電而引起的。該病會導致人體出現發作性意識喪失,部分患者常合并認知功能障礙。目前,臨床上關于癲癇的具體發病原因尚未完全明晰[1,2]。雖然傳統的抗癲癇治療方法能夠取得一定的療效,但是其副作用比較大,很容易引起患者出現認知功能損傷[3]。對于難治性癲癇而言,一種標志性的病理學改變就是海馬組織硬化[4]。因此,對海馬組織中的相關指標進行檢測,能夠為臨床治療療效判定提供一定的依據。本研究選擇難治性癲癇幼鼠作為研究對象,探討了左乙拉西坦(Levetiracetam,LEV)對難治性癲癇幼鼠海馬組織中神經軸突導向因子2(Axon guidance factor 2,Slit2)、再生修復關鍵分子2(Key molecules for regeneration and repair 2,srGAP2)、生長相關蛋白43(Growth associated protein43,GAP-43)。動態表達的影響,旨在為探討左乙拉西坦治療難治性癲癇的效果提供一定的參考依據。現報道如下。
1 材料與方法
1.1 實驗動物
選擇我院動物醫學中心培養的192只清潔級Wistar大鼠作為研究對象,體重為190~230g,平均(210.09±12.12)g;將其稱重編號之后,隨機分為空白對照組、模型組(IE組)、治療組(LEV治療組)及LEV對照組,各48只。
1.2 癲癇模型構造方法
采用氯化鋰-匹羅卡品(Licl-pilo)點燃的難治性癲癇大鼠模型96只,將96只大鼠分為IE組、LEV治療組,首先腹腔注射質量濃度為135mg/kg的氯化鋰,18~20h之后與1mg/kg阿托品腹腔注射,30min后再腹腔注射20mg/kg的匹羅卡品,對大鼠行為進行觀察。行為學觀察根據Racine癲癇行為進行分級,即:(1)0級。抽搐癥狀完全停止;(2)1級。嘴與面部發生節律性抽動;(3)2級。出現點頭或者甩尾;(4)3級。單側肢體出現抽動;(5)4級。全面性強制陣攣發作甚至不自主跌倒。出現4級及以上發作即可視為造模成功。持續抽搐30min即可腹腔注射濃度為10%的水合氯醛0.3g/kg止痙,使得死亡率顯著下降。如果發作程度無法達到上述等級,于30min之后再次給予未達到等級的大鼠腹腔注射20mg/kg的匹羅卡品,直至達到發作等級。(空白對照組及LEV對照組為正常大鼠、不予處理)。
1.3 給藥處理
將LEV片劑碾碎,然后將其溶于經消毒的注射用水之中,給予LEV治療組與LEV對照組每日一次灌胃,劑量為200mg/kg,連續灌胃4周,同時給予對照組與IE組同等劑量的濃度為0.9%的生理鹽水灌胃。
1.4 組織取材
造模成功后的1周、2周、4周,每組隨機抽取8只大鼠,10%的水合氯醛麻醉之后斷頭,剪開大鼠的顱骨取出大腦,將大腦的海馬組織分離放入濃度為4%的多聚甲醛溶液加以固定。
1.5 組織的石蠟包埋與切片
將大鼠海馬組織從甲醛溶液取出之后,置于20%的蔗糖融合(4℃)中過夜。在模具中加入液態石蠟,先稍微冷卻,然后再將待包埋的海馬組織置于石蠟之中,并排列整齊,再將塑料模具盒蓋上,最后加入少許液體石蠟,進行冷凍,使石蠟變成固態。將包埋好的組織置于石蠟切片機上,切成厚度約為4.0μm的切片進行免疫組化染色。
1.6 免疫組化法染色
1.6.1 脫蠟水化: 脫蠟之前將組織置于60℃恒溫箱之中烘烤20min,將石蠟切片放入二甲苯I與II中10min進行脫蠟,脫蠟之后放入100%的乙醇5min,95%乙醇5min,90%乙醇5min,85%乙醇5min,80%乙醇5min,75%乙醇5min,60%乙醇5min,50%乙醇5min,30%乙醇5min,自來水1min,雙氧水1min。
1.6.2 抗原修復: 加入3%的H2O2浸泡10min,從而除去內源性的過氧化氫酶,然后倒掉H2O2,在清水中洗兩次,再加入檸檬酸緩沖液,放入微波爐中蒸煮3min,冷卻至室溫,然后再蒸煮一次,冷卻至室溫。
1.6.3 血清封閉: 滴加正常善養血清封閉液室溫20min,甩去多余液體,吸水紙吸取多余水分。
1.6.4 滴加一抗: 滴入稀釋的一抗,于4℃下過夜。
1.6.5 滴加二抗: 將載玻片放入PBS中洗3次,每次5min,擦干組織周圍的PBS溶液后加上二抗,然后置于37℃溫箱中保存30min。
1.6.6 加顯示劑: 擦干組織周圍的PBS之后加入DAB顯色劑顯色5min,于顯微鏡下觀察掌握染色的程度,若存在棕黃色的沉淀,則使用流水沖洗。
1.6.7 復染: 將顯色后的片子使用清水沖洗一段時間之后,浸泡于蘇木精中進行染色,約為0.5min,清水沖洗2min。
1.6.8 脫水: 將復染之后的片子置于水中進行沖洗之后,依次將載玻片放入95%酒精5min,95%酒精5min,100%酒精5min,100%酒精5min,100%酒精5min,二甲苯中5min。充分晾干之后中性樹膠封片。
1.7 觀察指標
1.7.1 臨床療效[5](1)完全控制:無癲癇發作;(2)顯效:與治療前比較,癲癇發作頻次減少程度在75%以上;(3)有效:與治療前比較,癲癇發作頻次減少范圍在50%~74%;(4)無效:與治療前比較,癲癇發作頻次降低范圍在49%以內。
1.7.2 免疫指標變化: 比較LEV治療組與LEV對照組免疫指標(IgA、IgG及IgM)水平,均采用ELISA法進行檢測分析。
1.7.3 比較各組海馬組織Slit2陽性細胞數、srGAP2、GAP-43表達水平。
1.8 統計學方法
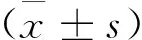
2 結果
2.1 LEV治療組與LEV對照組臨床療效對比
LEV治療組總有效率為89.58%,顯著高于對照組72.92%(P<0.05),見表1。

表1 LEV治療組與LEV對照組臨床療效比較[n=48,n(%)]
2.2 LEV治療組與LEV對照組免疫指標水平對比
兩組大鼠治療后免疫指標(IgA、IgG及IgM)水平較治療前均顯著升高,且LEV治療組上述指標水平也均分別顯著高于LEV對照組治療后(P均<0.05),見表2。

表2 LEV治療組與LEV對照組免疫指標水平比較
2.3 各組大鼠海馬組織Slit2陽性細胞數對比
LEV對照組與對照組各個時間點的Slit2陽性細胞數差異均無統計學意義(P均>0.05),但IE組及LEV治療組各個時間點的Slit2陽性細胞數均分別顯著低于對照組(P均<0.05),LEV治療組各個時間點的Slit2陽性細胞數均分別顯著高于IE組(P均<0.05),見表3。

表3 各組大鼠海馬組織Slit2陽性細胞數比較個/高倍視野×100)
2.4 各組大鼠海馬組織srGAP2蛋白相對表達量對比
LEV對照組與對照組各個時間點的srGAP2蛋白相對表達量差異均無統計學意義(P均>0.05),但IE組及LEV治療組各個時間點的srGAP2蛋白相對表達量均分別顯著低于對照組(P均<0.05),LEV治療組各個時間點的srGAP2蛋白相對表達量均分別顯著高于IE組(P均<0.05),見表4。

表4 各組大鼠海馬組織srGAP2蛋白相對表達量比較
2.5 各組大鼠海馬組織GAP-43免疫組化染色強度對比
LEV對照組與對照組各個時間點的GAP-43免疫組化染色強度差異均無統計學意義(P均>0.05),但IE組及LEV治療組各個時間點的GAP-43免疫組化染色強度均分別顯著低于對照組(P均<0.05),LEV治療組各個時間點的GAP-43免疫組化染色強度均分別顯著高于IE組(P均<0.05),見表5。

表5 各組大鼠海馬組織GAP-43免疫組化染色強度比較
3 討論
癲癇是兒童時期非常常見的一種神經系統性疾病,對兒童身心健康造成十分嚴重的影響。如果發展為難治性癲癇(Refractory status epilepticus,RSE),那么其病死率可高達16%以上[6,7],對患兒自身、家庭乃至整個社會均會造成非常嚴重的后果。Slits家族在神經軸突導向以及神經細胞線,甚至還存在一些軸突連接會反復跨越中線。在對小鼠、雞體外培養試驗研究表明:Slits會排斥神經元軸突,有效確保神經元軸突僅跨越中線1次,準確無誤地達到既定的位置,對軸突反復跨越中線產生異常的網絡結構具有有效地阻止效果。Fang[8]等通過基礎試驗研究證實:在動物造模1d~2周,大鼠海馬組織中的Slit2的陽性細胞數會持續性下降,并認為:Slit2的表達變化主要是對神經元癇性放電的一種適應性改變,而且也表明Slit2表達水平下降后可能會加快游走性局灶性發作(Migrating focal seizures,MFS)的發作,對神經的正常連接產生較大的干擾作用,參與了難治性癲癇的發病過程。
LEV屬于吡咯烷類衍生物的一種常見藥物,患者在服用之后,其吸收快速、生物利用效率高、血漿蛋白結合率低[9]。相關文獻報道稱[10,11],LEV治療癲癇的主要作用機制在于其與中樞神經內突觸囊泡蛋白(Synaptic vesicle protein in central nervous system,SV2A)相結合,從而對突觸內囊泡的胞外分泌功能以及突出前神經遞質釋放具有調節作用。大量臨床研究證實[12,13]:左乙拉西坦能夠有效治療難治性癲癇。本研究結果顯示:LEV治療組與IE組比較,Slit2的陽性細胞數顯著上升,結合Slit2與難治性癲癇發病之間的密切聯系,由此可以推斷LEV治療難治性癲癇的可能機制為:其可通過升高Slit2表達水平,對大鼠海馬組織苔蘚纖維化過程具有逆轉或阻止效果,從而可有效抑制異常神經網絡結構的形成過程,使得難治性癲癇發作的敏感度有效降低,進而有效防范難治性癲癇的發生、進展。聶磊等[14]研究發現:左乙拉西坦治療難治性癲癇大鼠療效顯著,且可有效改善大鼠海馬組織中的Slit2表達水平。
臨床關于srGAP2表達水平與難治性癲癇疾病的發生之間的研究較少,但有研究者通過分析面神經橫斷后初期srGAP2mRNA可以得知,其在3d~4周之內表達水平會迅速升高,表明srGAP2在軸突再生過程中扮演著十分重要的角色[15]。此外,還有研究表明:srGAP2在神經細胞發展過程中起到十分重要的作用[16,17]。相關研究發現:GAP-43參與了軸突損傷后的再生過程[18]。既往研究結果顯示:GAP-43在Wistar大鼠大腦海馬組織中的表達水平會上升,原因可能為該組織突觸結構的可塑性處于高位水平[19]。Caprini[20]研究結果顯示:GAP-43可以誘導人后根神經內Ca2+濃度升高,而臨床上常將細胞內Ca2+濃度上升作為癲癇大鼠模型細胞凋亡的一個重要標志性指標,因此,認為GAP-43可能會對癲癇的發作具有促進效果。
綜上所述,LEV對難治性癲癇幼鼠療效較為理想,可能是通過調節鼠馬組織中Slit2 、srGAP2 和GAP-43動態表達水平而發揮效果。

