烏帕替尼對氧糖剝奪/復氧后BV2 細胞極化的影響
宋志兵,張 倩,章越凡,邱 彥,李鐵軍 (1. 安徽中醫藥大學藥學院,安徽 合肥 001;. 海軍軍醫大學
藥學院藥理學教研室,上海 200433;3. 上海市浦東新區人民醫院,上海 201200;4. 上海市浦東新區浦南醫院藥劑科,上海200125)
小膠質細胞是參與防御腦缺血再灌注損傷的主要免疫細胞,在中樞神經系統修復和神經發生中發揮重要作用。在缺血性中風發生后,小膠質細胞表型往往會發生改變[1-2]。小膠質細胞經活化后會極化為促炎M1 型和抗炎M2 型兩種表型[3-4]。抗炎型小膠質細胞能通過減輕炎癥反應、清除細胞碎片和釋放神經營養因子來促進大腦的恢復。然而小膠質細胞除了具有神經保護作用外,還是大腦中促炎細胞因子的主要產生者。促炎型小膠質細胞能通過啟動炎癥級聯反應釋放大量的炎性細胞因子引起炎癥反應,阻礙大腦恢復過程[5-6]。
烏帕替尼(upadacitinib)是一種口服的、可逆的JAK 激酶(Janus kinase)抑制劑,對JAK1 有較強的選擇性,已被批準用于治療類風濕關節炎[7-9],目前臨床研究正在評估幾種免疫介導的炎癥性疾病、克羅恩病、潰瘍性結腸炎等炎癥相關疾病[10-11]。有報道稱小膠質細胞的極化與JAK/STAT 信號通路有關[12-13],卻沒有對于JAK1 選擇性抑制劑烏帕替尼在神經系統應用方面的報道。本研究通過使用BV2 小膠質細胞OGD/R 模型,探討烏帕替尼對BV2 小膠質細胞極化的影響及其可能的作用機制。
1 材料
1.1 細胞株
BV2 細胞和PC12 細胞均購自中科院上海細胞庫,培養條件:高糖型DMEM 培養基,含10%胎牛血清(FBS),置37 ℃,5%CO2培養箱中。
1.2 儀器
細胞培養箱、酶標儀(Thermo 公司);水平高速離心機(Eppendorf 公司);氧糖剝奪(OGD)裝置(Billups-Rothenberg 公司);實時定量PCR 儀(美國AB7500);Odyssey 雙色激光成像系統(LICOR 公司)。
1.3 藥物與試劑
烏帕替尼(貨號:AK600704,美國Ark Pharm公司);噻唑藍(MTT)試劑盒(塞維爾生物科技有限公司);RNA 提取試劑盒、反轉錄試劑盒(北京全式金生物技術有限公司);SYBR Green(Thermo Fisher);IL-1β、IL-6 和TNF-α 的ELISA 試劑盒(美國R&D 公司);GAPDH、JAK1、p-JAK1、STAT6、p-STAT6 抗體(CST 公司)。
2 方法
2.1 OGD/R 模型的建立
細胞接種在細胞培養板中,培養24 h 待細胞貼壁后,用磷酸緩沖鹽溶液(PBS)將孔內培養基洗凈,更換為無血清無糖的DMEM 培養基,將培養板置于OGD 裝置中,用混合氣體(95%N2+5%CO2)將裝置中空氣置換出來,培養板連同OGD 裝置一起放入37 ℃培養箱中3~4 h 后取出細胞,再更換為含血清的高糖DMEM 培養基繼續培養24 h。
2.2 MTT 法測細胞生存率
待測細胞每孔加入MTT 試劑20 μl,37 ℃孵育4 h 后,將孔內液體吸盡棄去,每孔加入150 μl二甲基亞砜(DMSO),震蕩1 min 使結晶物充分溶解,用酶標儀檢測492 nm 處吸光度值。計算生存率:每孔的吸光度值為該孔實測吸光度值減去空白吸光度值,對照組吸光度均值定為生存率100%,每孔細胞生存率=(該孔吸光度值/對照組吸光度均值)×100%。
2.3 細胞劃痕實驗
BV2 細胞以3×105個/ml 濃度密度接種于六孔板中,待細胞長滿底部后,用200 μl 的槍頭垂直沿直尺過圓心迅速在底部劃痕,用PBS 清洗3 遍將劃下的細胞洗凈,加入無血清無糖DMEM 培養基進行OGD 缺氧3 h,之后更換為無血清高糖培養基恢復氧糖繼續培養24 h,在恢復氧糖期間0、6、12、24 h 拍照觀察遷移變化。劃痕圖片經Image J軟件處理圈出劃痕區域面積S,遷移率=(1-S/S0h)×100%。
2.4 ELISA 檢測炎癥因子
收集細胞培養上清,在4 ℃、14 000/min 離心10 min,以去除細胞或細胞碎屑,吸取澄清的上清培養基做后續檢測。按酶聯免疫吸附測定(ELISA)試劑盒(美國R&D 公司)說明書進行操作,根據標準品吸光度值制作標準曲線,計算出每個樣品吸光度值對應的炎癥因子含量。
2.5 條件培養基共培養體系的建立
將BV2 小膠質細胞正常培養或 OGD 4 h/R24 h后的培養上清液(CM)用原培養基稀釋1 倍后分別加入正常或者OGD 4 h 處理的PC12 神經細胞中,復氧共培養24 h 后采用 MTT 檢測PC12 細胞的生存率。
2.6 實時PCR 檢測mRNA 水平
棄去培養基,用PBS 漂洗一次,六孔板中每孔加入200 μl 的異硫氰酸胍裂解液(TransZol Up),反復吹打使細胞充分裂解,室溫靜置5 min。按全式金RNA 提取試劑盒操作步驟提取RNA,之后按全式金反轉錄試劑盒說明書將RNA 反轉錄成cDNA,儲存于-20 ℃用于后續實驗。反轉錄得到的cDNA使用 7 500 型實時 PCR 儀進行定量分析,本實驗使用內參基因 GAPDH 對模板進行均一化處理。對照組、OGD 組和烏帕替尼組基因之間表達差異通過2?ΔΔCt計算。
2.7 Western blot 檢測蛋白水平
棄去培養基,用預冷的PBS 清洗2 遍,每孔加入50 μl 預冷的RIPA 裂解液,放冰上裂解5 min,收集裂解液,于4 ℃、14 000 g 離心15 min,收集上清。二喹啉甲酸(BCA)試劑盒測定蛋白濃度,用8% SDS-PAGE 膠電泳分離蛋白,濕轉至硝酸纖維素膜上,于封閉液室溫封閉2 h 后,更換為一抗在4 ℃孵育過夜,用等滲緩沖液(TBST)漂洗5 min(3 次),加入熒光二抗室溫避光孵育1 h,漂洗干凈后用Odyssey 雙色紅外激光掃描成像系統對膜進行掃描。圖像條帶通過image J 軟件進行分析,計算蛋白表達量。
2.8 統計學方法
使用SPSS 17.0 軟件進行統計分析,數據用均數±標準差(xˉ±s)表示。采用單因素方差分析檢驗差異的顯著性,P<0.05 表示有統計學意義。
3 結果
3.1 烏帕替尼對OGD/R 誘導的BV2 細胞損傷的影響
結果如圖1 所示,BV2 細胞OGD 3 h 后細胞的生存率較未進行OGD 的對照組明顯降低(P<0.01),給予烏帕替尼后生存率較OGD 組差異無統計學意義(圖1A);在OGD 4 h 后,與對照組相比,OGD 組細胞生存率明顯降低(P<0.01),而與OGD 組相比,烏帕替尼200 μmol/L 濃度下能顯著提高BV2 細胞生存率(P<0.05)(圖1B)。因此,選擇OGD 4 h 作為后續實驗條件,選擇烏帕替尼200 μmol/L 作為后續實驗藥物濃度。
3.2 烏帕替尼對OGD/R 后BV2 細胞極化的影響
結果如圖(圖2)所示,與對照組相比,OGD 組BV2 細胞M1 型標志物:CD11b、CD32、iNOS 的mRNA 水平均明顯增加(P<0.05),而M2 型標志物:Arg-1、IL-10、CD206 的mRNA 水平改變無統計學意義。與OGD 組相比,給予烏帕替尼后CD11b(P<0.01)、CD32(P<0.05)、iNOS(P<0.01)的mRNA水平均顯著減少,M2 型標志物mRNA 水平改變無統計學意義。
3.3 烏帕替尼對BV2 細胞OGD 后遷移能力的影響
從細胞劃痕實驗結果(圖3)中可以看出,與對照組相比,OGD 組BV2 細胞在6 h(P<0.05)、12 h(P<0.05)和24 h(P<0.01)細胞遷移率均明顯增加,而與OGD 組相比,烏帕替尼給藥組在6 h 和12 h細胞遷移率的改變無統計學意義,在給藥24 h 后的細胞遷移率明顯降低(P<0.05)。
3.4 烏帕替尼對BV2 細胞OGD/R 后培養基中炎性因子水平的影響
與對照組相比,OGD 組培養基中IL-1β、IL-6 和TNF-α 水平均明顯升高(P<0.01)。與OGD 組相比,烏帕替尼給藥組IL-1β(P<0.05)、IL-6(P<0.01)、TNF-α(P<0.05)等3 種炎性因子水平均顯著降低(圖4)。
3.5 烏帕替尼對共培養PC12 細胞OGD 后細胞生存率的影響
結果如圖所示,與對照組相比,條件培養基共培養12 h 的OGD 組PC12 細胞生存率明顯降低(P<0.01),在給予烏帕替尼條件培養基后,PC12 細胞生存率較OGD 組增加無統計學意義(圖5A);共培養24 h 的OGD 組細胞生存率較對照組明顯減少(P<0.01),而烏帕替尼組較OGD 組PC12 細胞生存率明顯增加(P<0.05)(圖5B)。
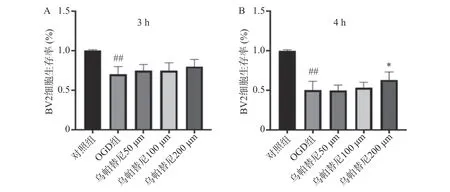
圖1 烏帕替尼對OGD/R 誘導的BV2 細胞損傷的影響
3.6 烏帕替尼對OGD/R 后BV2 細胞JAK1/STAT6信號通路相關蛋白表達水平的影響
結果如圖所示,在OGD/R 損傷后,BV2 細胞p-JAK1 和p-STAT6 蛋白表達水平較對照組顯著增加(P<0.01),在給予烏帕替尼后,p-JAK1 和p-STAT6 蛋白表達水平較OGD 組顯著降低(P<0.01)(圖6B, 6C)。
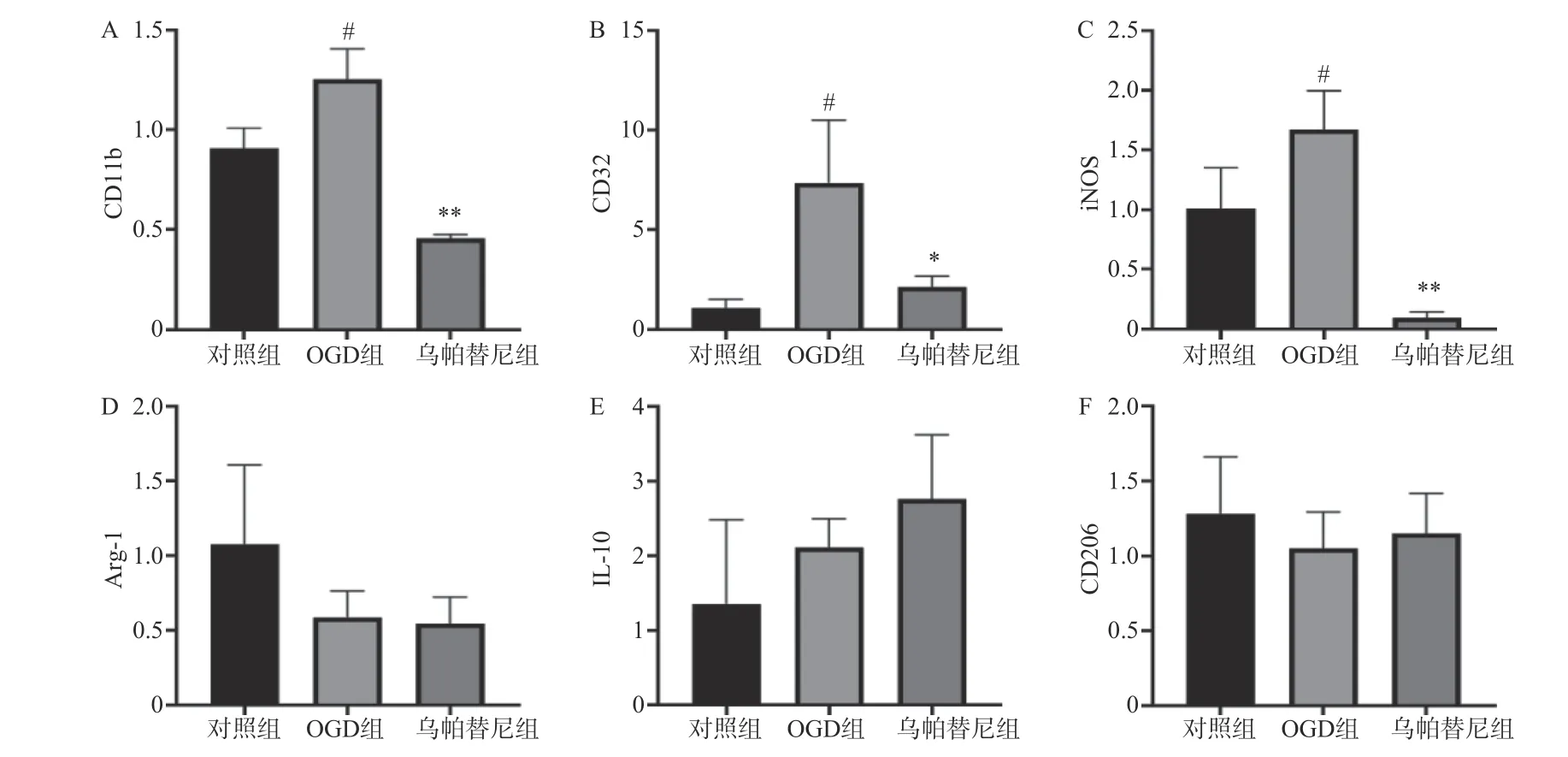
圖2 烏帕替尼對OGD/R 后BV2 細胞極化的影響

圖3 烏帕替尼對BV2 細胞OGD 后遷移能力的影響
4 討論
神經炎癥與神經系統疾病密切相關[14],而小膠質細胞是神經系統參與炎癥反應的關鍵細胞,小膠質細胞經刺激后活化,根據其激活狀態分為M1 型和M2 型2 種表型,中樞神經系統(CNS)中的小膠質細胞可以是促炎的,也可以有神經保護的作用,這取決于它們的激活狀態。促炎型小膠質細胞表達促炎因子IL-1、TNF-α、IL-6、一氧化氮(NO)等,會對神經系統有不利影響[15];而抗炎型小膠質細胞則會引起多種抗炎因子釋放,如FIZZ1、Chi3I3、精氨酸酶1、Ym1、CD206、胰島素樣生長因子1(IGF-1)和Fzd1 等,這些細胞因子可能參與神經保護和組織愈合[16]。
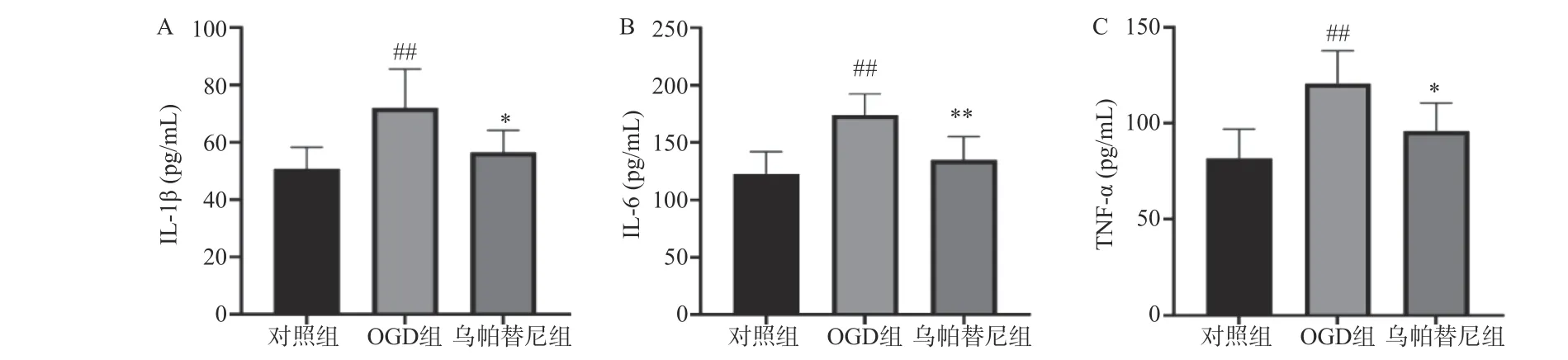
圖4 烏帕替尼對BV2 細胞OGD/R 后培養基中炎性因子水平的影響
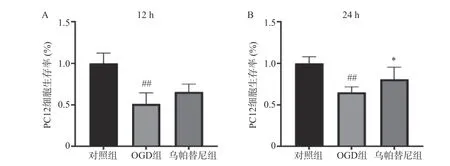
圖5 烏帕替尼對共培養PC12 細胞OGD 后細胞生存率的影響
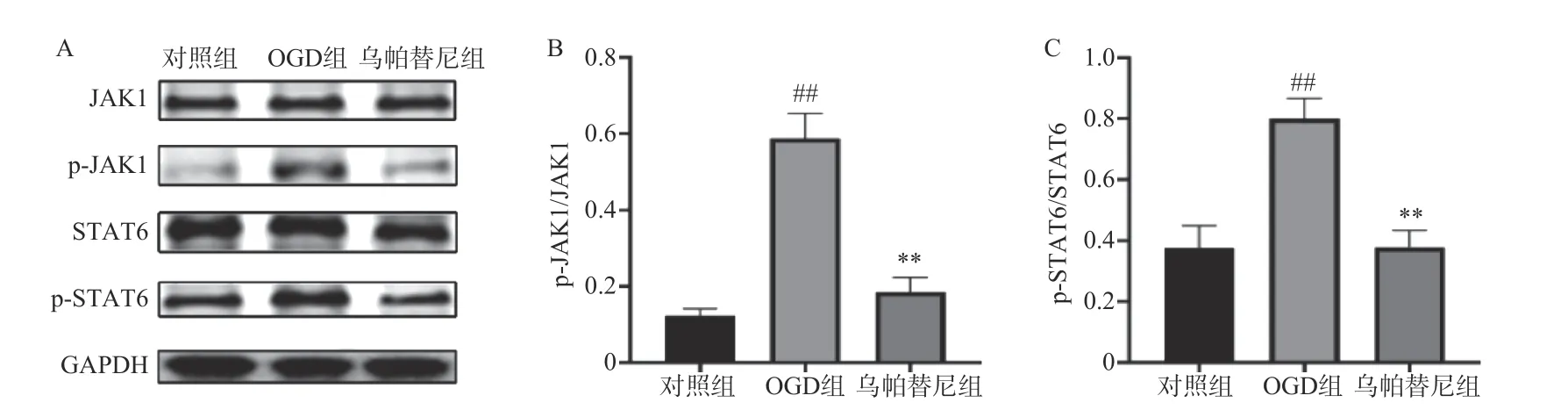
圖6 烏帕替尼對OGD/R 后BV2 細胞JAK1/STAT6 信號通路相關蛋白表達水平的影響
哺乳動物JAK 激酶家族由3 個JAKs(JAK1、JAK2、JAK3)和酪氨酸激酶2(TYK2)組成,它們經多種細胞因子觸發,選擇性地結合不同的受體,從而作為信號傳導器在細胞內發揮作用[17]。JAK 激酶激活下游的STAT 蛋白,激活的STAT 蛋白作為轉錄因子,轉運到細胞核,上調促炎性細胞因子和生長因子基因[18]。本研究將JAK1 選擇性抑制劑烏帕替尼作用于OGD/R 后的BV2 小膠質細胞,結果顯示烏帕替尼能增加OGD/R 后BV2 細胞的生存率。在發生急性腦卒中后,腦內的小膠質細胞通常會遷移至損傷部位[19],而受到損傷部位刺激后,小膠質細胞會極化為M1 型加重了缺血損傷[20],于是筆者對BV2 小膠質細胞OGD/R 后的極化和遷移能力進行檢測,發現BV2 細胞在OGD/R 后,其M1 型標志物CD11b、CD32、和iNOS 的mRNA 水平明顯升高,在烏帕替尼處理后,M1 型標志物水平明顯減少,這個結果表明,烏帕替尼能抑制BV2 小膠質細胞向M1 型極化,劃痕實驗結果可以看出烏帕替尼能抑制BV2 細胞OGD/R 后的遷移能力。為了進一步研究小膠質細胞極化后對神經系統的影響,本實驗檢測了OGD/R 后BV2 細胞培養基中炎癥因子的含量,研究結果顯示,烏帕替尼可減少OGD/R 后BV2 細胞分泌的炎癥因子。之后將OGD/R 后的BV2 細胞條件培養基稀釋一半后加入到OGD 4 h 后的PC12 細胞中,實現OGD/R后BV2 細胞的條件培養基與OGD 后PC12 細胞之間的共培養,共培養結果顯示,經烏帕替尼處理的BV2 細胞的條件培養基能提高OGD/R 后PC12 細胞的生存率。烏帕替尼為JAK1 選擇性抑制劑,而JAK/STAT 信號通路與神經炎癥密切相關,于是本研究通過Western blot 檢測烏帕替尼對OGD 4 h/R 24 h 后BV2 細胞JAK1/STAT6 信號通路相關蛋白的表達水平,發現經OGD/R 處理后的BV2 小膠質細胞JAK1 和STAT6 磷酸化蛋白的表達水平明顯增加,而烏帕替尼處理后可明顯減少JAK1 和STAT6 蛋白的激活,從而抑制BV2 細胞炎癥通路,減少由BV2 小膠質細胞經激活后引起的神經炎癥。
綜上所述,烏帕替尼能抑制BV2 細胞經OGD/R刺激后向M1 型極化,抑制其遷移能力并減少炎癥因子的釋放,通過調控JAK1/STAT6 信號通路抑制炎癥反應起到神經保護的作用。烏帕替尼目前已被批準用于類風濕關節炎的治療,但是對神經系統炎癥疾病治療的研究非常少,其抑制JAK/STAT 信號通路對腦缺血損傷可能具有保護作用。

