不同鳥嘌呤堿基數目對DNA/銀納米簇熒光強度的影響
袁一凡,陸 峰 (海軍軍醫大學藥學院藥物分析學教研室,上海 200433)
熒光共振能量轉移(fluorescence resonance energy transfer,FRET)是指供體熒光分子發射光譜與受體分子的吸收光譜有顯著的重疊且分子間距小于10 nm 時發生的一種非放射性的能量轉移[1],導致供體熒光淬滅而受體熒光增強或不變。近些年,FRET 技術以其精準高效的特點被廣泛應用在分析檢測領域,為檢測生物分子提供了重要的分析方法。基于FRET 技術,實現了活細胞內ATP 分子的檢測[2],金屬離子如汞離子的檢測[3-4],許多疾病相關基因[5-6]以及酶活性的檢測等[7-8]。
銀納米簇(AgNCs),作為一種新型的低毒性“綠色”熒光標記材料,具有量子產率高、毒性低、生物相容性好等特點[9],使得其被廣泛應用在多個研究領域。在銀納米簇的合成過程中,相較于其他的合成模板,DNA 更具優勢,如DNA 具有分子識別的功能(包括對于互補鏈和小分子的識別),不同序列的DNA 模板可調諧不同的發射波長等[10]。
研究發現,G 堿基可以增強DNA/銀納米簇(DNA/AgNCs)的熒光強度[11-12],基于此,我們設計了系列非銀簇模板部分的互補鏈,考察G 堿基個數對于銀簇熒光強度的影響,實驗結果顯示,暴露的G 堿基個數與銀簇的熒光強度呈正相關關系。該實驗不僅驗證了G 堿基對于銀簇熒光的增強作用,還提示我們在設計含有G-四聯體適配體的熒光探針時,可通過改變非銀簇部分的互補鏈長短來調控熒光的淬滅及恢復程度,以獲得最佳的檢測效果。
1 儀器與試劑
1.1 儀器
VS-100C 恒溫混勻儀(無錫沃信儀器制造有限公司);FL-6500 熒光分光光度計(PerkinElmer);ZEN3600 粒徑電位測定儀(英國馬爾文公司);精密電子天平(北京賽多利斯儀器系統有限公司);Vortex-Genie2 多功能旋渦混合器(美國Scientific Industries 公司);TGL-16C 離心機(上海安亭科學儀器廠);實驗室pH 計 FE20[梅特勒-托利多儀器(上海)有限公司];Tecnai G2 F30 高分辨率電子顯微鏡(荷蘭FEI 公司)
1.2 試劑
硝酸銀、硼氫化鈉、鹽酸(國藥集團化學試劑有限公司);三羥甲基氨基甲烷(Tris,大連美侖生物技術有限公司);氯化鎂、氯化鈉、氯化鉀(上海泰坦科技股份有限公司);試劑均為分析純。實驗用水為屈臣氏蒸餾水。
相關DNA 序列由生工生物工程(上海)股份有限公司合成。合成DNA-AgNCs 的模板序列及P1A5C5 的互補序列如表1、表2 所示。

表1 DNA/AgNCs 的模板序列
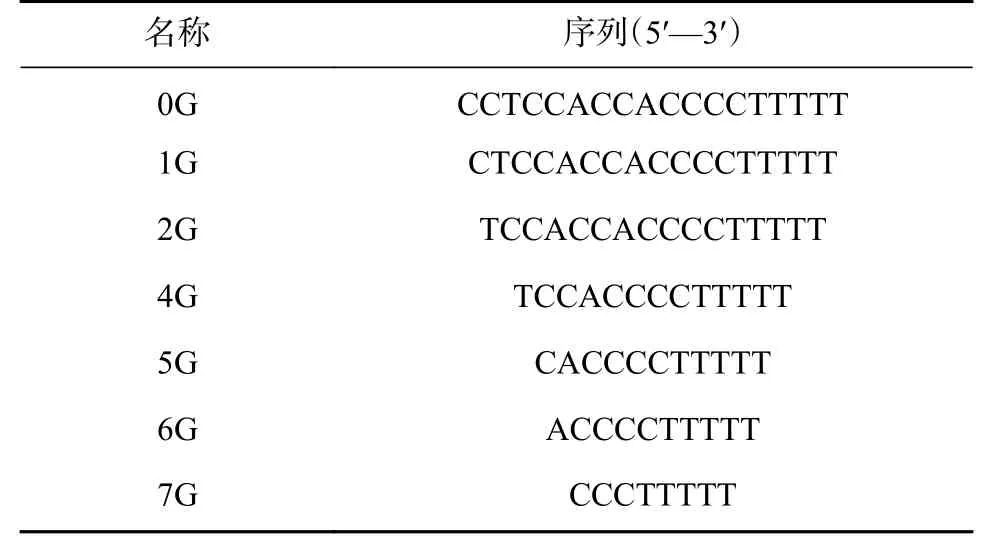
表2 P1A5C5 的互補序列
2 實驗內容
2.1 DNA 溶液的配制及處理
加入相應體積的20 mmol/L Tris-HCl(pH=7.4)緩沖溶液將DNA 溶解,即制得100μmol/L DNA 溶液,將制得的DNA 溶液95 ℃加熱5 min 后,冰水浴冷卻10 min。
2.2 銀納米簇的制備
參考文獻中的合成方法[13],將一定體積的硝酸銀溶液加入到上述DNA 溶液中(20 mmol/L Tris-HCl,pH=7.4),充分震蕩混勻,25 ℃孵育20 min,靜置,將一定體積新配制的硼氫化鈉引入到上述反應混合物中,最終使得體系中DNA、硝酸銀、硼氫化鈉的濃度分別為5、30、30μmol/L(即DNA:Ag+∶NaBH4的摩爾比為1∶6∶6),劇烈震蕩混勻,室溫下避光反應3 h 后,4 ℃避光反應過夜。得到的銀納米簇溶液在4 ℃保存以備用。
2.3 銀納米簇的表征
熒光圖譜表征:將2μmol/L 的銀納米簇溶液在200~800 nm 波長范圍內進行熒光光譜預掃描,設置激發和發射狹縫寬度為10 nm,掃描速度為1 200 nm/min,電壓值為400 V。
高分辨率透射電子顯微鏡表征:將銀納米簇溶液滴加銅網后觀察。
2.4 熒光光譜測量
在含有100 mmol/L NaCl,2 mmol/L MgCl2,5 mmol/L KCl 的20 mmol/L Tris-HCl 緩沖溶液中(pH=7.4),加入銀簇溶液(2μmol/L),將互補的DNA 溶液(表2)以1∶1 的摩爾比分別加入到上述體系溶液中,充分震蕩混勻,37 ℃孵育20 min。在室溫條件下進行熒光光譜測量。激發波長為486 nm,激發和發射狹縫寬度為10 nm,掃描速度為1 200 nm/min,電壓值為400 V。
3 結果與討論
3.1 銀納米簇的合成與表征
在進行DNA/AgNCs 的合成時,基于胞嘧啶堿基與銀離子的作用,一般選擇富含胞嘧啶堿基的序列作為合成模板,筆者根據文獻報道的模板序列結合模板優化設計[13-16],選擇了5 種銀簇模板并進行了相應的堿基優化設計,如表1 所示,結果顯示P1A5C5 的熒光信號強度較高(如圖1),且4 ℃避光保存45 d 后,熒光信號強度基本不變,穩定性良好。因此,我們使用該序列合成的DNA/AgNCs 進行后續的實驗研究。
對生成的P1A5C5 銀納米簇體系進行熒光激發光譜和發射光譜的表征,結果如圖2 所示,在487 nm 激發條件下,發射波長為577 nm。
DNA/AgNCs 的高分辨透射電子顯微鏡(HRTEM)圖片如圖3 所示,從圖中可以看出,DNA/AgNCs 的直徑約為2~3 nm,分散性良好。
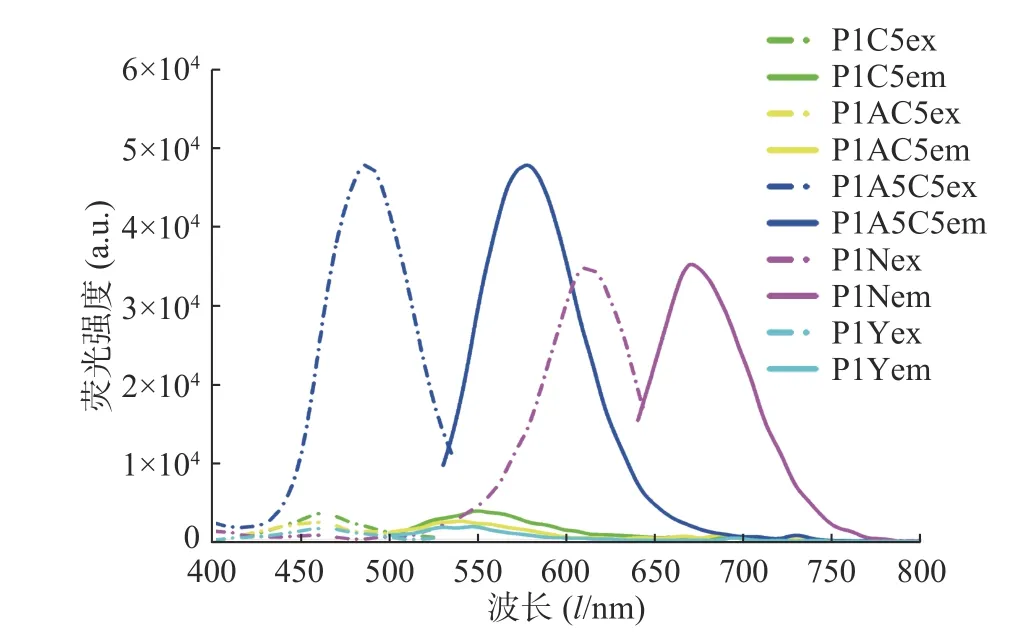
圖1 5 種DNA/AgNCs 模板序列的熒光圖譜表征
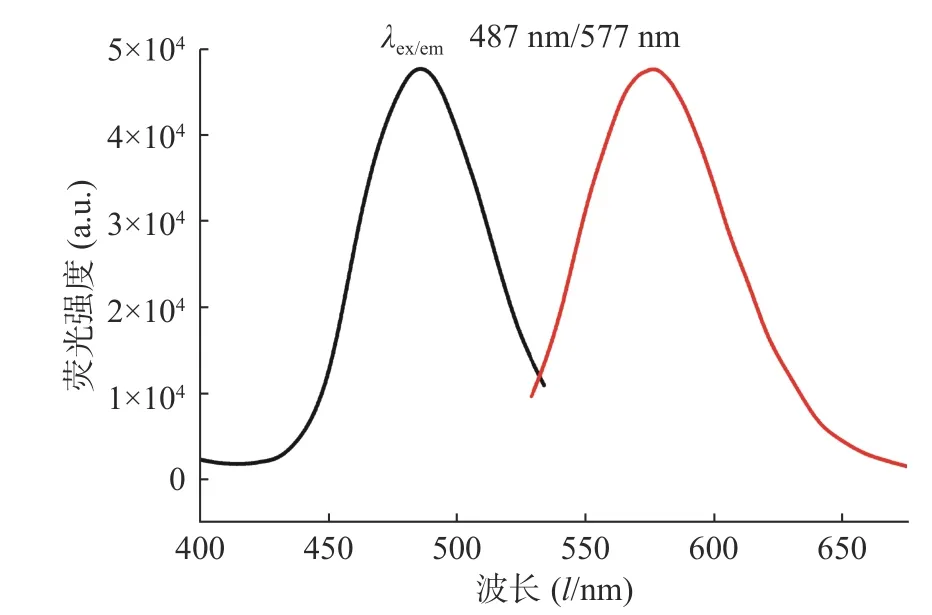
圖2 P1 A5 C5 銀納米簇的熒光圖譜表征

圖3 DNA/AgNCs 的高分辨率透射電子顯微鏡圖
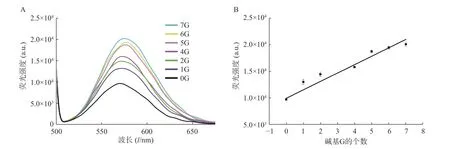
圖4 P1 A5 C5 與互補鏈作用后的熒光光譜圖及線性關系圖
3.2 互補DNA 的設計及熒光響應情況
在銀簇P1A5C5 序列5′-GGAGGTGGTGGGG AAAAACCCCCTAATTCCCCC-3′中,CCCCCTAA TTCCCCC 為成簇模板序列,下劃線部分為巖沙海葵毒素的G-四聯體適配體[17]。基于G 堿基對銀簇的熒光信號強度有增強作用這一現象,我們設計了一系列適配體部分的互補序列(表2),通過C-G 堿基互補,適配體部分暴露的G 堿基個數不同,導致與銀納米簇作用的堿基G 數目不同,進而對銀納米簇的熒光信號強度產生不同的影響。結果顯示,隨著暴露的G 堿基個數的增加,熒光信號強度增加(圖4A),對暴露的G 堿基個數與熒光信號強度關系進行擬合,得到的線性方程為:Y=1 726.1X+8 972.5,r=0.978 9(圖4 B)。該研究證明了G 堿基對銀簇的熒光具有增強效果,反之,通過C-G 堿基互補配對,G 堿基與銀簇的作用位點被占據,無法與銀簇作用,難以達到增強熒光信號強度的作用。因此,隨著暴露堿基個數的減少,熒光強度減弱。基于此,可實現與G-四聯體適配體有關的熒光開關的設計,進而實現對目標物的檢測。
在DNA 序列和銀納米簇進行堿基互補配對時,結合互補序列的Tm 值,我們研究了互補鏈間實現堿基互補配對所需的溫度和時間。實驗結果顯示,相較于4 ℃,在37 ℃條件下孵育,互補鏈間相互作用較強,容易實現堿基互補配對,熒光信號強度變化較為明顯;同時,考察了在37 ℃下作用1 h內的熒光變化情況,結果顯示,熒光變化強度隨時間未發生明顯變化,最終選擇20 min 作為孵育時間。
4 結論
該實驗利用含有G 四聯體適配體的DNA 序列合成了熒光銀納米簇,基于G 堿基可以增強銀納米簇的熒光這一現象,并結合堿基互補配對的原則,設計了8 種G 四聯體適配體的互補鏈,在互補鏈和適配體部分堿基互補配對后,熒光信號強度也產生相應的變化。隨著互補鏈長度的縮短,暴露的G 堿基個數增加,熒光信號增強,且暴露的G 堿基個數與熒光信號強度擬合得到的線性方程為:Y=1 726.1X+8 972.5,r=0.978 9。該實驗不僅證實了G堿基對熒光銀納米簇有熒光增強作用,還提示我們在設計含有G 四聯體的銀納米簇熒光探針時,可以通過互補鏈對熒光信號的干擾程度來調控熒光的開閉,這對進一步擴展銀納米簇在熒光分析方法中的應用具有指導意義。

