梔子豉湯固體發酵菌質的制備及主要成分含量變化
陳麗艷,邢 怡,宓月光,孫國東,孫銀玲,曹 陽,馮麗娜,王偉明*
(黑龍江省中醫藥科學院,黑龍江哈爾濱 150036)
梔子豉湯為張仲景的經典名方,由梔子和淡豆豉兩味藥食同源中藥配伍而成,為清宣胸中郁熱,治療虛煩懊惱不得眠之良方[1]。現代藥理研究表明,梔子豉湯具有抗抑郁作用,環烯醚萜類成分為其主要藥效物質,其中梔子苷含量最高[2-3]。藥代動力學和腸吸收代謝動力學研究表明,梔子苷生物利用度低,口服需經腸道微生物及腸壁酶將其代謝為京尼平而被吸收利用[4-5]。然而京尼平不穩定,在一定條件下可與多種氨基酸結合生成穩定的梔子藍[6],且梔子藍較梔子苷和京尼平肝毒性更低[7]。崔元璐等[8]研究推測,梔子豉湯采用“先煎梔子再加淡豆豉煎煮”的方法是由于梔子豉湯在煎煮過程中存在:梔子苷京尼平(不穩定)京尼平-氨基酸復合物(梔子藍)的轉化過程,其中京尼平-酪氨酸復合物已被證實其抗抑郁作用優于梔子苷和京尼平[9-10]。淡豆豉為特殊的發酵類中藥飲片,含有一定數量的枯草芽孢桿菌等益生菌,具有調節腸道菌群作用[11],在梔子豉湯煎煮過程中,由于高溫煎煮會殺滅一部分有益微生物并降低酶的活性,不能充分實現梔子苷的生物轉化,且京尼平與氨基酸的結合屬于靜態恒定過程。
本研究在梔子豉湯原方基礎上,采用雙向固體發酵技術,以梔子、青蒿、桑葉水煎液浸泡黑豆作為發酵基質,以枯草芽孢桿菌(Bacillus subtilis)和傘枝犁頭霉(Fusariumumbellatum)復合菌作為發酵菌株制備梔子豉,通過發酵菌株及發酵時間的考察,以梔子苷的轉化率為評價指標,在體外實現梔子苷的降解及京尼平-氨基酸復合物的動態積累過程,為提高梔子豉湯藥效及新產品開發提供依據。
1 材料與方法
1.1 材料與試劑
1.1.1 藥材和菌株
青蒿和桑葉(批號170101):河北祁新中藥顆粒飲片有限公司;黑豆(批號20170503):北京本草方源藥業集團有限公司;梔子(批號171001):亳州市張仲景中藥飲片有限責任公司。
枯草芽孢桿菌(Bacillus subtilis)DDC-SP1、傘枝梨頭霉(Absidia corymbifera)DDC-SP11、米根霉(Rhizopus oryzae)DDC-SP14:均從市售淡豆豉飲片中分離,經中國工業微生物菌種保藏管理中心鑒定(報告編號分別為17-066-161-169,17-276-852-1123和17-066-163-171),三株菌經篩選具有較高的蛋白酶和β-葡萄糖苷酶活性。
1.1.2 化學試劑
梔子苷對照品(批號Z-003-170222)(純度>98%)、京尼平對照品(批號J-028-161216)(純度>98%):成都瑞芬思生物科技有限公司;17種氨基酸水解標樣混合液:天冬氨酸(Asp)、絲氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、組氨酸(His)、精氨酸(Arg)、蘇氨酸(Thr)、丙氨酸(Ala)、脯氨酸(Pro)、胱氨酸(Cys)、酪氨酸(Tyr)、纈氨酸(Val)、蛋氨酸(Met)、賴氨酸(Lys)、異亮氨酸(Ile)、亮氨酸(Leu)、苯丙氨酸(Phe);AccQ·Fluor衍生劑(硼酸緩沖液、衍生劑粉末、衍生劑稀釋液、三水乙酸鈉-磷酸鈉洗脫液):美國Waters公司;甲醇、乙腈(均為色譜純)。其他試劑均為國產分析純。
1.1.3 培養基
營養瓊脂(nutrient agar,NA)培養基:蛋白胨10.0 g/L,牛肉粉3.0 g/L,氯化鈉5.0 g/L,瓊脂15.0 g/L,加熱溶解于1 000 mL蒸餾水中。121 ℃高壓滅菌15 min。
營養肉湯(NB)培養基:稱取蛋白胨10.0 g/L,牛肉浸粉3.0 g/L,氯化鈉5.0 g/L,加熱溶解于1 000 mL蒸餾水中。121 ℃高壓滅菌15 min。
馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基:馬鈴薯浸粉6.0 g/L,葡萄糖20.0 g/L,瓊脂20.0 g/L,加熱溶解于1 000 mL蒸餾水中。115 ℃高壓滅菌20 min。
馬鈴薯葡萄糖肉湯(potato dextrose broth,PDB)培養基:馬鈴薯浸粉6.0 g/L,葡萄糖20.0 g/L,加熱溶解于1 000 mL蒸餾水中。115 ℃高壓滅菌20 min。
1.2 儀器與設備
Waters Alliance 2489高效液相色譜(high performance liquid chromatography,HPLC)儀:美國Waters公司;DHP9272恒溫培養箱:上海一恒科學儀器有限公司;UV/VIS Lambda 365紫外-可見分光光度計:美國PE公司;BSA224S電子天平:德國賽多利斯科學儀器有限公司;HNY-2102C恒溫培養振蕩器:天津歐諾儀器有限公司;LDZX-50KBS立式壓力蒸汽滅菌器:上海申安醫療器械廠;DH6-907385-III電熱恒溫鼓風干燥箱:上海新苗醫療器械制造有限公司。
1.3 方法
1.3.1 梔子豉湯各藥味配伍劑量的換算
《傷寒論》記載梔子豉湯由“梔子十四個(掰),香豉四合(綿裹)”配伍而成。依據東漢時期度量衡的計量方法,換算為現代的梔子15 g、淡豆豉50 g[12]。《中國藥典》淡豆豉質量標準規定每1 kg大豆用青蒿、桑葉分別為70~100 g[13]。因此,本研究梔子豉湯制備中梔子∶青蒿∶桑葉∶黑豆質量比為15∶5∶5∶50。
1.3.2 發酵基質的制備
按照1.3.1的比例稱取梔子(打碎)、桑葉、青蒿加10倍水煎煮2次,每次1 h,過濾,合并濾液并濃縮至100 mL,拌入洗凈的黑豆中(黑豆與藥液的比例為1∶0.8(g∶mL))浸泡12~16 h,待藥液吸盡,于121 ℃高壓滅菌30 min,即得。
1.3.3 菌液的制備、接種及培養
分別利用枯草芽孢桿菌(Bacillus subtilis)DDC-SP1、傘枝梨頭霉(Absidia corymbifera)DDC-SP11、米根霉(Rhizopus oryzae)DDC-SP14三株菌采用單菌和雙菌發酵,發酵樣品編號及采用的發酵菌株分別為1號:菌株DDC-SP1;2號:菌株DDC-SP11;3號:菌株DDC-SP14;4號:菌株DDC-SP1和DDC-SP11(1∶1,V/V);5號:菌株DDC-SP1和DDC-SP14(1∶1,V/V);6號:菌株DDC-SP11和DDC-SP14(1∶1,V/V)。按照細菌和霉菌的常規培養溫度,本研究采用單菌細菌(即菌株DDC-SP1)發酵溫度37 ℃,霉菌和復合菌發酵溫度為28 ℃。將菌株DDC-SP1接種至營養肉湯中于37 ℃、120 r/min搖床培養18~24 h,得到枯草芽孢桿菌DDC-SP1菌液(108~109CFU/mL);菌株DDC-SP11和DDC-SP14分別接種至馬鈴薯葡萄糖培養液中,于28 ℃、120 r/min搖床培養3~5 d,分別制成孢子菌懸液(105~106孢子/mL)。將1.3.2的發酵基質接種上述菌液,單菌發酵樣品接菌量為2 mL/100 g,雙菌發酵樣品每種菌液接菌量為1 mL/100 g,混勻,除1號樣品于37 ℃、120 r/min搖床培養外,其余5組均于28 ℃、120 r/min搖床培養,分別于不同發酵時間取樣,60 ℃干燥。
1.3.4 樣品中梔子苷和京尼平的含量測定
采用高效液相色譜法(HPLC)測定梔子苷、京尼平和氨基酸的含量。
供試品溶液制備:分別取發酵0、1 d、3 d、7 d、10 d、15 d的干燥樣品,粉碎成細粉(80目),精密稱取粉末3.0 g,置具塞錐形瓶中,加入體積分數為50%甲醇50 mL,稱質量,搖勻,超聲40 min,放冷后再次稱定質量,用體積分數為50%甲醇補足質量損失,以3 000 r/min離心20 min,精密吸取上清液10 mL加體積分數為50%甲醇定容至50 mL,搖勻,0.45 μm濾膜過濾備用。
對照品溶液的配制:精密稱取梔子苷和京尼平對照品,分別加體積分數為50%甲醇制成400 μg/mL的對照品溶液,用體積分數為50%甲醇進行系列稀釋,0.45 μm濾膜過濾。
HPLC色譜條件:參照李翔等[14]的方法,Symmetry C18柱(4.6 mm×150 mm,5 μm);流動相A為甲醇,流動相B為0.5%冰醋酸;流速1 mL/min,檢測波長254 nm,進樣量10 μL,柱溫40 ℃;梯度洗脫程序設置以流動相A計:0~2 min,10%;3~8min,22%;9~13min,30%;14~40min,60%;41~42min,30%;43~50 min,10%。
1.3.5 樣品溶液吸光度值測定
京尼平可與多種氨基酸形成復合物產生藍色或黃色色素,但聚合度不一,分子質量相差很大,一般以色價或者吸光度值衡量其品質[15]。分別精密稱取不同發酵時間梔子豉樣品干燥粉末1 g,加蒸餾水100 mL搖勻,超聲提取20 min,靜置過濾,取濾液,以6 000 r/min離心15 min,取上清液,于波長590 nm處測定吸光度值。
1.3.6 樣品游離氨基酸含量測定
采用高效液相色譜-熒光檢測器法(high performance liquid chromatography-fluorescence detector,HPLC-FLD)測定游離氨基酸的含量。
在確定7 d為最佳發酵時間的前提下考察游離氨基酸的含量變化,分別于發酵0、6 h、12 h、24 h、48 h、72 h、120 h、168h取樣,60℃干燥,粉碎。參照宓月光等[16]游離氨基酸含量測定方法,分別精密稱取各樣品粉末200 mg,加入0.1 mol/mL的鹽酸10mL,混勻,超聲提取40min,8 000 r/min離心20 min,取上清液過0.45 μm濾膜,進樣量10 μL。
2 結果與分析
2.1 梔子豉發酵過程中梔子苷和京尼平的含量變化
對照品梔子苷(A)、京尼平(B)及梔子豉樣品(C)的高效液相色譜見圖1。由圖1可知,梔子苷在24~390 μg/mL質量濃度范圍內線性關系良好,標準曲線線性方程為Y=6 962.804 4X+35 420.657 1,相關系數R為0.997 4;京尼平在22~355 μg/mL質量濃度范圍內呈良好線性關系,標準曲線線性方程為Y=110.56X+32 838,相關系數R為0.998 2,梔子苷和京尼平色譜峰均達到了基線分離。
各組樣品發酵過程中梔子苷含量變化結果見圖2。由圖2可知,發酵第1天,2號、3號和6號樣品梔子苷含量略有上升,其他各組稍有下降,第3天開始各組樣品梔子苷含量均隨發酵時間延長而逐漸下降,2號和4號樣品均在7 d降為0,4號樣品在3 d降解最快,1號、3號和5號樣品于發酵15 d梔子苷完全轉化,6號轉化最慢。由于2號、3號和6號的發酵菌均為霉菌,第1天生長處于遲緩期,因此梔子苷未發生降解,28 ℃恒溫1 d可能利于梔子苷的溶出而呈小幅上升趨勢,而其他各組均有1號枯草芽孢桿菌,由于細菌生長較快,酶活逐漸提高而使梔子苷含量下降;3~7 d霉菌處于對數生長期,各組梔子苷在微生物酶的作用下快速降解。結果表明,采用菌株DDC-SP1和DDC-SP11復合菌發酵7 d梔子苷轉化最快。

圖1 梔子苷(A)、京尼平(B)及梔子豉樣品(C)高效液相色譜圖Fig.1 HPLC chromatography of geniposide (A),genipin (B) and Zhizichi sample (C)
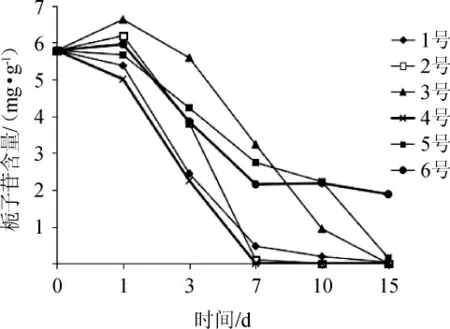
圖2 各組樣品發酵過程中梔子苷含量變化Fig.2 Changes of gardenoside contents in each group of samples during fermentation
各組樣品發酵過程中京尼平含量變化結果見圖3。由圖3可知,1號、2號和4號樣品京尼平含量均在7 d降為0,推測此時段京尼平與氨基酸可能完全形成復合物,在發酵3 d京尼平降解速率1號>4號>2號;3號樣品發酵15 d京尼平轉化完全,而6號樣品京尼平轉化最慢,15 d仍含有0.14 mg/g。除1號樣品外,其他各組樣品京尼平含量呈先下降后小幅升高再下降的趨勢,可能與各發酵菌酶系的構成及活力相關,除1號為單一枯草芽孢桿菌發酵外,其他各組的發酵菌均含有霉菌,發酵1~3 d霉菌生長處于遲緩期。發酵第1天,由于梔子苷較少量轉化為京尼平,梔子中原有的京尼平與大豆中的氨基酸結合生成梔子藍而使京尼平含量下降,在1~3 d又有小幅升高,此階段細菌正處于生長繁殖的活躍期,梔子苷轉化速度高于京尼平與氨基酸結合的速度,使京尼平產生積累,發酵3 d后隨著梔子苷和大豆蛋白的逐漸降解,生成的京尼平動態與多種氨基酸結合生成梔子藍復合物,導致京尼平含量迅速下降。結果表明,采用菌株DDC-SP1與DDC-SP11復合菌發酵可促進梔子苷降解為京尼平且于發酵7 d完全轉化。

圖3 各組樣品發酵過程中京尼平含量變化Fig.3 Changes of genipin contents in each group of samples during fermentation
綜上,2號和4號樣品均在7 d梔子苷和京尼平含量降為0,一方面表明梔子苷完全降解,另一方面表明京尼平完全與氨基酸形成復合物,而4號在第3天兩種成分轉化速率更快。4號是采用菌株DDC-SP1與DDC-SP11復合菌發酵制備梔子豉,可發揮多種酶協同作用促進梔子苷的轉化及京尼平-氨基酸的結合。
2.2 不同發酵時間梔子豉水溶液吸光度值變化
各組樣品發酵過程中吸光度值(OD590nm值)變化結果見表1。

表1 各組樣品發酵過程中OD590nm值變化Table1 Changes of OD590nmvalue of each group of samples during fermentation
由表1可知,隨著發酵時間的延長,各組樣品溶液的吸光度值未呈規律性變化,但4號樣品發酵7 d吸光度值最大為0.575,表明其產生的梔子藍色價最高。由于各組發酵菌的酶系及活性不同,對梔子苷和大豆蛋白的轉化能力存在差異,每組樣品中京尼平與不同氨基酸生成梔子藍復合物的組成及含量也不一樣。徐尤智等[15]研究表明,賴氨酸、甘氨酸、谷氨酸和丙氨酸與京尼平反應呈色較深,而天冬氨酸、蘇氨酸和酪氨酸呈色較淺,脯氨酸幾乎不顯色,因此梔子豉水溶液OD590nm值不呈規律變化。結果表明,采用菌株DDC-SP1與DDC-SP11復合菌發酵7 d生成梔子藍的色價最高。
2.3 梔子豉最佳發酵工藝
梔子豉最佳發酵工藝為梔子(打碎)15 g、青蒿5 g、桑葉5 g,加10倍量水煎煮2次,每次1 h,合并濾液,濾液濃縮至100 mL,拌入凈黑豆(黑豆與藥液的料液比為1.0∶0.8(g∶mL))浸泡12~16 h,待黑豆將藥液吸盡,裝袋,121 ℃高壓滅菌30 min,稍涼,分別接種菌株DDC-SP1菌液(108~109CFU/mL)和菌株DDC-SP11菌液(105~106孢子數/mL)各1 mL/100 g,搖勻,于28 ℃培養168 h(7 d),60 ℃干燥,即得梔子豉。
2.4 梔子豉發酵過程中游離氨基酸的含量變化
在確定梔子豉最佳工藝的基礎上,考察發酵7 d內樣品游離氨基酸的含量變化氨基酸混合標樣及樣品的HPLC-FLD色譜圖見圖4,各組樣品氨基酸含量測定結果見表2。

圖4 氨基酸混合標準品及梔子豉樣品的HPLC-FLD色譜圖Fig.4 HPLC-FLD chromatogram of mixed amino acid standards and Zhizichi samples
由圖4可知,17種氨基酸衍生物均達到基線分離,分離良好。由表2可知,氨基酸含量于發酵24~72 h變化明顯,72 h后趨于平穩。發酵基質(0 h)中精氨酸(Arg)含量最高為3.16 mg/g,絲氨酸(Ser)和脯氨酸(Pro)次之,分別為0.81 mg/g和0.73 mg/g,其他氨基酸含量在0~0.3 mg/g(所有樣品中均未出現胱氨酸色譜峰)。隨著發酵時間的延長,樣品中不同氨基酸含量變化趨勢不一致,168 h精氨酸(Arg)含量下降了94.9%,絲氨酸(Ser)和天冬氨酸(Asp)含量分別下降了71.6%和52.0%,而脯氨酸(Pro)含量升高了3.4倍,組氨酸(His)和谷氨酸(Glu)含量均升高1.5倍,其余氨基酸含量未發生明顯變化。梔子豉發酵過程中出現了幾種氨基酸含量上升或下降的現象,其中精氨酸含量下降幅度最大,可能京尼平與精氨酸結合較多[18-20],另外,梔子豉發酵過程復雜,涉及多種成分的變化及相互作用,尚需進一步深入研究。

表2 梔子豉發酵過程中17種游離氨基酸的含量變化Table 2 Changes of 17 kinds of free amino acids contents during Zhizichi fermentation
3 結論
雙向固體發酵技術已成為開發中藥新藥的新途徑,國家一類新藥——槐耳菌質即是采用此技術研制而成[17]。本研究在梔子豉湯原方基礎上,采用雙向固體發酵技術制備梔子豉,確定了其最佳發酵工藝條件為以梔子、青蒿、桑葉水煎液浸泡黑豆作為發酵基質,接種枯草芽孢桿菌(Bacillus subtilis)和傘枝犁頭霉(Fusarium umbellatum)復合菌(1∶1,V/V)于28 ℃發酵168 h。此條件下,梔子苷和京尼平含量降為0,生成的京尼平-氨基酸復合物的色價最高(OD590nm為0.575),精氨酸(Arg)、絲氨酸(Ser)和天冬氨酸(Asp)含量分別下降了94.9%、71.6%、52.0%,而脯氨酸(Pro)、組氨酸(His)和谷氨酸(Glu)含量含量分別升高了3.4倍、1.5倍、1.5倍。本研究根據梔子豉湯抗抑郁活性成分的代謝轉化機制制備梔子豉,明確了其最佳發酵工藝及主要成分含量變化,后續將進一步通過抑郁癥大鼠模型進行藥效學研究,為基于經典名方的新型抗抑郁食療產品或新藥開發奠定基礎。

