發酵乳桿菌的生長限制性因素分析及高密度培養工藝優化
孫媛媛,崔樹茂,唐鑫,毛丙永,趙建新,陳衛
(江南大學 食品學院,江蘇 無錫,214122)
發酵乳桿菌不僅是傳統發酵食品中的優勢微生物,且廣泛地存在于人體腸道。2009年,它被列入了歐洲食品安全局(European Food Safety Authority, EFSA)的合格安全性推定(Qualified Presumption of Safety, QPS)清單,并被美國食品藥品監督管理局(U.S.Food and Drug Administration, FDA)列為“公認的安全”(generally recognized as safe, GRAS)生物。在2011年被中國衛計委列入《可用于食品的菌種名單》[1]。近年來,發酵乳桿菌的功能特性不斷被挖掘出來,如耐酸耐膽鹽[2]、降解膽固醇[3]、抗氧化[2]、抑菌[4-5]等,并且有多株功能性發酵乳桿菌被開發上市[6]。
發酵乳桿菌是專性異型發酵乳桿菌,在生長過程中消耗糖產生乳酸、乙酸和CO2,底物的利用效率及產物抑制可能均不同于同型發酵乳桿菌和雙歧桿菌。乳酸菌在生長過程中首先受到底物抑制,碳源、氮源、無機鹽、微量元素都是組成菌體增殖底物的關鍵內容,其中,碳源和氮源能夠為菌株提供生長所需的營養物質,無機鹽除了提供礦質元素外,還作為緩沖體系防止發酵液pH下降過快,微量元素作為多種酶的輔助因子參與菌株的代謝[7]。豐富的底物是菌株生長的必要條件,但是底物濃度過高會使培養基的初始滲透壓過高,反而會抑制菌株的生長,因此乳酸菌培養前底物濃度過高、底物成分比例不合適及培養后期限制性底物的不足與消耗均是菌株生長的抑制因素[8]。眾所周知,有機酸積累引起的酸抑制是乳酸菌分批培養時抑制菌體生長的主要因素,但是通過補堿的恒pH培養可以輕松解除酸抑制[9]。已有研究表明,中性條件下酸根積累引起的滲透壓升高成為大部分同型發酵乳桿菌和雙歧桿菌在恒pH培養時的主要抑制因素[8]。發酵乳桿菌代謝產生的乳酸和乙酸對菌體的抑制是否亦是滲透壓抑制還是有酸根毒害作用需進一步研究,且在菌株培養時需均衡底物和代謝產物濃度,既確保底物濃度不會對菌株產生抑制,又需保證底物能夠為菌體高濃度增殖提供充足營養。
本文在分析底物抑制和代謝產物抑制的基礎上,基于底物濃度、滲透壓及最適pH優化發酵乳桿菌的恒pH培養工藝,達到高密度培養的目的,為工業化生產提供一定的理論依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
發酵乳桿菌FXJCJ6-1分離自新疆昌吉的一位回民的糞便樣品,發酵乳桿菌FGDLZR161分離自廣東連州的一位兒童的糞便樣品,發酵乳桿菌CCFM422分離自海南省樂東黎族自治縣的酸豆角樣品,均由江南大學食品生物技術中心保藏。
1.1.2 試劑
葡萄糖、胰蛋白胨、酵母粉、牛肉膏、無水乙酸鈉、檸檬酸氫二銨、K2HPO4、MgSO4·7H2O、MnSO4·H2O、Tween 80、NaCl、乳酸鈉水溶液,國藥集團化學試劑有限公司;酵母蛋白FM103、酵母浸粉FM803、酵母浸粉FM528、大豆蛋白胨FP410、牛骨蛋白胨FP326、魚骨蛋白胨FP351,安琪酵母股份有限公司;葡萄糖試劑盒,上海榮盛生物藥業有限公司。
1.2 儀器與設備
ZHJH-C1115B型超凈工作臺,上海智誠分析儀器制造有限公司;GRP-9080型隔水式恒溫培養箱,上海森信實驗儀器有限公司;FE20型pH計、EL3002型電子天平,梅特勒-托利多儀器(上海)有限公司;MS 3 basic 型渦旋振蕩器,德國IKA公司;MLS-3750型高溫高壓滅菌鍋,日本SANYO公司;T&J-Minipod 1L×8型迷你平行發酵罐,迪必爾生物工程有限公司;l?ser-om806 m型冰點滲透壓測定儀,德國l?ser公司;UV-2450紫外分光光度計,日本島津公司。
1.3 實驗方法
1.3.1 培養基的配制
MRS液體培養基(g/L):葡萄糖20、蛋白胨10、牛肉膏10、酵母粉5、乙酸鈉2、K2HPO42、檸檬酸氫二銨2、MgSO4·7H2O 0.1、MnSO4·H2O 0.05、Tween 80 1 mL,調節pH 6.2~6.4。
MRS固體培養基:與MRS液體培養基配方相同,另加20 g/L的瓊脂粉。
氮源偏好分析培養基[10](g/L):氮源1、葡萄糖6、K2HPO410、Na2HPO410、MgSO4·7H2O 0.25、MnSO4·H2O 0.05、Tween 80 1 mL,調節pH 6.0。
MRS氮源偏好分析培養基(g/L):氮源1(0.4胰蛋白胨、0.4牛肉膏、0.2酵母粉),其他成分同氮源偏好分析培養基。
MRS氮源(MRS無機鹽)培養基(g/L):氮源1(0.4胰蛋白胨、0.4牛肉膏、0.2酵母粉)、葡萄糖6、乙酸鈉2、K2HPO42、檸檬酸氫二銨2、MgSO4·7H2O 0.25、MnSO4·H2O 0.05、Tween 80 1 mL,調節pH 6.0。上述培養基均在115 ℃滅菌20 min。
1.3.2 菌株活化與培養
用接種環從保菌管中蘸取少量菌液,在MRS固體培養基上劃線,平板置于37 ℃培養24~36 h。挑取單菌落,接入5 mL MRS液體培養基中,37 ℃培養12 h。以體積分數為4%的接種量將培養液接種到新鮮的MRS液體培養基中,培養12 h后得到活化的種子液。以下實驗方法中的接種量均為4%。
1.3.3 菌株對不同氮源利用的偏好性分析
按照1.3.1的方法配制不同的氮源培養基,接入菌株后37 ℃培養至穩定期,測定OD600。
1.3.4 生長限制性無機鹽分析
用NaCl代替MRS培養基中的無機鹽,保持2種培養基的滲透壓相同,在發酵罐中接入菌株,37 ℃恒pH 6.0培養至穩定期,每2 h取樣,繪制菌株的生長曲線,同時在穩定期取樣,測定活菌數。
1.3.5 生長限制性微量元素分析
培養基配方(g/L):氮源1、葡萄糖6、K2HPO410、Na2HPO410、Tween 80 1 mL。培養基中只添加單一的微量元素(0.05 MnSO4、0.05 MgSO4),質量比1∶1添加MnSO4和MgSO4,空白組(兩者都不加),37 ℃培養至穩定期,測定OD600。
1.3.6 中性條件下酸根的最低抑菌濃度測定
參照崔樹茂[8]的方法,在MRS液體培養基中添加乳酸鈉、乙酸鈉和NaCl,配成0.1、0.2、…、1.5 mol/L的鹽溶液,在無菌環境中用NaOH或HCl將溶液pH值調節至7.0。接入菌株后測定初始OD600,然后在37 ℃培養24 h,測定OD600,若OD600未發生變化,說明菌株被完全抑制,此樣品的鹽濃度為該菌株的最低抑菌濃度。
1.3.7 最適生長滲透壓及完全抑制滲透壓的測定
添加3 g/L的NaCl會使培養基的滲透壓平均增加100 mOsm/kg,而MRS液體培養基的滲透壓一般在350 mOsm/kg左右,計算NaCl的添加量,配制350、400、500、…、3 300 mOsm/kg的培養基,接入菌株后37 ℃培養,每2 h取樣測定OD600,繪制菌株的耐滲透壓曲線,計算菌株的代時。
1.3.8 碳氮消耗比測定
按照1.3.1氮源偏好分析培養基的配方,其中的氮源為各菌株的最適氮源。在菌株發酵過程中不斷監測OD600和發酵液中的葡萄糖濃度,計算生長速率被抑制時的碳氮消耗比。
1.3.9 生長限制性微量元素最適濃度的測定
利用恒pH自動反饋補糖培養分析微量元素的質量濃度及比例對活菌數的影響。培養基中分別稱取0.05、0.15、…、0.55 g/L的MnSO4和MgSO4,m(MnSO4)∶m(MgSO4)=1∶1,以相同的培養基和培養條件置于平行發酵罐,接入菌株后37 ℃恒pH 6.0補糖培養至穩定期,測定OD600和活菌數,優選出最佳質量濃度。然后在最佳質量濃度的基礎上,改變兩者的比例,重復上述操作,優選出微量元素之間的最佳比例。
1.3.10 最適生長pH的測定
設置不同的pH梯度:5.0、5.5、6.0、6.5,接入菌株后37 ℃培養至穩定期,測定OD600及活菌數。
1.3.11 恒pH分批培養
根據培養基的底物分析,確定最優的底物質量濃度,根據耐滲透壓曲線和碳氮消耗比,計算培養基中的碳源、氮源的添加量,培養基的初始滲透壓應低于菌株生長速率被抑制時的滲透壓。在發酵罐中恒最適pH發酵,37 ℃培養至穩定期,測定OD600及活菌數。
1.3.12 恒pH自動反饋補糖培養
推算恒pH培養時菌體被完全抑制時消耗的最適氮源添加量,根據底物分析,配制滲透壓為350 mOsm/kg左右的培養基,在發酵罐中以最適pH進行37 ℃恒pH補糖培養,補料液為400 g/L的葡萄糖溶液,穩定期測定OD600及活菌數。具體操作如下:
配制400 g/L(c堿)的NaOH溶液和400 g/L(c糖)的葡萄糖溶液,開啟發酵罐的補糖和補堿系統,關聯比例(k)根據公式(1)[8]設置:
(1)
式中:40,NaOH的摩爾分子量,g/mol;W,菌株代謝單位質量的葡萄糖產生的酸摩爾數,mol/g。
1.3.13 測定方法
菌體密度的測定:用紫外分光光度計在波長600 nm下測定發酵液的吸光度值,若吸光度值超過0.8,需要將菌液稀釋,使稀釋后菌液的吸光度值在0.2~0.8;活菌數的測定:平板菌落計數法;葡萄糖濃度的測定:葡萄糖試劑盒測定;滲透壓的測定:滲透壓儀測定。
1.4 數據統計分析
所有實驗均重復3次,實驗結果表示為平均值±標準偏差。實驗數據采用Origin 9.1繪圖,采用SPSS 25.0統計軟件進行單因素ANOVA判斷(鄧肯檢驗),P<0.05表示具有顯著性差異。
2 結果與分析
2.1 限制性底物的分析和優化
2.1.1 氮源利用的偏好性
乳酸菌利用葡萄糖發酵的效率高,可以直接利用葡萄糖進行生長代謝所需的一系列生化反應[11]。另外葡萄糖價格低廉,綜合考慮后,選擇葡萄糖作為發酵乳桿菌的最佳碳源。
氮源作為生長底物的一種,對乳酸菌的生長起著重要的作用。由于乳酸菌中存在著不同的蛋白水解酶系,因此不同的乳酸菌利用的最適氮源不同[12]。按照1.3.3的方法,系統研究單位質量(1 g)不同氮源對發酵乳桿菌的增殖效果,以此歸納出發酵乳桿菌對氮源利用的偏好性。
從表1可以看出,3株發酵乳桿菌在復合氮源(酵母浸粉528+牛骨蛋白胨+牛骨蛋白胨)培養基中的OD600與在其他單一氮源培養基中的OD600有顯著性差異(P<0.05),說明發酵乳桿菌對復合氮源的利用程度較高。這與SAFARI等[13]的研究結果一致,他們發現復合氮源更有利于嗜酸乳桿菌、干酪乳桿菌和植物乳桿菌等乳酸菌的生長。
除此之外,比較MRS氮源組和MRS氮源(MRS無機鹽)組,可以發現MRS氮源(MRS無機鹽)組的OD600明顯高于MRS氮源組,說明培養體系中無機鹽對發酵乳桿菌的增殖效果有影響,即無機鹽有可能是發酵乳桿菌的生長限制性因素。
另外,朱丹鳳等[14]研究發現,上述氮源中的氨基酸種類和含量豐富,所以排除了由于氮源中缺少必需氨基酸而影響菌株增殖的可能。從單一氮源來看,發酵乳桿菌對微生物類氮源的利用程度較高,這是因為這類氮源的肽相對分子質量90%都集中在500 Da以下(表2),說明發酵乳桿菌對小分子肽具有偏好性。但是將不同種類、不同分子質量的氮源復配后,發酵乳桿菌的利用程度更高,說明單一氮源中缺乏生長因子,而復配后的氮源中富含生長因子,從而促進了菌株的生長。綜上,酵母粉復合大分子肽的蛋白胨是發酵乳桿菌的最適氮源,這個結論可以為發酵乳桿菌工業化生產提供一定的指導。
2.1.2 生長限制性無機鹽
無機鹽一般是作為緩沖鹽被加入到培養基中,其能夠在菌體增殖時減緩發酵液pH值下降的速率,同時維持發酵環境的滲透壓。姚國強等[15]研究發現,LactobacillusreuteriIMAU10240在缺乏無機鹽的培養基中生長時,其生長速率明顯受到抑制。但是大部分乳酸菌在恒pH條件下生長時,其增殖情況并不受無機鹽存在與否的影響。本實驗通過對比發酵乳桿菌在2種培養基(添加無機鹽、未添加無機鹽)中的生長情況,探究在恒pH培養時,無機鹽對發酵乳桿菌的生長是否有促進作用。

表2 不同氮源的肽分布 單位:%
由2.1.1的結果可知,分批培養時,添加的無機鹽種類對發酵乳桿菌的增殖有一定的影響。但是,由圖1可知,在恒pH培養時,3株發酵乳桿菌在2種培養基中的生長情況大致相同,且穩定期的活菌數也不存在顯著性差異(P>0.05)。由此可以得知,在恒pH培養時,緩沖鹽的作用是維持發酵液pH的相對穩定,無機鹽的添加并不會對發酵乳桿菌的增殖起到促進作用。

a-發酵乳桿菌FXJCJ6-1;b-發酵乳桿菌FGDLZR161;c-發酵乳桿菌CCFM422圖1 發酵乳桿菌未添加和添加無機鹽恒pH培養的生長曲線及活菌數Fig.1 Growth curve and viable counts of L.fermentum cultured at constant pH with inorganic salts and or no inorganic salts注:不同小寫字母代表差異顯著(P<0.05),相同代表差異不顯著(下同)
2.1.3 生長限制性微量元素分析
微量元素是一類對微生物的生長有促進作用,但需要量極少的元素,通常是作為某些活性物質的組成成分或者酶的激活劑發揮作用[16]。在異型乳酸發酵中,Mn2+、Mg2+是多個關鍵酶的輔酶因子。Mg2+參與核蛋白體的聚合[17],適量的Mg2+能促進ATP的合成[18]。另外,李興峰[19]研究發現,Mn2+、Mg2+對乳酸脫氫酶的酶活有促進作用。CHENG等[20]研究發現,Mn2+在植物乳桿菌中充當了“代謝轉換”的作用,它調節了丙酮酸到乳酸等代謝途徑的代謝通量。因此,一般在發酵培養基中都會添加MnSO4和MgSO4來促進乳酸菌的生長。
由圖2可知,Mn2+和Mg2+對3株發酵乳桿菌的生長具有促進作用,發酵乳桿菌在Mn2+和Mg2+均添加的情況下生長效果明顯優于只添加單一微量元素的組別和空白組,具有顯著性差異(P<0.05)。因此,可以判定Mn2+和Mg2+是發酵乳桿菌的生長限制性微量元素。

a-發酵乳桿菌FXJCJ6-1;b-發酵乳桿菌FGDLZR161;c-發酵乳桿菌CCFM422圖2 發酵乳桿菌限制性微量元素分析結果Fig.2 Analysis results of limiting trace elements of L.fermentum
2.2 代謝產物的抑制
2.2.1 酸根積累對菌株的抑制作用
按照1.3.6的方法,研究pH 7.0條件下未解離的酸根對發酵乳桿菌的抑制,判斷酸根是否是發酵乳桿菌生長的主要限制性因素。測定了pH 7.0條件下NaCl、乙酸鈉和乳酸鈉對發酵乳桿菌的最低抑菌濃度。NaCl對菌株的抑制主要是滲透壓抑制,因此將NaCl的最低抑菌濃度作為研究酸根抑制的對照。若乙酸鈉和乳酸鈉的最低抑菌濃度低于NaCl的最低抑菌濃度,則表明酸根對發酵乳桿菌具有特異性毒害作用。
由表3可知,NaCl、乙酸鈉和乳酸鈉在pH 7.0條件下對發酵乳桿菌的最低抑菌濃度均相同,說明pH 7.0時,乙酸根和乳酸根對這3株發酵乳桿菌的抑制是由于酸根積累引起的滲透壓升高,即,未解離的酸根并不會對發酵乳桿菌有特異性毒害作用,發酵乳桿菌的生長主要是受到滲透壓的抑制。

表3 NaCl、乙酸鈉和乳酸鈉在pH 7.0時對發酵乳桿菌的最低抑菌濃度 單位:mmol/L
2.2.2 最適生長滲透壓與完全抑制滲透壓
由2.2.1的結果可知,發酵乳桿菌生長的主要抑制因素是酸根積累引起的滲透壓升高,因此,需要重點研究每株菌對環境滲透壓的耐受程度,以此更好地優化菌株的培養工藝。
由圖3可知,發酵乳桿菌FXJCJ6-1和FGDLZR161在滲透壓為1 000 mOsm/kg時生長速率被抑制,發酵乳桿菌CCFM422在滲透壓為1 200 mOsm/kg時生長速率被抑制。
2.3 培養工藝的優化
2.3.1 底物濃度的優化
2.3.1.1 碳氮比
基于2.1.1最適氮源的結果,按照1.3.8的方法,測定發酵乳桿菌利用最佳氮源生長速率被抑制和完全被抑制時的葡萄糖濃度,結果如表4所示。
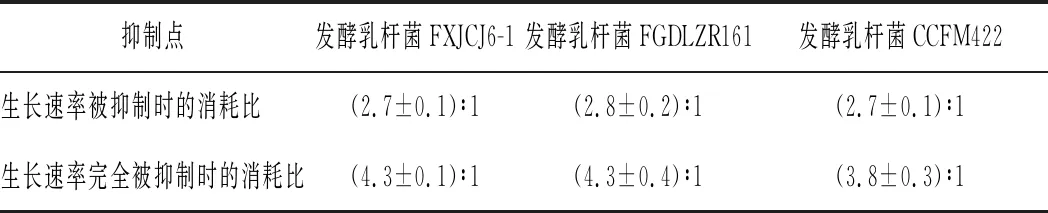
表4 發酵乳桿菌生長速率被抑制和完全被抑制時的碳氮消耗比Table 4 Ratio of carbon and nitrogen consumption when the growth rate of L.fermentum was suppressed and completely suppressed
DISHISHA等[21]研究發現,培養基中碳源和氮源比例過低時,菌體代謝旺盛產生大量的代謝廢物,從而抑制菌體增殖;碳源和氮源比例過高時,菌體主要利用營養物質來合成積累代謝產物。王玉林等[22]研究發現,培養基的最適碳氮比為生長速率被抑制時的消耗比時,菌株的增殖效率最高。由表4可知,發酵乳桿菌FXJCJ6-1和CCFM422的最佳碳氮比為2.7,發酵乳桿菌FGDLZR161的最佳碳氮比為2.8。基于菌株生長速率被抑制時的碳氮比結果及滲透壓值,最大程度地提高培養基中的碳、氮含量,以此提高菌株的發酵密度。
2.3.1.2 限制性微量元素濃度及比例的優化
由2.1.3的結果可知,Mn2+和Mg2+均是發酵乳桿菌的生長限制性微量元素,因此,探究Mn2+、Mg2+質量濃度及比例與活菌數之間的關系。

a、c、e-發酵乳桿菌FXJCJ6-1、FGDLZR161、CCFM422的耐滲透壓曲線;b、d、f-發酵乳桿菌FXJCJ6-1、FGDLZR161、CCFM422不同滲透壓下的代時圖3 發酵乳桿菌的耐滲透壓曲線及不同滲透壓下的代時Fig.3 The osmotic pressure curve of L.fermentum and the generation time under different osmotic pressure conditions
由圖4-a、4-c、4-e可知,確定m(Mg2+)∶m(Mn2+)=1∶1時,Mg2+和Mn2+的總質量濃度越高,活菌數越高,但增加到一定程度后,活菌數的變化差異不大,說明一定范圍內提高Mg2+和Mn2+的質量濃度,可以提高菌體的增殖效果。這與PHAM等[23]的研究結果一致,他們發現Mn2+質量濃度過高時會抑制α-葡萄糖苷酶等水解酶,對菌體增殖造成負面影響。
在Mg2+、Mn2+的最適質量濃度的基礎上改變Mg2+和Mn2+的比例,由圖4-b、4-f可知,m(Mg2+)∶m(Mn2+)=1∶1時,發酵乳桿菌FXJCJ6-1和CCFM422的活菌數與其他組有顯著性差異(P<0.05);而圖4-d表明Mg2+和Mn2+的質量比對發酵乳桿菌FGDLZR161的影響不是很大。
綜上,培養發酵乳桿菌FXJCJ6-1的微量元素為m(Mg2+)∶m(Mn2+)=1∶1,總質量濃度為0.35 g/L;培養發酵乳桿菌FGDLZR161的微量元素為m(Mg2+)∶m(Mn2+)=3∶1,總質量濃度為0.35 g/L;培養發酵乳桿菌CCFM422的微量元素為m(Mg2+)∶m(Mn2+)=1∶1,總質量濃度為0.45 g/L。
2.3.2 最適生長pH
乳酸菌的最適生長pH值一般在5.0~7.0,不同乳酸菌的最適生長pH不同。乳酸菌在發酵過程中會產生有機酸,從而使發酵液pH低于正常生長pH范圍,導致菌株的細胞膜滲透性和細胞內酶活性受到干擾[24]。在確定了最優培養基的基礎上,設置不同的pH梯度,探究3株發酵乳桿菌的最適生長pH。
從圖5可以看出,發酵乳桿菌FXJCJ6-1的最適pH值為6.0,發酵乳桿菌FGDLZR161和CCFM422的最適pH值為5.5。

a、b-發酵乳桿菌FXJCJ6-1 Mg2+、Mn2+的濃度和比例優化結果;c、d-發酵乳桿菌FGDLZR161 Mg2+、Mn2+的濃度和比例優化結果;e、f-發酵乳桿菌CCFM422 Mg2+、Mn2+的濃度和比例優化結果圖4 發酵乳桿菌限制性微量元素質量濃度及比例優化Fig.4 Optimization results of the mass concentration and proportion of limiting trace elements in L.fermentum

圖5 發酵乳桿菌的生長pH優化結果Fig.5 Optimization results of growth pH of L.fermentum
2.3.3 恒pH分批培養
恒pH分批培養,是將底物一次性加到發酵罐中恒pH培養。根據上述的限制性底物分析結果以及耐滲透壓曲線和碳氮消耗比,確定培養基中的碳源、氮源、微量元素的添加量,需要注意的是培養基的初始滲透壓應低于菌株生長速率被抑制時的滲透壓。
(1)發酵乳桿菌FXJCJ6-1恒pH分批培養
由表5可知,培養基初始滲透壓接近于生長速率被抑制的滲透壓時,發酵液中的活菌數最大。因此,發酵乳桿菌FXJCJ6-1恒pH分批培養的最佳培養基配方(g/L):氮源40(酵母浸粉528 8、牛骨蛋白胨 16、魚骨蛋白胨 16),葡萄糖 108,MgSO40.175,MnSO40.175,Tween 80 1 mL,恒pH 6.0培養,活菌數為(1.3±0.1)×1010CFU/mL,較在MRS靜置培養時的活菌數(3.2±0.07)×109CFU/mL,提高了3.1倍。
(2)發酵乳桿菌FGDLZR161恒pH分批培養
由表6可知,培養基初始滲透壓接近于生長速率被抑制的滲透壓時,發酵液中的活菌數最大。因此,發酵乳桿菌FGDLZR161恒pH分批培養的最佳培養基配方(g/L):氮源40(酵母浸粉528 8、牛骨蛋白胨 16、魚骨蛋白胨 16),葡萄糖 112,MgSO40.26,MnSO40.09,Tween 80 1 mL,恒pH 5.5培養,活菌數為(1.1±0.1)×1010CFU/mL,較在MRS靜置培養時的活菌數(2.3±0.03)×109CFU/mL,提高了3.8倍。

表5 發酵乳桿菌FXJCJ6-1的恒pH分批培養的培養基及培養結果Table 5 Constant pH batch culture medium and culture results of L.fermentum FXJCJ6-1

表6 發酵乳桿菌FGDLZR161的恒pH分批培養的培養基及培養結果Table 6 Constant pH batch culture medium and culture results of L.fermentum FGDLZR161
(3)發酵乳桿菌CCFM422恒pH分批培養
由表7可知,氮源40和45 g/L條件下活菌數差異不大,考慮成本問題,選擇40 g/L的氮源進行培養。因此,確定發酵乳桿菌CCFM422恒pH分批培養的最佳培養基配方(g/L):氮源40(酵母浸粉 528 8、牛骨蛋白胨 16、魚骨蛋白胨 16),葡萄糖 108,MgSO40.225,MnSO40.225,Tween 80 1 mL,恒pH 5.5培養,活菌數為(9.5±0.5)×109CFU/mL,較在MRS靜置培養時的活菌數(1.7±0.07)×109CFU/mL,提高了4.6倍。

表7 發酵乳桿菌CCFM422的恒pH分批培養的培養基及培養結果Table 7 Constant pH batch culture medium and culture results of L.fermentum CCFM422
2.3.4 恒pH自動反饋補糖培養
恒pH自動反饋補糖培養是基于較低的滲透壓條件,后期根據底物消耗自動補料,這種培養模式避免了高濃度底物引起的限制,可以最大程度地減緩發酵液滲透壓的升高,對耐滲透壓能力較弱菌株的增殖效果較好。結果如圖6所示。

a-發酵乳桿菌FXJCJ6-1;b-發酵乳桿菌FGDLZR161;c-發酵乳桿菌CCFM422圖6 發酵乳桿菌恒pH分批培養和自動反饋補糖培養結果Fig.6 Constant pH automatic feedback sugar supplement results of L.fermentum
恒pH自動反饋補糖培養時,發酵乳桿菌FXJCJ6-1、FGDLZR161、CCFM422穩定期活菌數分別為(6.8±0.1)×109、(7.9±0.9)×109和(7.1±0.2)×109CFU/mL。由于發酵乳桿菌能夠耐受較高的滲透壓,所以恒pH自動反饋補糖培養的低滲優勢沒有得到很好的體現。因此選擇恒pH分批培養來增殖發酵乳桿菌。
3 結論
(1)發酵乳桿菌對不同種類的氮源利用偏好性不同,酵母粉復合大分子肽的蛋白胨是發酵乳桿菌的最適氮源。
(2)無機鹽只是起到減緩發酵液pH降低速率的作用,在恒pH培養發酵乳桿菌時,添加無機鹽并不能提高菌株的增殖效果。
(3)Mn2+和Mg2+均是發酵乳桿菌的生長限制性微量元素,菌體的高效增殖需要兩者同時存在。
(4)中性條件下,酸根積累并不會對發酵乳桿菌有特異性毒害作用,發酵乳桿菌的生長主要是受到滲透壓的抑制,且發酵乳桿菌能夠耐受較高的滲透壓環境。
(5)恒pH分批培養是發酵乳桿菌的最優培養工藝。恒pH分批培養發酵乳桿菌時,初始底物濃度應基于菌株的耐滲透壓曲線進行設定,培養基的初始滲透壓應接近于菌株生長速率被抑制時的滲透壓,而培養基中的碳氮源添加比例應按照菌株生長速率被抑制時的碳氮消耗比進行設定。

