人乳糜化脂肪來源干細胞生物學特性的初步研究
陳俊男 李治樺 賴琳英 周桂文 梁黎明 陳敏亮
[關鍵詞]乳糜化脂肪;間充質干細胞;生物學特性;表面標記物
脂肪源性基質/干細胞(Adipose d e r i v e d s t e mcells,ASCs)是一類來源于脂肪組織的成體間充質干細胞,具有自我更新和優良多向分化潛能,且取材容易、取材量大、對組織損傷小、干細胞含量豐富、增殖能力強大、不受倫理約束等優點使其迅速成為組織工程與修復領域的研究熱點[1]。2001年,Zuk等[2-3]首先發現ASCs,他們在體外能夠很好地擴增,具有多向分化能力,治療涵蓋多領域[4-6]。不僅如此,ASCs能夠分泌細胞因子,建立良好的損傷修復微環境,提高機體組織修復能力等[7-8]。2013年,Patrick Tonnard等[9]通過機械乳化與過濾方式把抽吸脂肪組織制成“納米脂肪(Nanofat)”,用于臨床治療并獲較好效果。研究收集3種脂肪樣本(Macrofat顆粒脂肪,Microfat微粒脂肪及Nanofat),三者比較分析發現,Nanofat內含有大量優質ASCs。
本研究對傳統負壓抽吸獲得的自體顆粒脂肪,先經特殊步驟處理得到“乳糜化脂肪(Chyle fat)”,然后從中提取乳糜化脂肪來源干細胞(Chyle fat derived stemcells,CFSCs)并進行體外分離、培養、鑒定、多向誘導等實驗,旨在對同一個體、相同體積的兩種脂肪樣本中分離、純化的間充質干細胞,從形態學觀察、干細胞表型鑒別及誘導分化能力進行分析比較,初步研究CFSCs的形態學特征及生物學特性,以期為以干細胞為基礎的相關臨床治療提供實驗依據和技術支持。
1 材料和方法
1.1 脂肪組織樣本來源:本實驗所用人脂肪標本材料來自解放軍總醫院第四醫學中心燒傷整形科接受脂肪抽吸手術的1例女性患者(35歲)。抽脂部位為下腹部,患者無急、慢性病史,且已簽署知情同意書。
1.2 研究方法
1.2.1 Chyle fat的制備
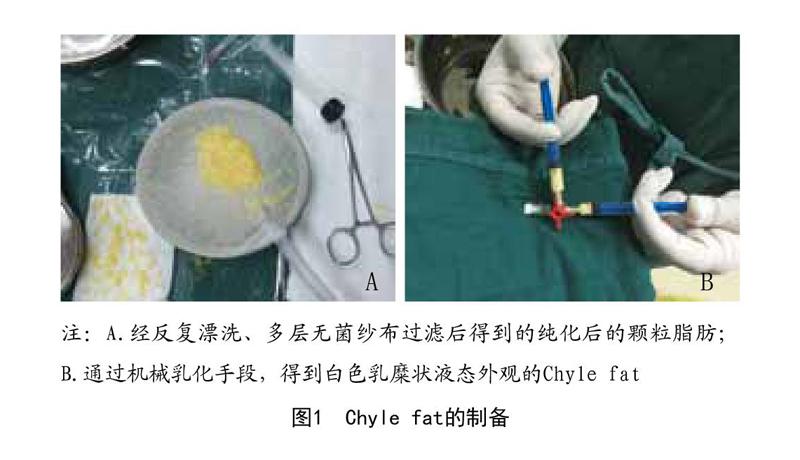
1.2.1.1 顆粒脂肪制備:脂肪抽吸是在1例35歲女性患者接受腹部整形修復手術的過程中進行的。術前腫脹液的配比如下:無菌生理鹽水1 000ml+2%利多卡因注射液400mg+鹽酸腎上腺素注射液1mg。20ml注射器回抽10ml(抽吸負壓值60kPa)及管徑3mm伴多個側孔直徑1mm進行脂肪抽吸手術。將收獲的脂肪用林格氏液沖洗干凈并通過孔徑為0.5mm的無菌尼龍布過濾、清洗、純化,剔除粗大纖維結締組織,無菌罐內收集經過處理后的脂肪樣本,分裝存儲在無菌的離心管內,每管30ml,每3管為一組,計算均值作為一次實驗數據結果。
1.2.1.2 Chyle fat制備:將顆粒脂肪經孔徑大小為0.8mm的納米轉換頭(BD Luer-Lok connector)在兩個5ml注射器內快速對打30次,通過機械乳化的方法,使脂肪轉換成白色的乳糜狀液態,將脂肪液體再次用無菌尼龍布過濾,收集Chyle fat,同法分裝儲存于離心管內,每管30ml,3管為一組,計算均值作為一次實驗數據。見圖1。
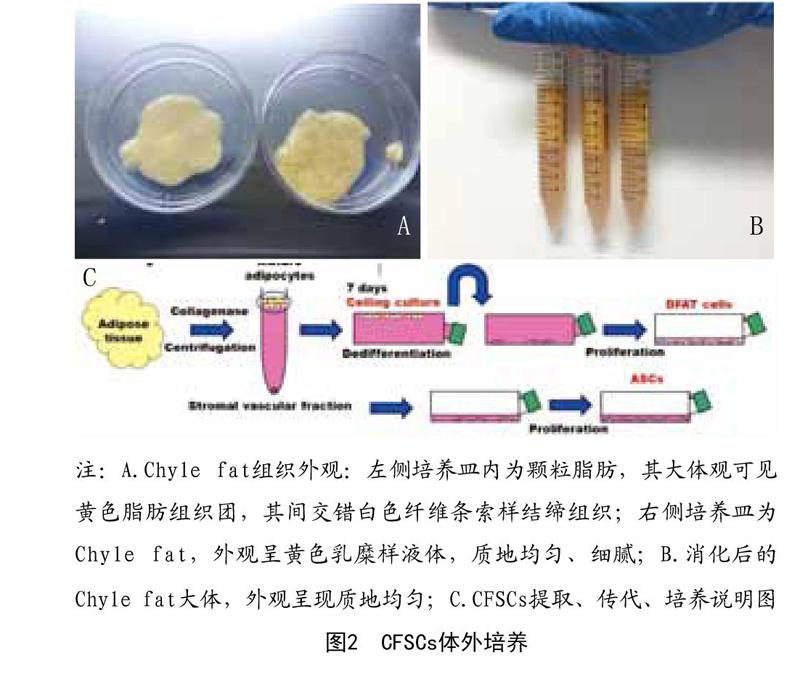
1.2.2 分離提取CFSCs及其體外培養:ASCs及CFSCs的分離來自不同的脂肪抽吸物(顆粒脂肪和Chyle fat),分離提取CFSCs步驟均參照Zuk法。具體操作為:每管以1:1(等體積)比例加入相應體積的含有0.1% Ⅱ型膠原酶的磷酸鹽緩沖液,37℃恒溫搖床勻速80r/min振蕩消化45min,觀察混合物呈均質勻漿狀即為消化完全,再加同等體積DMEM/F12培養基(其中含體積分數10%胎牛血清及體積分數1% 100IU青霉素、100mg/ml鏈霉素)中和膠原酶終止消化,之后2 000rpm/min離心10min,吸出上層液體和破碎脂肪油脂并丟棄,將基質細胞沉淀重懸于磷酸鹽緩沖鹽水中,用70μm細胞尼龍篩網過濾,并將濾液收集,而后1 600rpm/min離心10min,吸出上清,培養基重懸基底細胞沉淀,調整細胞濃度為1×105/cm2,接種到25T培養瓶內,于37℃、5% CO2飽和濕度的培養箱內孵育。本實驗選取P3代脂肪干細胞進行研究。見圖2。
1.2.3 CFSCs細胞形態學觀察:倒置相差顯微鏡下觀察CFSCs接種不同時間細胞形態的變化、分布及克隆增殖情況。
1.2.4 流式細胞術檢測CFSCs表面抗原標記:取P3代CFSCs,0.25%胰酶消化,PBS洗滌2次,1% BSA(牛血清白蛋白)吹打均勻,制備成每管濃度為1×106/100μl分裝,每支EP管100μl。然后分別加入FITC偶聯小鼠抗人CD105、FITC偶聯小鼠抗人CD90、BV421偶聯抗人CD73、BV421偶聯抗人CD34單克隆抗體每管5μl、Pe偶聯抗人CD31、Pe偶聯抗人CD45單克隆抗體每管20μl,設立空白同型對照,送流式細胞儀檢測。
1.2.5 CFSCs多能誘導分化
1.2.5.1 成脂誘導鑒定:P3代CFSCs細胞,2×104/cm2接種于六孔板至細胞100%融合,加成人ASCs成脂肪誘導培養基A(10%胎牛血清+培養基A+1%青鏈霉素+500μmol/L 3-異丁基-1-甲基黃嘌呤)誘導3d,棄A加B液(10%胎牛血清+培養基B+1%青鏈霉素+谷氨酰胺+400μl胰島素)。A、B液交替使用20d,顯微鏡觀察細胞形態變化,油紅〇染色:將培養板置于顯微鏡下對成脂染色觀察并拍照。
1.2.5.2 成骨誘導鑒定:P3代CFSCs細胞,換用成骨誘導液(成骨誘導液+10%胎牛血清+1%雙抗+400μl抗壞血酸、20μl地塞米松、2ml β-甘油磷酸鈉)誘導培養,設計對照組,誘導培養5周。誘導期間每日顯微鏡下觀察細胞形態學改變情況,終末期行茜素紅染色,顯微鏡下觀察并拍照記錄。
1.2.5.3 成軟骨誘導鑒定:取P3代CFSCs細胞,加入成軟骨誘導培養基(成軟骨培養基+20μl地塞米松+600μl抗壞血酸+2ml ITS添加物+200μl丙酮酸鈉+200μl脯氨酸),采用微團培養法誘導分化連續培養1個月,對照組僅用常規配制的DMEM培養。誘導4周后行阿利辛藍染色觀察,對細胞外基質酸性多糖的陽性染色來鑒別成軟骨分化結果。
1.2.6 CFSCs細胞增殖能力檢測(CCK-8法):取P3代CFSCs細胞,96孔板接種細胞懸液,100μl/孔,測6孔/天,實驗時間共7d,將首次接種的培養板放入培養箱中預培養24h,每孔加入配置CCK-8工作液100μl,再用酶標儀檢測在450nm的吸光度值,連續檢測7d。以OD對培養時間繪制細胞生長曲線。
1.2.7 統計學分析:運用SPSS 22.0軟件進行數據分析。所有數據以均數±標準差(x?±s)表示,組間數據比較用t 檢驗,以P <0.05為差異有統計學意義。
2 結果
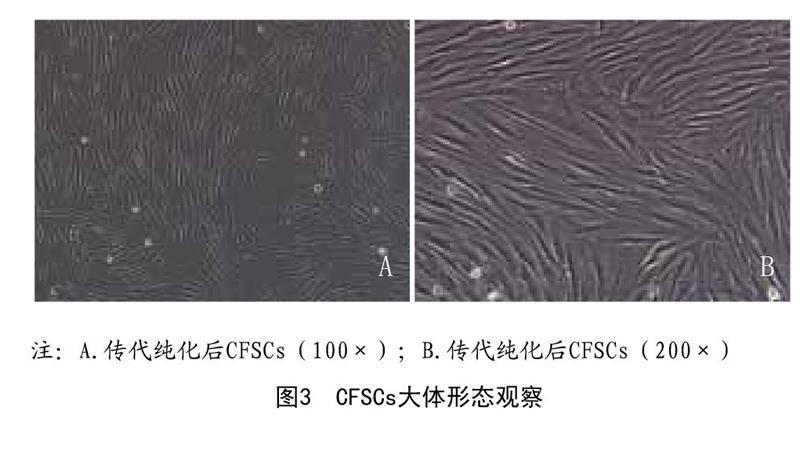
2.1 CFSCs細胞形態學:CFSCs原代經24h左右可貼壁,接種24h后可見大約半數細胞貼壁,形狀呈現出圓形或菱形,大小不一,此時在培養瓶內可見大量透光度亮的紅細胞等漂浮,48h左右細胞數量上升,長梭形為主,培養至5~7d后細胞進入指數增殖期,局部融合排列緊密,呈放射狀或平行狀緊密排列,此時視為細胞傳代時機。原代細胞一般在3~5d即可達90%以上融合,二、三代后CFSCs細胞生長良好。見圖3。
2.2 CFSCs表面標記物免疫表型檢測:流式細胞儀檢測P3代CFSCs免疫表型結果:①CFSCs:P3代CFSCs細胞呈CD105(95.32%)、CD90(90.16%)、CD73(96.90%)陽性表達,同時呈白細胞、造血細胞系及內皮細胞分子標記物CD45(0.25%)、CD34(0.39%)、CD31(0.18%)陰性表達; ② 顆粒脂肪A S C s : P 3 代A S C s 細胞呈C D 1 0 5(90.89%)、CD90(89.07%)、CD73(90.62%)陽性表達,同時其呈CD45(0.04%)、CD34(0.05%)、CD31(0.23%)陰性表達,間接排除白細胞、造血細胞系和內皮細胞的污染。見圖4。
2.3 CFSCs三系誘導結果
2.3.1 成脂誘導結果:P3代CFSCs成脂肪誘導分化第4天開始,可以觀察到生細胞形態逐漸由梭形變為橢圓形或圓形,細胞胞質內有大小不一、晶瑩透亮的脂滴形成,油紅〇染色示細胞內脂滴呈桔紅色。見圖5。
2.3.2 成骨誘導結果:P3代CFSCs成骨細胞誘導后,大量細胞呈現出不規則的形狀,且體積開始慢慢變大,之后細胞開始密集、重疊,出現聚集,細胞胞質內出現顆粒狀物質,茜素紅染色示桔紅色鈣化結節的類骨小梁結構。見圖6。
2.3.3 成軟骨誘導結果:P3代CFSCs成軟骨細胞誘導后,大量細胞出現體積變大變圓,胞質十分豐富,阿利辛藍染色示軟骨組織內酸性粘多糖著色效果。見圖7。
2.4 CFSCs細胞生長曲線:CCK8法檢測P3代CFSCs,以細胞的吸光度值為縱坐標,以培養時間為橫坐標,標畫生長曲線。可以看出,同ASCs的生長曲線相似,CFSCs在經歷了一個快速增殖期后,逐漸進入平臺期,從第6天開始,細胞增殖達到頂點并出現接觸抑制的現象。見圖8。
3 討論
分離ASCs方法主要有:一為脂肪組織固體團塊;二為負壓吸引法所得到的液態脂肪組織。但是,何種方法能夠獲取更多干細胞團呢?該疑問尚未解決,有待于更進一步地深入探究[10-11]。從分離、提取ASCs角度看,脂肪抽吸手術因來源豐富、操作簡單、取材方便、創傷痛苦小等諸多優勢,臨床實踐證實其遠比切除脂肪法更具優勢。最常見的脂肪抽吸術式仍為腫脹法脂肪抽吸術[12],但是要注意抽吸壓力的掌控,否則會導致ASCs產量大幅下降或影響干細胞的增殖活性[13]。
研究證實腹部、側腹部所獲得的ASCs產量無顯著性差異[14]。本研究選取低負壓(60kPa)抽吸方式得到游離脂肪組織,乳糜化機械分離結合酶消化法成功獲取到CFSCs,該細胞梭形且呈貼壁生長[15]。
Kim等[ 1 6 ]研究發現,高濃度含葡萄糖培養基可以加速干細胞老化,抑制干細胞的增殖、分化。故本實驗采用DMEM/F12培養基培養人CFSCs,發現通過機械乳化和酶消化后分離提取的人CFSCs體外培養時克隆增殖快,傳代間隔時間短,連續多次傳代亦未出現顯著衰老跡象。SVF中除ASCs外,還包括內皮細胞、脂肪前體細胞等多種細胞[17]。未避免上述混合細胞群可能對ASCs表型鑒定、增殖能力等結果造成干擾、混淆實驗數據,本實驗應用CFSCs的貼壁特性,通過多次離心清洗的方式盡量去除大部分懸浮細胞,使得CFSCs因其可貼壁牢固從而存留。然而,原代培養CFSCs時存在被成纖維細胞污染之可能,且兩者形態神似,均無特異性鑒別標志。那么,漂洗及消化時間在此顯得尤為重要,因為不同細胞的貼壁、消化時間均不一致,知曉成纖維細胞消化所需時間顯著長于CFSCs后,只需要采用適當的消化時間就能有效地去除此類雜質細胞。
本次用流式細胞術檢測P3代CFSCs膜表面的抗原,結果提示:①CFSCs細胞高表達CD105(95.32%)、CD90(90.16%)、CD73(96.90%)等間充質細胞標記物,而不表達造血系細胞標記物、共刺激分子及部分黏附分子如CD45(0.25%)、CD34(0.39%)、CD31(0.18%);②顆粒脂肪ASCs的細胞表面標志抗原表達情況:CD105(90.89%)、CD90(89.07%)、CD73(90.62%)、CD45(0.04%)、CD34(0.05%)、CD31(0.23%)。CD34和CD31代表血管內皮細胞標記物,兩者在上述乳糜化脂肪中的極低表達說明提取并純化過的CFSCs不含血管內皮細胞、造血系細胞等。CD45在所有白細胞上都有表達,也叫其白細胞共同抗原,該抗原的低表達量也證明了本實驗分離獲得的細胞并非白細胞等血液來源細胞。提示:獲取的CFSCs為高度均一的間充質來源細胞群,充分說明乳糜化脂肪中提取到的CFSCs呈現間充質干性極強特性。本實驗尚對CFSCs進行增殖及三系分化潛能檢測,結果顯示:同傳統的顆粒脂肪ASCs相似,CFSCs具有強大的增殖能力和向外、中、內胚層分化的能力。
本實驗在制備乳糜化脂肪時,脂肪細胞在機械乳化過程中被大量破壞,鏡下未見明顯脂肪細胞,但是乳糜化脂肪樣本后期的細胞培養與純化過程中,成功分離出具備良好分化潛能的CFSCs,該CFSCs具有粘附性,能夠貼壁形成單層,并表現出成纖維細胞形態,且其具備干細胞免疫表型,并可在不同誘導條件下向成熟脂肪細胞、骨細胞、軟骨細胞分化。研究結果說明:乳糜化脂肪內含有大量優質干細胞(CFSCs)。
類似Nanofat,乳糜化脂肪不在于容積構建,因其內缺少脂肪細胞。前期臨床研究[18]發現,乳糜化脂肪移植能夠改善瘢痕內Ⅰ、Ⅲ型膠原蛋白排列順序使增生性瘢痕趨于平坦。結合本實驗研究結果得出:乳糜化脂肪內都不含脂肪細胞了,還能稱其為脂肪移植嗎,改善瘢痕質地及組織性質的關鍵又是什么呢?考慮主要起效的為其內所含的干細胞。因此,乳糜化脂肪注射可以被想象成是一個體內組織工程重建過程。乳糜化脂肪移植治療瘢痕是一種非常有價值的臨床技術,其機制仍需進一步研究。

