血清TK1、ULBP2水平預測轉移性結直腸癌患者化療效果的臨床研究
程傳耀 解智慧 柴慧芳 秦長江
結直腸癌(CRC)發病率及病死率較高,據報道,CRC發病率占胃腸道腫瘤第三位,且多發于40歲以上中老年群體,男性發病率較女性高,近年發病率呈升高趨勢[1]。轉移是CRC惡化特征,CRC的遠處轉移主要是肝臟,約50%的CRC患者發生術前或術后肝臟轉移[2]。目前,化療是治療轉移性CRC的主要手段之一,可取得一定療效,但仍有部分患者經化療效果不佳,預后較差[3]。因此,尋求可早期預測轉移性CRC患者化療效果的新型標志物十分必要。胸苷激酶1(TK1)屬于細胞內周期依賴性酶,TK1在增殖旺盛的細胞中含量顯著升高,據報道,TK1活性受到腫瘤增殖影響,可用來評估腫瘤增殖程度[4]。UL16結合蛋白2(ULBP2)是自然殺傷細胞表面活化性受體,在抗腫瘤免疫及抗感染免疫等中發揮重要作用,據報道,ULBP2在諸多腫瘤疾病患者的血清中呈高表達[5]。故推測血清TK1、ULBP2可能參與CRC的發生及發展,與化療效果具有潛在聯系,但目前關于此類研究較少。本研究主要觀察血清TK1、ULBP2在轉移性CRC患者中的表達,并分析二者預測患者化療效果的價值,為臨床提高CRC化療效果提供依據。具示如下。
1 資料與方法
1.1 一般資料
選取2017年10月至2019年12月本院收治的81例轉移性CRC患者為研究對象,本研究得到醫學倫理委員會批準,且患者及家屬簽署知情同意書。男性51例,女性30例;年齡49~69歲,平均年齡(60.21±5.19)歲;轉移類型:同時性轉移58例、異時性轉移23例;病理類型:結腸癌50例、直腸癌31例;TNM分期[6]:Ⅰ期~Ⅱ期36例、Ⅲ期~Ⅳ期45例。
1.2 入選標準
1.2.1 納入標準 ①患者均符合《現代腫瘤學》[7]轉移性CRC診斷標準,且經穿刺或手術組織病理活檢檢查確診;②入院前未接受手術或放化療;③預計生存期≥3個月;④患者均在本院完成4個周期的化療(28 d為1個周期),且獲得隨訪;⑤精神正常,可溝通交流。
1.2.2 排除標準 ①合并重要臟器病變或功能不全;②合并其他惡性腫瘤;③伴全身感染性疾病或自身免疫性疾病;④伴凝血功能異常;⑤合并神經系統疾病。
1.3 方法
1.3.1 化療方法 給予患者西妥昔單抗聯合FOLFOX4化療方案:西妥昔單抗首次400 mg/m2,靜脈滴注2 h,之后每周維持量250 mg/m2,靜脈滴注1 h,最大滴速≤5 ml/min;治療前30 min給予患者使用靜脈用地塞米松5 mg,肌內注射異丙嗪25 mg進行預處理;西妥昔單抗在化療藥物應用前使用,第2天開始應用化療藥物。FOLFOX4化療方案:靜脈滴注奧沙利鉑85 mg/m2,d1;亞葉酸鈣200 mg/m2,d1~2;5氟尿嘧啶500 mg/m2,d1~5;持續28 d為1周期,化療4個周期評估短期療效。
1.3.2 化療效果評估及分組方法 化療4個周期時,參照實體瘤相關評估標準[8]評價患者化療效果,完全緩解:靶病灶完全消失,持續時間>1個月;部分緩解:靶病灶最大直徑×最大垂直直徑縮小≥50%,且持續時間>1個月;穩定:靶病灶最大直徑×最大垂直直徑縮小<50%,或增加≤25%;進展:靶病灶最大直徑×最大垂直直徑增加>25%或出現新病灶。本研究中將化療效果為完全緩解、部分緩解患者納為緩解組;反之設為無效組。
1.3.3 血清TK1、ULBP2水平檢測方法 采集患者入院時、化療結束時清晨空腹靜脈血5 ml,置于抗凝管中靜置10 min,以2 000 r/min速率離心15 min備用;采用酶聯免疫吸附法檢測血清ULBP2、TK1、癌胚抗原(CEA)水平。
1.4 統計學方法

2 結果
2.1 入院時、化療結束時患者血清ULBP2、TK1水平比較
81例結直腸癌患者化療結束時血清ULBP2、TK1水平均較入院時降低,差異有統計學意義(P<0.05)。見表1。
2.2 化療效果及患者分組情況
81例轉移性CRC患者經評估發現,12例(14.81%)完全緩解,41例(50.62%)部分緩解,21例(25.93%)穩定,7例(8.64%)進展。緩解組53例(65.43%),無效組28例(34.57%)。
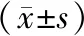
表1 81例結直腸癌患者化療前后血清ULBP2、TK1水平比較
2.3 2組患者相關資料比較
2組基線資料、CEA水平比較差異無統計學意義(P>0.05);無效組血清ULBP2、TK1水平高于緩解組(P<0.05)。見表2。
2.4 各指標影響轉移性CRC患者化療效果的Logistic回歸分析結果
經單項Logistic回歸分析結果顯示,血清ULBP2、TK1過表達可能是轉移性CRC患者化療無效的影響因素(OR>1,P<0.05)。見表3。

表2 2組患者相關資料比較

表3 各指標影響轉移性CRC患者化療效果的Logistic回歸分析結果
2.5 各指標影響轉移性CRC患者化療效果的多元回歸分析結果
將轉移性CRC患者化療效果作為狀態變量(1=無效,0=緩解),將血清ULBP2、TK1作為協變量,同時納入其他基線資料,建立多元回歸模型,在校正性別、年齡、轉移類型、病理類型、TNM分期帶來影響后,結果顯示,血清ULBP2、TK1過表達是結直腸癌患者化療無效的影響因素(OR>1,P<0.05)。見表4。
2.6 血清ULBP2、TK1單獨及聯合預測轉移性CRC患者化療效果的價值分析
將轉移性CRC患者化療效果作為狀態變量(1=無效,0=緩解),將血清ULBP2、TK1作為檢驗變量,繪制ROC曲線圖(見圖1),結果顯示,當血清ULBP2、TK1的cut-off值分別取79.90 ng/l、5.145 pmol/l時,提示化療效果不良高風險,且此時血清ULBP2、TK1單獨及聯合預測患者化療效果不良的AUC分別為0.842、0.849、0.879,均有一定預測價值。見表5。

表4 各指標影響轉移性CRC患者化療效果的多元回歸分析結果

表5 血清ULBP2、TK1單獨及聯合預測轉移性CRC患者化療效果的價值分析

圖1 血清ULBP2、TK1單獨及聯合預測轉移性CRC患者化療效果的ROC曲線
3 討論
目前,西妥昔單抗聯合化療是治療轉移性CRC的一線方案,可在一定程度上延長患者生存期,改善生存質量[9]。但仍有部分轉移性CRC患者經標準化療方案治療后,生存時間短,化療效果不佳,預后較差[10]。王玲[11]研究了92例接受西妥昔單抗聯合化療方案治療的轉移性CRC患者化療情況,結果顯示,42例患者治療效果不佳,占45.65%。本研究中81例轉移性CRC患者經評估發現,28例患者治療無效,占34.57%,略低于上述研究,可能與患者的納入及排除標準等因素有關。但上述結果均提示轉移性CRC患者經化療后,仍有部分效果不佳,故尋求新型指標預測患者化療效果至關重要。
TK1是DNA合成的關鍵酶,完整的TK1是四聚體形式,參與細胞周期DNA合成及損傷修復調節[12]。正常健康人很難檢測到TK1,但腫瘤患者血清及組織中TK1表達高,死亡細胞釋放的TK1進入血液循環,使血清TK1成為腫瘤細胞生長及繁殖的重要標志物[13-14]。據報道,通過檢測血清中TK1含量,可在一定程度上反映患者體內腫瘤細胞增殖情況,對評估腫瘤惡性程度、判斷預后有重要的指導意義[15]。故推測血清TK1水平對預測轉移性CRC患者化療無效風險有一定價值。ULBP是自然殺傷細胞2族成員D受體(NKG2)的重要活化性配體,一旦機體受到惡性病變刺激,ULBP與受體相結合可激活自然殺傷細胞,增強腫瘤細胞因子分泌[16]。ULBP2與巨噬細胞活化程度具有密切關系,可增強巨噬細胞吞噬NKG2受體靶細胞能力,活化天然免疫效應細胞,對抗腫瘤免疫起到重要作用[17]。研究顯示,在細胞快速增殖、高分化狀態下,ULBP2表達水平明顯升高,目前已證實,ULBP2在多種腫瘤血清中呈高表達狀態[18]。故推測血清TK1、ULBP2對預測轉移性CRC患者化療效果均有一定價值。
本研究結果顯示,81例轉移性CRC患者化療結束時血清ULBP2、TK1水平較化療實施前降低,且化療無效組血清ULBP2、TK1水平高于緩解組,且經回歸分析結果顯示,血清ULBP2、TK1過表達是轉移性CRC化療無效的影響因素,提示血清ULBP2、TK1水平在轉移性CRC患者中呈高表達,經規范化療后,水平有所下降,二者過表達可能會增加轉移性CRC化療無效風險。分析其原因可能為,腫瘤細胞是典型的高活性細胞,ULBP2在多種惡性腫瘤中表達升高,可通過誘導細胞凋亡并發揮抗腫瘤免疫機制參與結直腸癌發生及發展,與患者預后具有密切聯系[19]。腫瘤細胞的復制及轉移與TKI密切相關,而患者死亡的主要原因是腫瘤復發及轉移,故血清TKI高表達可在一定程度上反映患者化療效果及預后情況[20]。本研究最后繪制ROC曲線發現,血清TK1、ULBP2單獨及聯合預測轉移性CRC患者化療效果具有一定價值,且當二者的cut-off值分別取79.90 ng/l、5.145 pmol/l時,可獲得最佳預測價值,提示血清TK1、ULBP2用于預測轉移性CRC患者化療效果具有潛在價值。但本研究仍存局限,如未對血清TK1、ULBP2之間的相關性進行分析,關于二者是否會相互影響,共同參與轉移性CRC病情發展并干擾化療效果還需臨床進一步證實。
綜上所述,血清TK1、ULBP2過表達可能提示轉移性CRC患者化療無效風險,二者對預測CRC患者化療效果有一定價值,早期監測各指標水平,對早期預測、評估轉移性CRC患者化療效果,并指導化療方案調整及合理制定具有重要意義。

