超聲造影、血清AFP、CEA水平對肝癌介入術后微血管侵犯、早期復發的預測價值
李 冉 范會軍 徐 杰 張 凱 梁長華
原發性肝癌中約有90%為肝細胞癌,臨床以手術治療為主,但患者術后仍有非常高的復發率,預后情況不佳[1-3]。微血管侵犯(microvascular invasion,MVI)、早期復發是影響肝癌患者預后不良的危險因素之一,而肝癌MVI情況需要經術后病理檢查確定,存在滯后性[4-5]。因此,術前準確預測肝癌MVI和早期復發對肝癌患者治療方式的選擇以及預后評估都具有重要的意義。超聲造影(contrast-enhanced ultrasonography,CEUS)是臨床常用的影像學檢查,可以反映肝臟血供情況;甲胎蛋白(alpha-fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)是肝癌的篩查指標之一[6-8]。本研究比較了CEUS、血清AFP、CEA水平對肝癌介入術后MVI、早期復發的預測價值,報告如下。
1 資料與方法
1.1 一般資料
選擇2018年11月至2019年5月醫院收治的102例肝癌患者作為研究對象,其中男性58例,女性44例,年齡46~78歲,平均(63.21±6.13)歲,均為原發性肝細胞癌,腫瘤直徑0.49~14.28 cm,平均(5.16±1.22)cm,手術類型:射頻消融術68例、碘油介入治療34例。
1.2 納入、排除標準
納入標準:①所有患者均具有完整實驗室檢查、CEUS及隨訪資料;②經術后病理活檢確診為肝細胞癌患者;③均為首次進行肝癌介入治療,術前未接受放療、化療等抗腫瘤治療。排除標準:①造影劑過敏;②合并造血功能不全、心肝腎功能不全;③合并嚴重的肺部疾病;④孕婦及哺乳期婦女;⑤合并其它惡性腫瘤。
1.3 檢驗方法
1.3.1 CEUS檢查 術前,對所有患者進行肝臟超聲檢查,多病灶患者選取最大病灶、其它患者取腫瘤最佳切面行CEUS檢查。利用Philips IU-Elite型超聲診斷儀,經腹C5-2扇形探頭,常規掃查條件設置為Pelvic gen,超聲造影劑:采用SonoVue (意大利Bracco公司),59 mg凍干粉劑;超聲造影檢查:采用Contrast/General模式,機械指數(MI)設定為0.06~0.07 l。經肘靜脈注入Sonovue 1.0~1.5 ml后同時計時。
1.3.2 CEUS分析 選擇本科室5年以上操作經驗的主治醫師2名,在不知任何臨床信息下獨立完成,兩者意見不一致時,以討論達到一致后的結果為準。超聲造影時期分為動脈、門脈和延遲期,參考病灶周圍正常肝實質增強水平,與造影劑進入后的增強水平進行對比,將低于、等于及高于肝實質增強水平定義為無增強和增強。記錄CEUS檢查中的征象:腫瘤數目、腫瘤邊緣、包膜類型、邊緣、內部壞死情況,以及動脈期是否增強、門脈期是否快速消退。
1.3.3 血清AFP、CEA檢查 取入組患者術前空腹靜脈血5 ml,離心機分離血清,利用化學發光免疫分析儀及試劑盒檢驗AFP水平;利用酶聯免疫法測定血清CEA水平,試劑盒由武漢優爾生生物工程有限公司。
1.4 微血管侵犯判定標準[9]
術后病理檢查中,在顯微鏡下于內皮細胞襯覆血管腔內可見癌細胞巢團,在癌旁肝門組織內靜脈小分支及腫瘤包膜內血管觀察MVI數量和分布情況,將入組患者根據MVI情況,分為MVI組和Non-MVI組。
1.5 隨訪方式
入組患者在介入治療結束后對其進行1年的隨訪,每個月通過電話、門診的方式進行,隨訪率100%。隨訪資料包括基礎體格檢查,疑似復發患者行病理檢查,治療結束后每3個月的胸、腹CT檢查資料,隨訪截止時間2020-6-10。早期復發判定標準:影像學檢查結合穿刺活檢結果、或再次手術后病理檢查。
1.6 統計學處理
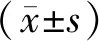
2 結果
2.1 影響肝癌介入術后MVI的單因素分析
本研究納入102例肝癌患者,經術后病理分析,證實為MVI的有66例,非MVI的有36例。單因素分析顯示,MVI組患者中多發腫瘤、無或不完整包膜、腫瘤邊緣不光滑、門脈期快速消退的發生率均高于Non-MVI組;MVI組患者血清AFP、CEA均高于Non-MVI組患者,差異有統計學意義(P<0.05)。2組性別、Child-Pugh分級、動脈期高增強、腫瘤內部壞死的發生率比較,差異無統計學意義(P>0.05),見表1。
2.2 影響肝癌介入術后MVI的多因素Logisitic回歸分析
以是否存在BPPV作為因變量,以上述有統計學意義項(腫瘤數目、包膜類型、腫瘤邊緣、門脈期快速消退、AFP、CEA)作為自變量,其中AFP、CEA為多分類變量,以正常AFP(<20 μg/l)、CEA(<4.6 μg/l)作為參照變量,對上述因素進行賦值,腫瘤數目(單發=0,多發=1)、包膜類型(有=0,無或不完整=1)、腫瘤邊緣(光滑=0,不光滑=1)、門脈期快速消退(無=0,有=1)、AFP(正常=0,異常=1)、CEA(正常=0,異常=1),并將其納入Logisitic回歸模型中,發現多發腫瘤、包膜無或不完整是影響肝癌介入術后出現MVI的獨立危險因素,見表2。

表1 影響肝癌介入術后MVI的單因素分析(例,%)

表2 影響肝癌介入術后MVI的多因素Logisitic回歸分析
2.3 影響肝癌介入術后早期復發的單因素分析
本研究納入102例肝癌患者,經術后1年的隨訪,證實為早期復發有21例,其中19例為肝內復發、2例為肝外轉移。單因素分析顯示,復發組患者中多發腫瘤、無或不完整包膜、門脈期快速消退、腫瘤內部壞死、MVI的發生率均高于未復發組;復發組患者血清AFP、CEA均高于未復發組患者,差異有統計學意義(P<0.05)。2組性別、Child-Pugh分級、動脈期高增強、腫瘤邊緣的發生率比較,差異無統計學意義(P>0.05),見表3。
2.4 影響肝癌介入術后早期復發的多因素Logisitic回歸分析
以是否存在BPPV作為因變量,以上述有統計學意義項(腫瘤數目、包膜類型、MVI、門脈期快速消退、腫瘤內部壞死、AFP、CEA)作為自變量,其中AFP、CEA為多分類變量,以正常AFP(<20 μg/l)、CEA(<4.6 μg/l)作為參照變量,對上述因素進行賦值,腫瘤數目(單發=0,多發=1)、包膜類型(有=0,無或不完整=1)、MVI(無=0,有=1)、腫瘤內部壞死(無=0,有=1)、門脈期快速消退(無=0,有=1)、AFP(正常=0,異常=1)、CEA(正常=0,異常=1),并將其納入Logisitic回歸模型中,發現存在MVI、包膜無或不完整是影響肝癌介入術后出現早期復發的獨立危險因素,見表4。

表3 影響肝癌介入術后早期復發的單因素分析(例,%)

表4 影響肝癌介入術后早期復發的多因素Logisitic回歸分析
3 討論
據統計,我國每年約有11萬人死于肝細胞癌,全球新發肝癌患者中約有55%在我國,盡管臨床上針對肝癌的新型化療藥物和手術方式不斷更新,但患者預后生存情況仍不樂觀[10]。
肝臟的獨特之處在于門靜脈、肝靜脈雙重血供,具有強侵襲性的肝癌容易侵犯血供系統,通過血流作用形成肝內復發和肝外轉移,影響手術和藥物的治療效果。杜紫雷等[11]的研究指出,血管侵犯是肝癌復發、轉移最主要的途徑之一,MVI是其中的一種血管侵犯方式,僅能通過顯微鏡檢查發現,是腫瘤早期轉移的標志之一。因此,術前準確預測肝癌MVI和早期復發對肝癌患者治療方式的選擇以及預后評估具有重要的意義。
既往研究指出,肝癌病灶供血來自肝動脈,CEUS在動脈期表現出增強,門脈期至延遲期表現為低增強回聲,在實際應用中,患者的病灶發展、病情進展各異,可以結合腫瘤數量、邊緣、包膜類型、內部壞死情況,以及動脈期和門脈期增強情況共同判斷[12-13]。趙盛發等[14]對73例肝癌患者的CEUS表現進行分析,發現CEUS檢查中腫瘤分化程度、門脈期和延遲期增強模式與MVI的發生有密切聯系,對肝癌患者MVI的預測有一定實用價值。本研究中,以術后病理學結果作為分組標準,腫瘤包膜情況、腫瘤數目是影響肝癌出現MVI的危險因素,而腫瘤邊緣不光滑、門脈期快速消退與MVI的發生有關,但并不是出現MVI的獨立危險因素。以上結果提示,CEUS對于判斷肝癌MVI有一定參考價值,在實際應用中需結合CEUS中多個征象共同判斷。孔德帥等[15]的研究指出,合并MVI、腫瘤直徑>5 cm、腫瘤包膜不完整是影響肝癌手術患者預后的獨立危險因素。本研究中對102例接受介入術治療的肝癌患者隨訪1年,以肝癌復發作為分組標準,發現存在MVI、包膜無或不完整是影響肝癌介入術后出現早期復發獨立危險因素,我們推測可能是因為肝癌細胞包膜不完整時,癌灶侵襲性更高,發生MVI和復發的可能性亦隨之升高。
值得注意的是,本研究發現患者血清AFP、CEA與肝癌MVI和介入術后早期轉移有關,但并不能作為預測二者的獨立危險因素。與既往研究[16]的結論不一致,推測可能是因為樣本容量不同、AFP和CEA的分組閾值不同、多因素分析納入的指標不同。AFP、CEA等指標對肝癌患者診斷、預后的預測作用中有一定爭議,美國肝病研究協會給出的肝細胞癌診治指南[17]不推薦患者行AFP檢查,但也有研究[18]認為AFP仍然是判斷肝癌患者預后的重要指標之一,所以有待今后進行針對性研究。
綜上所述,多發腫瘤、不完整包膜是肝癌MVI的獨立危險因素;不完整包膜、合并MVI是影響肝癌介入術后早期復發的危險因素。CEUS檢查對于預測肝癌介入術后MVI、早期復發有重要價值,而血清AFP、CEA對MVI早期復發的預測價值有待進一步探討。

