2型糖尿病女性低骨量與周圍神經病變的相關性
周玲玲 李華*
既往有研究證實神經病變與低骨量之間存在相關性,KORNAK 等[1]曾報道過一例ATL3 酶(Atlastin GTPase3)上高度保守的氨基酸殘基上的錯義突變后致使遺傳性感覺自主神經病變及下肢骨骨質破壞的病例。另外,骨軟骨瘤作為一種骨腫瘤性疾病可以合并有腓神經病變[2]。各階段骨細胞、骨痂和骨骼肌的軟骨細胞、周圍毛細血管內皮細胞存在神經生長因子的高度著色提示這些介質參與骨折的愈合過程[3]。降鈣素基因相關肽(CGRP)免疫反應陽性的神經纖維在骨組織的廣泛分布,以及其在骨折后骨痂的形成和隨后的骨重塑骨過程中的迅速增殖也提示周圍神經在骨組織修復重建過程中扮演重要角色[4]。不過,也有學者在進行薈萃分析后并未發現糖尿病神經病變的發生與骨骼病變之間存在相關性[5]。因此,其中的關系并未得到明確的證實。在本研究中,肌電圖將作為判斷2 型糖尿病周圍神經病變與否及程度的客觀檢查,同時采集研究對象骨密度(BMD)檢查結果進行比較,進一步探討低骨量與周圍神經病變之間的相關性。
1 資料與方法
1.1 一般資料 納入同濟大學附屬第十人民醫院內分泌科2014 年1 月至2015 年12 月在病房住院患者586例。納入標準:根據美國糖尿病學會(ADA)2 型糖尿病診斷標準診斷明確的絕經后女性及>50 周歲男性的2 型糖尿病患者。排除標準:(1)嚴重的感染,住院期間伴發酮癥、高滲高糖等急性并發癥者;(2)嚴重心、肝、腎等重要臟器疾病者;(3)目前合并有甲狀(旁)腺功能異常、骨腫瘤、骨關節炎等影響骨代謝的疾病,或有頸腰椎病變、腦梗死、神經毒性藥物應用史等明確病因的神經病變者;(4)近3 個月存在影響骨代謝藥物使用史的病例者。
1.2 方法 (1)生化指標檢測:所有觀察對象晨起采集空腹血,包括血清丙氨酸氨基轉移酶(ALT)、血肌酐(Cr)、總膽固醇(TC)、甘油三酯(TG),血糖、血漿C 肽、糖化血紅蛋白(HbA1c%),血鈣、磷水平,血清骨鈣素、I 型膠原羧基端肽(β-CTX)、骨堿性磷酸酶(BAP)和25 羥維生素D。(2)肌電圖:鑒于2 型糖尿病周圍神經病變癥狀及查體體征相對主觀差異較大,此研究中對所有觀察對象進行神經電生理檢查,并以此作為糖尿病周圍神經病變(DPN)的診斷依據。檢查在相對安靜環境中由同一位醫師進行,使用紅外線燈使受試者皮膚溫度保持≥31℃,采用神經電生理檢查儀(Skovlude,丹麥)評估受試者正中神經、尺神經、脛神經、腓總和腓淺神經的神經傳導速度及振幅。根據受試者肌電圖結果分別按各自性別分為2 型糖尿病不伴有周圍神經病變組(DM 組)及2 型糖尿病合并有周圍神經病變組(DM&DPN 組)。(3)雙能X 線吸收法:采用Hologic QDR 4500 W 骨密度儀分別對被檢測者的腰椎(L1-L4),髖部和股骨頸部的BMD 進行檢測,記錄BMD(g/cm2)和T 分數或Z 分數。基于世界衛生組織骨質疏松診斷標準,即T 分數≤-2.5SD,對研究對象做出診斷。
1.3 統計學方法 采用SPSS 20.0 統計軟件。符合正態分布的計量資料以(±s)表示,非正態分布計量資料以中位數(四分位距)表示。P<0.05 為差異具有統計學意義。連續正態分布數據、非正態數據、分類變量的組間比較分別采用ANOVA 檢驗、Kruskal-Wallis 檢驗及χ2檢驗。多因素分析用于分析腰椎、髖部和股骨頸的BMD 與變量之間的關系。
2 結果
2.1 有神經病變組和無神經病變組的臨床資料比較 見表1。
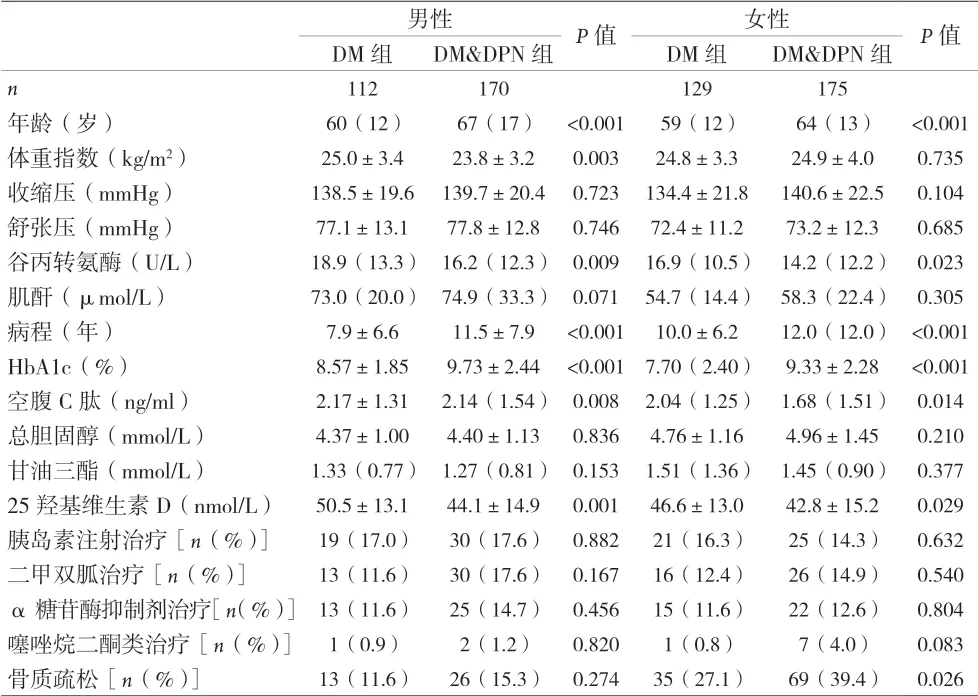
表1 各性別有神經病變組和無神經病變組的臨床資料比較
2.2 有神經病變組和無神經病變組的BMD 與骨代謝指標比較 女性兩組間的骨質疏松患病率具有顯著差異,DM&DPN 組人群骨質疏松患病率高于單純DM 組(39.4% vs 27.1%,P=0.026),其中DEXA 顯示髖骨、股骨頸處的BMD 具有顯著差異(髖骨:DM 組:0.816±0.132,DM&DPN 組:0.786±0.138,P=0.037;股骨頸:DM 組:0.697±0.131,DM&DPN 組:0.664±0.131,P=0.013),腰椎處BMD 未見明顯差異(見圖1B)。男性兩組間的髖骨及股骨頸處BMD 值存在差異(髖骨:DM 組:0.935±0.118,DM&DPN 組:0.899±0.151,P=0.043;股骨頸:DM 組:0.801±0.124,DM&DPN 組:0.766±0.154,P=0.042)(見圖1A),但是男性人群兩組間的骨質疏松的患病率并未發現明顯差異。另外,骨轉換指標亦在女性研究對象的兩組間差異具有統計學意義,見表2。
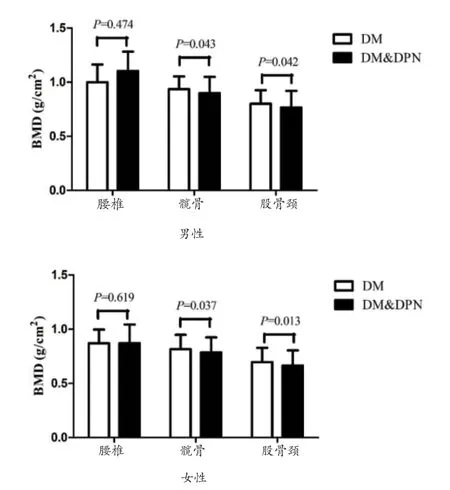
圖1 各性別有神經病變組和無神經病變組的BMD比較
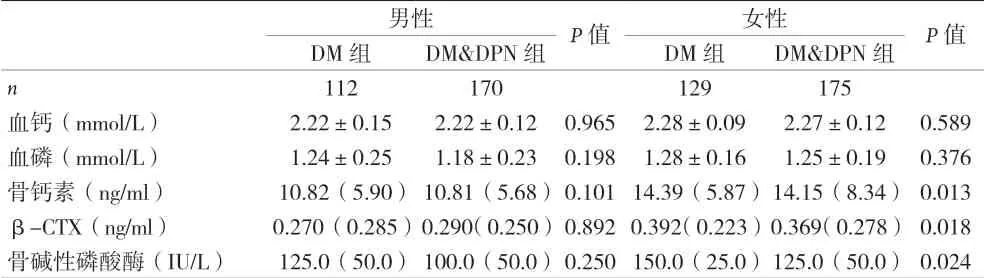
表2 各性別有神經病變組和無神經病變組的骨代謝指標比較
2.3 BMD 與變量之間的多因素分析 與BMD 密切相關的因素納入多因素分析。男性患者中,腰椎部位BMD與年齡呈負相關(r=-0.205,P=0.018),而BMI(r=0.311,P=0.001)呈正相關,髖部BMD 與BMI(r=0.183,P=0.049)呈正相關,尚未發現納入因素與股骨頸部位BMD 之間的相關性。女性患者中,無論是腰椎部位或是股骨頸部位,BMD 與年齡呈負相關(腰椎:r=-0.228,P=0.021;股骨頸r=-0.249,P=0.008),與BMI(腰椎:r=0.239,P=0.007;股骨頸:r=0.267,P=0.002)呈正相關,唯獨在髖部,僅發現BMI 與BMD 呈正相關(r=0.291,P=0.001)。女性患者的DPN 合并與否同髖部及股骨頸部位的BMD 密切相關(髖部:r=-0.257,P=0.004;股骨頸:r=-0.239,P=0.007)。
3 討論
本研究發現女性2 型糖尿病患者的周圍神經病病變與低骨量相關,尤其是髖骨及股骨頸部位,骨代謝指標亦證實此部分人群存在低骨代謝水平。既往有研究觀察到2 型糖尿病患者骨質疏松性風險增加及需要經歷較長的愈合過程[6],并且發現下肢骨骨量的降低與周圍神經損傷相關[7]。
長期慢性的高糖狀態會影響全身多器官系統,包括骨骼。血糖控制不佳、漫長病程的患者典型的骨骼并發癥包括糖尿病足及夏科氏神經關節病變,會增加患者的醫療、經濟負擔,嚴重影響日常生活質量。夏科氏關節病是一類因深、淺感覺障礙等神經病變相關導致的骨質破壞及關節畸形,可以作為糖尿病神經病變與骨質破壞的研究模型,BARBARO 等[8]研究發現合并有神經性潰瘍一側下肢BMD 較對側下肢、無神經病變的糖尿病患者或健康人群下肢BMD 明顯降低,也有動物實驗發現,2 型糖尿病和周圍神經病變的GK 大鼠呈現出局部區域性骨病變[9]。RANKL 作為TNF 超家族的一種細胞因子,通過與配體RANK 結合促進下游NF-kβ 信號傳導調節破骨細胞生成、成熟和分化,OPG 作為一種誘餌受體,能夠阻止RANKL 與RANK 之間的相互作用,從而充當RANKL 的拮抗劑[10]。有學者認為RANKL/OPG 信號轉導通路及炎癥介質在夏科氏骨關節病變的發生發展中具有重要地位[11]。
然而這種局部的骨骼改變難以完全通過PTH、降鈣素、維生素D 等調節全身鈣磷代謝激素的變化闡明。神經纖維廣泛分布于骨膜、骨皮質及骨小梁,甚至骨髓組織中,因此骨重塑過程或許有來自周圍神經的參與。有研究通過體外共同培養小鼠成骨細胞及頸上神經節的神經突細胞發現神經細胞及成骨細胞之間的相互作用,證實周圍神經對局部骨代謝的調控[12]。許多學者也曾研究探討神經遞質及其受體在成骨細胞、破骨細胞的分布及其在骨吸收形成平衡中的作用及機制[13]。神經肽Y 及CGRP 對骨骼具有促進合成作用,AHMAD等[14]通過放免法對局部神經肽進行定量測量后發現,實驗鼠的脊髓和背根神經節處的CGRP,骨關節尤其是骨皮質及骨髓處的NPY 明顯低于對照鼠組,并且認為NPY 能夠通過中樞、外周機制影響骨轉化。另外也有動物實驗發現,長期慢性高血糖狀態誘導了骨髓間充質干細胞源性胰島素分泌樣細胞(PI-BMDCs)的形成,并進一步與背根神經節神經元的結合,導致神經功能障礙及促使過早凋亡,致使糖尿病性神經病變事件的發生,并且推論血糖之于骨組織無異于甜蜜的負擔[15]。
本研究同樣具有局限性。其一,作為橫斷面研究,雖然結果提示合并有DPN 絕經后女性存在明顯的低骨量,但神經病變與BMD 之間的因果關系及潛在機制仍有待闡明。其二,單一的肌電圖結果用于全面系統的評估神經病變仍有待商榷,在之后的研究中期待更加直接的評估方法。
總之,研究結果表明絕經后2 型糖尿病女性的BMD 與神經病變之間呈負相關,但仍需更多的前瞻性研究來證實。

