右美托咪定對體外循環后圍術期神經認知障礙老齡大鼠海馬HPA軸和BDNF-ERK-CREB信號通路的影響
綦欣竹,毛安瓊,李正芬,袁雪梅,劉 慶,張 英
0 引言
1 材料與方法
1.1 動物選擇 實驗動物的應用及實驗程序得到西南醫科大學實驗動物中心實驗動物應用管理委員會同意。選擇老齡健康雄性SD大鼠[生產許可證編碼:SCXK(川)2013-17]120只,18~20月齡,體重400~550 g,采用隨機數字表法分為4組(n=30):對照組(C組)、體外循環組(T組)、體外循環+右美托咪定組(D組)、體外循環+生理鹽水組(NS組)。C組大鼠不做任何處理,T組大鼠僅建立體外循環模型,D組大鼠腹腔注射50 μg/kg右美托咪定后同T組,NS組大鼠腹腔注射等劑量的生理鹽水后同T組。
1.2 建立體外循環動物模型 采用50 mg/kg戊巴比妥腹腔注射麻醉大鼠,待翻正反射消失后,行氣管插管,調節呼吸機參數,監測大鼠生命體征。分離腹壁內前動脈、尾動脈和右頸內靜脈,以腹壁內前動脈監測動脈血壓,以尾動脈和右頸靜脈建立CPB。CPB主要由蓄血器、滾泵和實驗動物膜肺靜脈組成。預充液為4 ml,由乳酸林格氏液、6%羥乙基淀粉、甘露醇、碳酸氫鈉按11∶7∶1∶1的比例組成。當激活凝血時間(ACT)>480 s時,CPB開始。開始灌注流量為20~40 ml/(kg·min),逐漸增加至160~180 ml/(kg·min)。平均血流保持在100~120 ml/(kg·min),平均動脈壓維持在60/100 mmHg。經過90 min的流動,停止CPB,剩余的機器預充血或膠體流體被返回。然后注射1 mg魚精蛋白,拔除導管,縫合血管和切口。手術后,使用電熱墊和溫控燈使大鼠體溫維持在37 ℃。
1.3 行為學測定 老齡大鼠于體外循環后3 d、5 d、7 d,進行行為學測定。
1.3.1 Morris水迷宮實驗 參考文獻[9]進行水迷宮實驗。Morris水迷宮測試采用直徑為160 cm、高度為50 cm的水池。水深31 cm,溫度保持在23 ℃。水池被分成4個大小相等的象限,每個象限的墻壁上都有一個獨特的彩色圖案作為參考。在目標象限中心放置直徑為9 cm、高度為30 cm的圓形平臺,淹沒在水面以下1 cm處。大鼠在導航試驗前1天被放入水池中,游2 min以適應迷宮。在每一次試驗中,大鼠都被引入一個迷宮,在4個指定的起點之一面對墻壁。迷宮上方放置了一臺連接電腦的攝像頭,記錄游泳軌跡、總游泳距離和尋找平臺的時間。如果大鼠在120 s內沒有找到平臺,則記錄潛伏期為120 s。實驗結束后,這些大鼠被放置在平臺上15 s,以便學習和記憶。每只老鼠每天接受4次測試,每一次的起點都不同,試驗之間有30 min的休息時間。實驗持續5 d,記錄平均潛伏期和總距離,使用上海吉亮動物行為分析系統進行分析。在最后一次位置導航測試24 h后,平臺被移除,老鼠被允許自由游泳120 s,每只動物游1次。在120 s的時間框架內記錄逃避潛伏期和穿越原平臺次數。使用ANY-maze系統5.26 (Stoelting Co.,Wood Dale,IL,USA)對計算機上運行的行為指標進行實時自動記錄時間和運動路線數據的分析。
1.3.2 穿梭箱實驗 參考文獻[10]進行穿梭箱實驗。箱體由兩個相等的隔間(50 cm×25 cm×25 cm)組成,中間有一個黑色的有機玻璃隔板,隔板底部有一個正方形的開口(9 cm×9 cm),可以在隔間之間自由移動。兩個隔間都配備了位于上側壁的光源(15 W)和網格地板,網格地板由19根不銹鋼棒串聯到主控制模塊(Letica LI-2900,西班牙),能夠在每個隔間中獨立地提供連續的、緊急的電擊。大鼠在連續15 d的10次試驗中進行測試。每只大鼠置于同一個隔間里,在實驗開始前有5 min的探索時間。每個試驗包括1個10 s的警告信號和一個燈泡(條件刺激,CS),接著是1個3 s 0.3~0.5 mA的電擊(非條件刺激,UCS)和25個50 s的試驗間隔。在CS期間,大鼠移動到盒子的另一邊即認為是做出了回避反應。那些在3 s UCS期逃脫電擊的大鼠視為有逃脫反應。對主動回避反應次數、主動及被動回避反應潛伏期進行分析。
1.3.3 曠場實驗 參考文獻[11]進行曠場實驗。使用高為45 cm、底為40~40 cm的黑色盒子,盒子中心上方有1個4 W的冷光源。動物活動記錄使用上海吉亮動物行為分析系統(上海,中國)。慢病毒注射后1周進行行為測試。將大鼠置于野外中央,利用紅外攝像系統和視頻合成器記錄其在光照條件下的活動。利用計算機分析系統分析運動軌跡。分析的行為變化包括總爬行距離、尾數和活動。每次實驗后,用75%的酒精溶液清洗盒子內部,去除老鼠身上的氣味,以免影響下一只大鼠的行為。每只大鼠實驗結束后均將其糞便及尿液清理干凈,并用75%酒精擦拭場地3次。
1.4 采用酶聯免疫吸附測定法(ELISA)測定大鼠血漿中促腎上腺皮質激素釋放激素(CRH)、促腎上腺皮質激素(ACTH)和皮質醇(CORT)濃度 各組大鼠行為學測試結束后,隨機選取5只大鼠,抽取心臟血2 ml,置于肝素管內,6 ℃條件下3 000 r/min離心15 min后取血漿,分裝置于-80 ℃保存待測。在室溫下,將樣品和稀釋液加入孔中,生物素抗體加入孔中,洗滌后加入HRP和生物素顯色液,最后加入終止液。在450 nm波長下測定各孔的吸光度(OD)。
1.5 采用蛋白印跡法(Western blot)檢測大鼠海馬BDNF、ERK及CREB蛋白的表達 各組大鼠行為學測試結束后,隨機選取5只大鼠,采取靜脈血后,取海馬。隨后,用10% SDS-PAGE分離蛋白。使用PageRuler Plus預染色蛋白梯子(Thermo Fisher Scientific,Inc.)作為蛋白標記加載,并估計樣品的分子量。蛋白被轉移到聚偏氟乙烯(PVDF)膜上。室溫下5%脫脂乳封閉2 h后,將PVDF膜與以下一抗孵育,兔BDNF多克隆抗體(稀釋度1∶1 000,Biorbyt公司,英國)、兔ERK多克隆抗體(稀釋度1∶800,Santa Cruz公司,美國)、兔CREB多克隆抗體(稀釋度1∶1 000,Biorbyt公司,英國)、β-actin(稀釋度1∶2 000,Santa Cruz公司,美國),在4 ℃過夜。然后將膜與適當的辣根過氧化物酶(HRP)標記的山羊孵育,加入辣根過氧化酶標記的二抗(1∶6 000,北京中杉金橋科技公司)室溫搖床孵育1 h,膜與化學發光底物孵育后顯影照相,在室溫下1 h。最后,用化學發光法觀察條帶。每個實驗重復6次。用Quantity one 圖像分析軟件(美國Bio Rad公司)測定BDNF、ERK及CREB蛋白的表達。
1.6 采用免疫組化SP法檢測海馬BDNF、ERK及CREB的陽性神經元計數 各組大鼠行為學測試結束后,隨機選取5只大鼠,取大鼠海馬組織。參照說明書步驟進行操作:在海馬區隨機選擇8個視野,用顯微鏡圖像分析系統下的目鏡,400倍顯微計數,計算海馬BDNF、ERK及CREB的陽性細胞的平均數。
北京城什剎海前海南頭,煤灰土新墊就一片場坪,白日照著,有一圈沒事可做的閑人,皆為一件小小熱鬧粘合在那里。
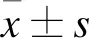
2 結果
2.1 Morris水迷宮測試逃避潛伏期和穿越原平臺次數 與C組比較,T組、D組、NS組大鼠術后各時點逃避潛伏期延長,穿越原平臺次數減少(P<0.05);與T組、NS組相比較,D組大鼠術后各時點逃避潛伏期縮短,穿越原平臺次數增加(P<0.05);與術前比較,T組、D組、NS組大鼠術后各時點逃避潛伏期延長,穿越原平臺次數減少(P<0.05);T組與NS組術后各時點逃避潛伏期和穿越原平臺次數比較差異無統計學意義(P>0.05),見表1。

表1 四組大鼠術后各時點逃避潛伏期和穿越原平臺次數的比較
2.2 穿梭箱實驗測試主動回避反應次數及主動及被動回避反應潛伏期 與C組比較,T組、D組,NS組大鼠術后各時點主動回避反應次數減少,主動及被動回避反應潛伏期延長(P<0.05);與T組、NS組相比較,D組大鼠術后各時點主動回避反應次數增加,主動及被動回避反應潛伏期縮短(P<0.05);與術前比較,T組、D組、NS組大鼠術后各時點主動回避反應次數減少,主動及被動回避反應潛伏期延長(P<0.05);T組與NS組,術后各時點主動回避反應次數及主動、被動回避反應潛伏期差異無統計學意義(P>0.05),見表2。

表2 四組大鼠術后各時點主動回避反應次數及主動、被動回避反應潛伏期比較
2.3 曠場實驗測試直立次數和中央格停留時間 與C組比較,T組、D組、NS組大鼠術后各時點直立次數減少,中央格停留時間延長(P<0.05);與T組、NS組相比較,D組大鼠術后各時點直立次數增多,中央格停留時間縮短,差異均有統計學意義(P<0.05);與術前比較,T組、D組、NS組大鼠術后各時點直立次數減少,中央格停留時間延長(P<0.05);T組與NS組術后各時點直立次數和中央格停留時間差異無統計學意義(P>0.05),見表3。

表3 四組大鼠術后各時點直立次數和中央格停留時間比較
2.4 采用酶聯免疫吸附測定法(ELISA)測定大鼠血漿中CRH、ACTH和CORT濃度 與C組比較,T組、D組、NS組大鼠術后各時點血漿中CRH、ACTH和CORT濃度升高(P<0.05);與T組、NS組相比較,D組大鼠術后各時點血漿中CRH、ACTH和CORT濃度降低(P<0.05);T組與NS組術后各時點血漿中CRH、ACTH和CORT濃度差異無統計學意義(P>0.05),見表4。

表4 四組大鼠術后各時點血漿中CRH、ACTH和CORT濃度的比較(n=5)
2.5 Western-blot檢測大鼠海馬BDNF、ERK及CREB蛋白的表達 與C組比較,T組、D組、NS組大鼠術后各時點海馬BDNF、ERK及CREB蛋白的表達降低(P<0.05);與T組、NS組相比較,D組大鼠術后各時點海馬BDNF、ERK及CREB蛋白的表達升高(P<0.05);T組與NS組術后各時點海馬BDNF、ERK及CREB蛋白的表達差異無統計學意義(P>0.05)。見表5。

表5 四組大鼠術后各時點海馬BDNF、ERK及CREB蛋白的比較(n=5)
2.6 采用免疫組化法檢測海馬BDNF、ERK及CREB蛋白的陽性神經元計數 與C組比較,T組、D組、NS組大鼠術后各時點海馬BDNF、ERK及CREB蛋白的陽性神經元計數降低(P<0.05);與T組、NS組相比較,D組大鼠術后各時點海馬BDNF、ERK及CREB蛋白的陽性神經元計數升高(P<0.05);T組與NS組術后各時點海馬BDNF、ERK及CREB蛋白的陽性神經元計數比較差異無統計學意義(P>0.05)。見表6、圖1。

表6 四組大鼠術后各時點海馬BDNF、ERK及CREB蛋白陽性神經元計數結果的比較(個)
3 討論
譫妄和術后認知功能障礙現統稱為PND,已成為常規外科手術后最常見的并發癥,尤其是老年人,預后較差,對于預先存在神經退行性變患者的PND的1年死亡率較高。目前,還沒有行之有效的PND治療方案。本研究參照文獻[12]選擇18~20月齡大鼠作為研究對象,模擬臨床老年患者病理生理狀態。本研究發現,大鼠體外循環術后3 d、5 d、7 d逃避潛伏期延長,穿越原平臺次數減少,主動回避反應次數減少,主動及被動回避反應潛伏期延長,直立次數減少,中央格停留時間延長,表明大鼠體外循環術后出現圍術期神經認知功能障礙,模型制備成功。

圖1 大鼠海馬BDNF、ERK及CREB蛋白免疫組化照片(400×)
大量的臨床資料證實HPA軸基因與應激狀態之間有聯系。HPA軸激活后可使CRH的合成與釋放。下丘腦區還分泌另一種應激激素-抗利尿激素,其與CRH協同作用,刺激ACTH分泌。PVN依賴其他下丘腦核(如弓狀核、背內側下丘腦核、視前區)和其他腦核(如杏仁核等)的輸入,與CRH分泌的正性刺激整合在一起。另一方面,海馬和前額葉皮層抑制PVN的活性,進而抑制HPA軸的活性[13]。HPA軸還可與其他應激相關的神經肽、胺和氨基酸系統相互作用,但人類HPA軸,尤其是CRH可能會被遺傳或環境因素永久激活,使人容易受到環境壓力的影響,從而在不同程度上進一步激活HPA軸。激活的HPA軸可能通過CRH的中心投射和/或皮質類固醇循環水平的增強來影響情緒,而HPA軸不同水平上的SNP可能是大腦對皮質醇敏感性變化的基礎。有研究發現,HPA軸失調降低了第二信使環核苷酸(cGMP和cAMP)的水平,進而降低了CREB和BDNF的磷酸化表達,進一步加重了阿爾茨海默病患者記憶和學習障礙[14]。
BDNF在神經元的存活、生長和分化中起著重要的作用。BDNF水平的降低,尤其是在紋狀體中,被認為在神經系統疾病發病機制中起著至關重要的作用。在亨廷頓氏舞蹈癥患者死后腦組織中觀察到腦內BDNF水平的降低[15]。越來越多的證據表明,BDNF在人腦中的多態性和BDNF表達的減少與AD的發病機制密切相關。BDNF基因的多態性(C270T和Val66Met)可引起BDNF的高表達從而減緩了AD患者的認知能力下降。這表明大腦BDNF水平可以作為一種新的評估AD進展的標志物。因此,可以考慮通過直接補充BDNF或間接刺激BDNF表達來增加BDNF水平,作為AD改善認知功能潛在的疾病治療方法。此外,BDNF基因還可改善Aβ前體蛋白(APP)轉基因小鼠學習和記憶能力。ERK和CREB信號分子參與認知功能。ERK屬于絲裂原活化蛋白激酶家族成員,激活CREB,調節細胞過程,調節長期突觸可塑性,穩定新記憶[16]。CREB是ERK的重要轉錄因子,與許多與學習、記憶和突觸可塑性相關的神經元基因的啟動子區域結合[17],其磷酸化促進了細胞周期蛋白依賴性激酶和細胞周期蛋白基因的轉錄表達。有絲分裂需要ERK活性,但如果在G2/M期ERK活性過高,則會阻止有絲分裂進入并導致細胞死亡。
本研究發現,右美托咪定預處理老齡大鼠體外循環術后3 d、5 d、7 d,血漿中CRH、ACTH和CORT濃度降低,海馬BDNF、ERK及CREB蛋白的表達和陽性神經元計數升高,表明給予右美托咪定后,可以降低應激反應,上調海馬BDNF、ERK及CREB蛋白的表達,從而改善圍術期術后認知功能障礙。其機制可能是:體外循環應激刺激下,下丘腦室旁核處CRH表達上調,再以旁分泌或自分泌的方式作用CRH-R1,進一步促進自身分泌。同時刺激垂體前葉細胞ACTH釋放入血,ACTH又促進腎上腺皮質的組織增生以及CORT的生成和分泌[18]。高血漿皮質酮可引起海馬內BDNF下調,下調的BDNF蛋白可直接與TrkB結合抑制ERK蛋白表達,使得下游的轉錄因子CREB下調,導致認知功能障礙的發生[19]。有研究發現,右美托咪定由于激活延髓孤束核中突觸后α2受體,導致交感神經發放沖動現象降低,交感張力抑制,從而降低應激反應[20],因此,本研究結果表明,右美托咪定可通過降低體外循環大鼠應激反應抑制下丘腦室旁核處CRH分泌,使得垂體前葉細胞ACTH釋放入血減少以及CORT分泌減少,導致海馬BDNF、ERK及CREB蛋白表達上調,從而改善圍術期術后認知功能障礙,但右美托咪定是否通過其他信號通路改善圍術期術后認知功能障礙,有待進一步研究。
綜上所述,右美托咪定可改善體外循環后老齡大鼠圍術期神經認知障礙,其機制可能與抑制HPA軸,激活海馬BDNF-ERK-CREB信號轉導通路有關。

