肺表面活性物質分別聯合BiPAP、CPAP對新生兒呼吸窘迫綜合征肺功能的影響
韓淑貞
0 引言
新生兒呼吸窘迫綜合征(Neonatal respiratory distress syndrome,NRDS)易發于早產兒,是新生兒常見的呼吸危急重癥之一[1-2]。本病具有發病率高、致死率高、進展迅速、病情危重等特點,嚴重危害患兒生命健康與生長發育。近年來,持續氣道正壓通氣(CPAP)是臨床糾正呼吸困難的常用通氣模式,在救治早產兒NRDS方面因其療效顯著得到廣泛認可。雙水平氣道正壓通氣支持治療方法(BiPAP)屬新型無創通氣類型,與CPAP相比,其優勢在于能夠通過患兒自身呼吸頻率來調整機械呼吸頻率[3]。但單純使用機械通氣治療本病臨床效果不佳[4]。NRDS的發生主要由于肺表面活性物質(PS)的缺乏所致,應用外源性PS替代治療是目前治療NRDS的特效療法,PS與無創呼吸支持模式聯合使用可能提高其治療效果。本研究探討兩種方案的療效差異,以期為臨床選擇治療方案提供理論依據。
1 資料與方法
1.1 一般資料 收集我院2015年1月至2019年12月收治的NRDS患兒80例,男44例,女36例。根據隨機數字表隨機分為BP組、CP組,各40例。BP組男22例,女18例,胎齡29+6~36+6周,體重1 290~3 000 g;CP組男22例,女18例,胎齡29+5~36+4周,體重1 180~3 000 g,兩組患兒各項基本臨床資料比較差異無統計學意義(P>0.05),研究通過我院倫理委員會審查。
1.2 診斷標準及納入標準 ①診斷標準參照《歐洲早產兒呼吸窘迫綜合征治療共識指南》[5];②影像學檢查提示病情程度Ⅰ~Ⅲ級;③血流動力學穩定;④胎齡為29~42周;⑤現階段未采用過機械通氣;⑥治療告知患兒家屬治療內容,并簽署知情同意書。
1.3 排除標準 ①患先天性心肺畸形、先天性心臟病、染色體異常、重度貧血者;②多胎妊娠者;③免疫功能低下者;④孕婦伴有嚴重感染性疾病者;⑤出生時即已出現重度呼吸困難癥狀者;⑥患兒臨床資料收集不完善者。
1.4 治療方法 兩組患兒均予以肺表面活性物質進行治療,固爾蘇注射液(意大利凱西制藥公司;生產批號:H20140848),加熱至37 ℃待用。護士抽吸氣管內的分泌物后,囑患兒采取仰臥位,將固爾蘇注射液滴注氣管內,100 mg/(kg·次)。在球囊加壓給氧后拔出氣管插管,準備予以正壓通氣。注意事項:滴藥完成后予以1 min氣囊加壓呼吸,確保藥物充分到達雙肺;用藥時間不超過5 min,操作過程嚴格把控,確保無菌;用藥后8 h內不進行任何拍背、翻身及氣管內操作。
BP組采用BiPAP(瑞邁特G2SA20)方式進行通氣,采用雙鼻塞,參數設置:吸氣峰壓(PIP)8~10 cmH2O,呼氣末正壓(PEEP)范圍4~6 cmH2O(1 cmH2O=0.1 kPa),吸入氧濃度(FiO2)范圍0.21~0.40,呼吸頻率(RR)30次/min,上限壓力水平維持時間為0.5~0.7 s。PEEP設定為4 cmH2O,在4~6 cmH2O調節,FiO2波動于0.4~0.5。當PEEP>6 cmH2O或FiO2>0.6時,需行有創通氣。
CP組采用NCPAP(凱迪泰Inspiration 5i)方式進行通氣,采用雙鼻塞,參數設置:PIP為8~10 cmH2O,PEEP范圍4~6 cmH2O,FiO2范圍0.25~0.40。當參數PEEP≤4 cmH2O,FiO2=0.21時即氧合穩定,可改用頭罩吸氧。
1.5 觀察指標
1.5.1 兩組患兒治療前后血氣及吸入氧濃度指標變化 分別于治療前后檢測動脈血酸堿度(pH)、動脈二氧化碳分壓(PaCO2)、動脈血氧分壓(PaO2)及血氧飽和度SpO2等指標。
1.5.2 兩組患兒治療前后肺功能變化 檢測兩組患兒治療前后氧合指數(PaO2/FiO2)、肺動態順應性(CD)及吸氣阻力(RAW)等肺功能指標變化,記錄數據。
1.5.3 兩組患兒住院時間與呼吸支持情況 比較兩組患兒住院時間、無創通氣時間及呼吸暫停發生例次,評估患兒呼吸支持情況。呼吸暫停標準:呼吸停止時間>20 s,或呼吸停止時間<20 s,心率<100次/min,伴有或不伴有面部青紫。
1.6 療效標準 參照《歐洲早產兒呼吸窘迫綜合征治療共識指南》[5]診斷標準。顯效:治療3 d后進行性呼吸困難、發紺、呻吟等NRDS癥狀消失,呼吸平穩,四肢溫暖,面色紅潤,血氧濃度正常水平;有效:進行性呼吸困難、發紺、呻吟等NRDS癥狀有所改善,呼吸仍稍急促,狀態較治療前安靜,四肢較冰涼;無效:上述癥狀無改善甚或加重,或仍需機械輔助通氣。臨床療效總有效率=(顯效例數+有效例數)/總例數×100%。
2 結果
2.1 兩組患兒治療前后血氣及吸入氧濃度指標變化 治療后,兩組患兒pH、PaO2、SpO2均升高(P<0.05),且BP組高于CP組(P<0.05);兩組患兒PaCO2均降低(P<0.05),且BP組低于CP組(P<0.05)。見表1。
2.2 兩組患兒治療前后肺功能變化 治療后,兩組患兒PaO2/FiO2、CD均升高,且BP組高于CP組(P<0.05);兩組患兒RAW均降低,且BP組低于CP組(P<0.05)。見表2。
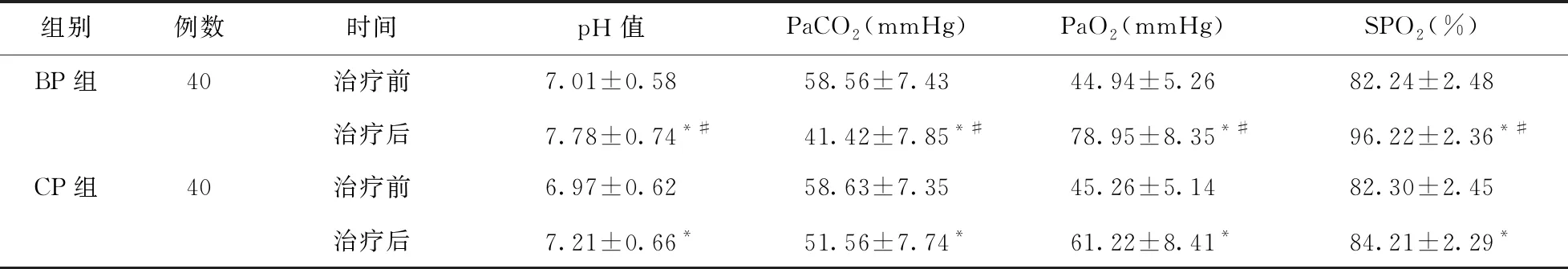
表1 兩組患兒治療前后血氣及吸入氧濃度指標比較

表2 兩組患兒治療前后肺功能指標比較
2.3 兩組患兒住院時間及呼吸支持比較 BP組住院時間、無創通氣時間較CP組縮短,3 d內呼吸暫停發生例次少于CP組,差異均有統計學意義(P<0.05)。見表3。
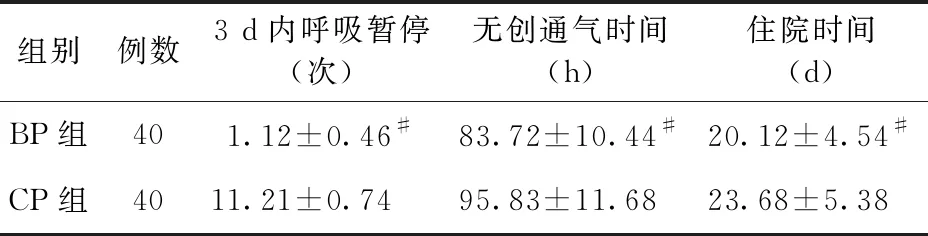
表3 兩組患兒住院時間及呼吸支持比較
2.4 臨床療效評價 BP組臨床總有效率為95%,CP組臨床總有效率為72.5%,BP組高于CP組。見表4。

表4 兩組患兒臨床總有效率比較(例)
3 討論
NRDS的主要致病機制為肺間質和肺泡內水腫、肺內靜-動脈分流、肺泡與小氣道萎縮,伴不同程度的氣體彌散能力障礙、血流灌注比例和氣體通換失調現象[6],而及時有效的機械通氣能夠改善患兒缺氧狀態,提高其生存率。隨著新型通氣設備的不斷改進,如CPAP的引進,使得經氣管插管、有創呼吸支持的治療方式在防治新生兒呼吸系統疾病的過程中應用率顯著減少,進而降低了呼吸機相關肺損傷、VAP、肺內出血等嚴重并發癥。但在呼吸暫停、肺不張中早期等相對嚴重肺部疾病的治療過程中,CPAP臨床療效欠佳,仍存在導致患兒病情加重、誘發并發癥等風險,需再次應用有創機械通氣維系呼吸支持,因此,尋求一種有效、有力的無創呼吸支持模式顯得尤為重要。
20世紀90年代初,美國偉康公司首次將BiPAP運用于無創正壓通氣中,其不僅具有無創機械通氣特點,還可根據患兒自身的呼吸周期調整正壓支持,以此維系肺泡擴張。BiPAP是由2種壓力共同構成的呼吸支持,氣道壓力調節范圍存在上限壓力及下限壓力,2種壓力時間與吸氣、呼氣時間對應,壓力大小和作用時間可以自調。有研究認為,BiPAP在治療NRDS方面與CPAP相比,具有能夠提前撤機、減少氧依賴、降低炎癥、更安全、更耐受等多重應用優勢。NRDS患兒多存在PS缺乏現象,無法滿足患兒自主呼吸的支持,使肺泡萎縮,肺順應性降低,出現呼吸困難,其他系統感染,甚至呼吸衰竭等急危重癥[7-10]。PS的主要成分為二棕櫚酰卵磷脂,該物質由Ⅱ型肺泡上皮細胞分泌,具有促進肺表面張力降低、防止肺泡萎縮、抑制肺部病變、提高順應性、維持肺內壓穩定等作用,進而改善肺部氣體交換功能,改善患兒呼吸困難、口唇發紺等臨床癥狀[11-19],應用外源性PS能夠擴大肺泡表面積,促進內源性PS釋放。研究結果顯示,覆于肺泡內磷脂及特異性蛋白質能夠有效降低其表面張力,穩定肺泡內氣體交換頻次。外源性PS治療使萎陷的肺泡逐漸充氣,進而改善氣體通換功能,升高PaO2分壓,降低PaCO2分壓,緩解機體缺氧狀態,糾正呼吸性酸中毒[20-21]。
本研究結果顯示,治療后,BP組PaO2及PaO2/FiO2CD均升高、PaCO2及RAW均降低,且變化程度均顯著優于CP組,提示BP方案在改善動脈血氣、氧交換能力及通氣功能優于CP組。本研究表明,BP組臨床總有效率高于CP組。治療后,BP組患兒機械通氣后,在改善呼吸支持、縮短住院時間方面顯著優于CP組。分析其原因,PS聯合 BiPAP 能夠更好地促進凹陷肺泡恢復、加速肺泡中氣體交換、改善患兒進行性呼吸困難癥狀[22]。BiPAP的部分功能與CPAP類似,擴張凹陷肺泡、提高肺順應性及肺功能殘氣量,糾正通氣/血流比例失調[23]。但因 BiPAP可以因時制宜地調整上限壓力,提高氣道平均壓,故BiPAP的呼吸支持效果較 CPAP提升氧合能力更強,促二氧化碳外排效果更佳[24]。BiPAP可顯著降低呼吸暫停、呼吸性酸中毒等因素所致的重新插管率,因此,在安全性能方面,BiPAP較CPAP具有顯著優勢。
綜上所述,肺表面活性物質聯合BiPAP較其聯合CPAP方案療效顯著,能夠縮短住院時間,提高血氣及吸氧指標,改善肺功能,對于日后臨床治療新生兒呼吸窘迫綜合征機械通氣器具上的選擇有指導意義。

