苦參素對腫瘤源性內皮細胞生物學行為的作用及其分子機制
張彩靈黃贊松13
(1. 右江民族醫學院附屬醫院消化內科,廣西 百色 533000;2. 右江民族醫學院研究生學院,廣西 百色 533000;3. 廣西肝膽疾病臨床醫學研究中心,廣西 百色 533000)
在全球范圍內,原發性肝癌(簡稱肝癌) 在腫瘤死亡率中排名第3位[1],而在我國,肝癌死亡率在主要惡性腫瘤中排名第2位,僅次于肺癌[2]。盡管近幾年來肝癌的預防、檢測和治療方面取得了顯著進展,但由于肝癌早期無明顯癥狀,導致診斷時已處于晚期,治療效果差,預后欠佳[3-4]。肝癌作為一種高度異質性的惡性腫瘤,其組織血供豐富,因此抗肝癌血管生成的治療具有重大意義。
苦參素是從豆科植物苦參、苦豆子、山豆根中提取的一種生物活性成分,以氧化苦參堿為主,具有抑制腫瘤細胞增殖、抑制腫瘤細胞侵襲遷移、抑制腫瘤血管生成等抗腫瘤特性,通過多種不同作用機制它也可以發揮一定的抗肝癌作用[5-6]。轉錄因子E26轉化特異性序列1(E26 transformation-specific sequence 1,Ets-1)是一種54 kDa的核蛋白,是內皮細胞基因轉錄的主要調控因子,研究表明[7]VEGF可以通過刺激Ets-1的乙酰化來刺激RNA聚合酶Ⅱ暫停釋放以驅動內皮細胞的血管生成反應。有研究發現[8]通過上調人臍靜脈內皮細胞(HUVEC)中的Ets-1轉錄來提高 VEGFR1表達,可能抑制 VEGFR2介導的促血管生成反應,但大量證據表明[9]Ets-1在腫瘤細胞及腫瘤相關基質細胞中表達增高。腫瘤血管生成歷經血管內皮基底膜降解、內皮細胞增殖及遷移等過程,是腫瘤發生發展的關鍵步驟,目前對于苦參素如何抑制腫瘤血管生成的作用及機制仍不十分明確。本研究通過肝癌細胞條件培養基將HUVEC誘導形成腫瘤源性內皮細胞(tumor-derived endothelial cells,Td-EC),觀察苦參素對Td-EC增殖、遷移及血管形成等腫瘤細胞生物學行為及Ets-1表達的影響,探討其作用的可能分子機制。
1 材料與方法
1.1 材料 HUVEC購自中國科學院昆明細胞庫,人肝癌HepG2細胞由右江民族醫學院廖長秀博士惠贈,苦參素注射液購自鄭州卓峰制藥有限公司(批號:國號準字H20033744,規格:2 ml,0.2 g×10支/盒),胎牛血清購自Gemini公司(批號:A24G00J),DMEM高糖培養基購自Gibco公司(批號:8119272),內皮細胞培養基ECM(包含500ml基礎培養基、25 ml胎牛血清、5 ml內皮細胞生長補充劑、5 ml青霉素/鏈霉素溶液)購自Sciencell公司(批號:No.28094),CCK-8試劑盒購自MCE公司(批號:No.42830),Matrigel Basement Membrane Matrix(基質膠)購自BD公司(貨號:356234,批號:9246010),0.25%胰蛋白酶-EDTA消化液、二甲基亞砜購自北京索萊寶科技有限公司,RNAiso Plus、逆轉錄試劑盒、TB Green○RPremix Ex TaqTM試劑盒及引物購自寶生物工程(大連)有限公司。
1.2 方法
1.2.1 細胞培養 HUVEC采用含5%胎牛血清、內皮細胞生長補充劑(ECGS)的ECM培養,置于37℃、含5% CO2培養箱中貼壁培養,細胞密度達70%~80%時可進行傳代,每2~3 d傳代1次,所有實驗均采用對數生長期細胞。HepG2細胞在含有10%胎牛血清的DMEM培養基中培養,置于37℃、含5% CO2培養箱中貼壁培養,所有實驗均采用對數生長期細胞。當細胞密度達70%時,更換為無血清的DMEM培養基繼續培養48 h后收集細胞上清液,1000 r/min離心5 min,用0.22 μm過濾器過濾,并在-80℃下儲存作為條件培養基。將HUVEC與含有50%HepG2細胞條件培養基的內皮細胞培養基一起培養48 h,以變成Td-EC,檢測腫瘤內皮標志物1(TEM1)和腫瘤內皮標志物8(TEM8)來驗證Td-EC的身份,可以有助于與HUVEC區分[10]。通過檢測TEM1、TEM8的表達升高確認HUVEC已向Td-EC轉變,表明Td-EC細胞模型成功,應用于后續實驗。
1.2.2 CCK-8法檢測苦參素對Td-EC的抑制作用 收集Td-EC,胰酶消化重懸成單細胞懸液,計數,調整細胞密度為5×104個/毫升,100微升/孔接種于96孔板中。設實驗組(苦參素組)、陰性對照組(含等量完全培養基)、空白對照組(只含完全培養基,不含苦參素、細胞),每組設4個復孔。預培養24 h后,棄舊培養基,分別向實驗組加入含苦參素濃度為0.375 mg/ml、0.75 mg/ml、1.5 mg/ml、3 mg/ml、6 mg/ml的完全培養基,100微升/孔;向陰性對照組及空白對照組加入等量完全培養基。繼續培養24 h后,每組分別加入10微升/孔CCK-8溶液,繼續孵育3 h,用酶標儀測定在450 nm波長處各組吸光度值(A值),計算苦參素對細胞作用24 h后的抑制率。實驗非同日重復3次。計算公式:抑制率(%)=[1-(實驗組A值-空白對照組A值)-(陰性對照組A值-空白對照組A值)]×100%。選擇半數抑制率(50% inhibitory concentration,IC50)的藥物濃度作為后續實驗干預條件。
1.2.3 細胞劃痕實驗檢測苦參素對Td-EC遷移的影響 在6孔板孔底部背面畫5條平行的直線做標記。胰酶消化HUVEC重懸成單細胞懸液,計數,調整細胞密度為 5×104個/毫升,2毫升/孔接種到6孔板中,誘導HUVEC變成Td-EC后當細胞密度至80%~90%時,用無菌的10 μl槍頭垂直所畫標記直線方向在每孔內劃2條痕。用無血清的ECM基礎培養基輕洗2遍。實驗分為2組,實驗組加入含IC50濃度(經計算為3.5 mg/ml)苦參素的低血清濃度培養基(含0.5%胎牛血清、含50%HepG2細胞條件培養基),陰性對照組加入等量低血清濃度培養基,于不同時間點(0 h、24 h)在劃痕的同一位置觀察拍照,每孔隨機4個拍照點,每組細胞設3個復孔。實驗非同日重復3次。用Image J軟件統計劃痕面積,計算各組細胞劃痕愈合率。計算公式:劃痕愈合率(%)=(0 h的劃痕面積-24 h的劃痕面積)/0 h的劃痕面積×100%。
1.2.4 體外血管形成實驗檢測苦參素對Td-EC管形成的影響 取預冷的融解基質膠50微升/孔均勻涂布96孔板,置于37℃培養箱中1 h。實驗組分為2組,實驗組加入含IC50濃度(經計算為3.5 mg/ml)苦參素的ECM,陰性對照組加入等量培養基,胰酶消化Td-EC后用對應組別的培養基重懸成單細胞懸液,計數,調整細胞密度為 2×105個/毫升,100微升/孔接種于基質膠表面。于不同時間點(3 h、24 h)用倒置顯微鏡觀察每孔管形成變化,每孔隨機4個拍照點,每組細胞設3個復孔。實驗非同日重復3次。用Image J軟件統計管形成的數量。
1.2.5 實時定量逆轉錄PCR(real-time quantitative reverse transcription PCR,real-time qRT-PCR)檢測Ets-1 mRNA的表達 設HUVEC組、Td-EC組,同時將Td-EC作為實驗對象分為2組,實驗組加入含IC50濃度(經計算為3.5mg/ml)苦參素的ECM,陰性對照組加入等量培養基。藥物干預24 h后,采用RNAiso Plus提取細胞總RNA,按PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)試劑盒說明書制備cDNA。以cDNA為模板,GAPDH為內參進行實時熒光定量PCR。Ets-1引物序列:上游引物5′-GTCATTCCTGCTGCTGCCCTA-3′,下游引物 5′-AGTTTGAATTCCCAGCCATCTCC-3′,產物長度137 bp,TEM1引物序列:上游引物 5′-GTGGACACAGATGAGTGCCAGA-3′,下游引物 5′-CCCTCGCTACAATAACACTCGAAG-3′,產物長度89 bp,TEM8引物序列:上游引物 5′-CAAGATGCCGGAGCAGGAATA-3′,下游引物 5′-AGGACCCACAAGGCATCGAG-3′,產物長度126 bp,GAPDH引物序列:上游引物 5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物 5′-TGGTGAAGACGCCAGTGGA-3′,產物長度138 bp。反應條件:預變性95℃ 30 s;PCR反應 95℃ 5 s,60℃ 30 s,共40個循環。采用2-ΔΔCt方法計算目的基因的相對表達量,其中ΔΔCt=(實驗組目的基因Ct值-實驗組內參基因Ct值)-(對照組目的基因Ct值-對照組內參基因Ct值)。
2 結果
2.1 不同濃度苦參素對Td-EC增殖的影響 苦參素作用Td-EC 24 h后,各組A值總體比較差異有統計學意義(F=152.49,P<0.05),各濃度苦參素組對Td-EC增殖均有不同程度抑制作用,與陰性對照組相比差異有統計學意義(P<0.05),見表1。作用24 h的IC50為(3.58±0.37) mg/ml,故選擇3.5 mg/ml的苦參素濃度作為后續實驗干預條件。
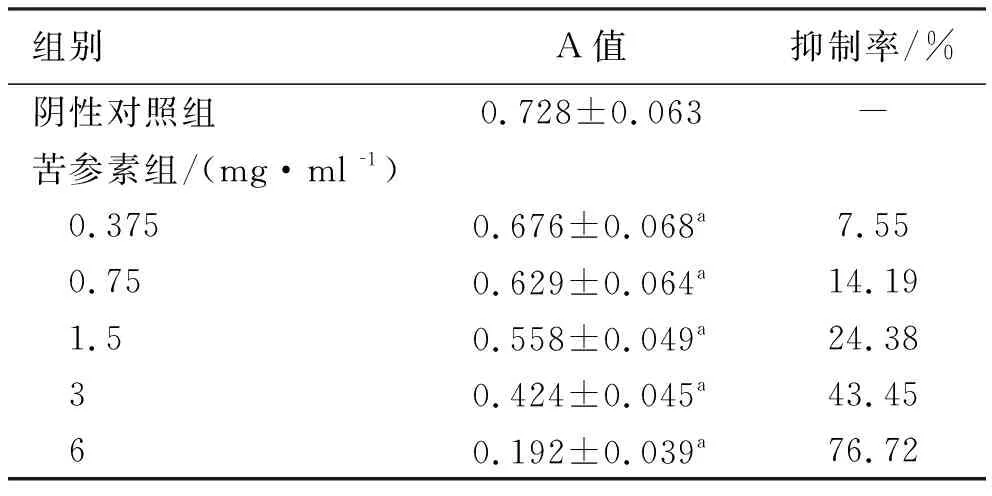
表1 不同濃度苦參素作用Td-EC 24 h后A值及細胞抑制率 (n=12)
2.2 苦參素對Td-EC遷移能力的影響 細胞劃痕實驗顯示,3.5 mg/ml濃度的苦參素作用Td-EC 24 h后劃痕愈合率明顯下降,與陰性對照組相比差異有統計學意義(t=-12.656,P<0.001),見圖1。
2.3 苦參素對Td-EC管形成的影響 體外血管形成實驗顯示,Td-EC在3 h后逐漸出現管形成,3.5 mg/ml濃度的苦參素作用Td-EC 3 h后管形成數量與陰性對照組相比差異無統計學意義(t=0.781,P=0.479),3.5 mg/ml濃度的苦參素作用Td-EC 24 h后的管形成數量明顯減少,與陰性對照組相比差異有統計學意義(t=-5.276,P<0.05),見圖2。
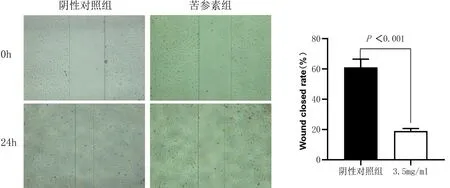
圖1 苦參素對Td-EC遷移能力的影響 (×40)
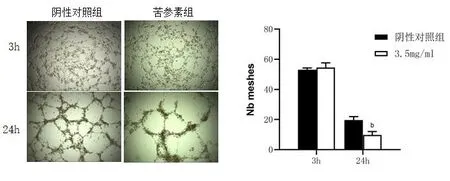
注:與陰性對照組比較,b:P<0.05。
2.4 Ets-1、TEM1、TEM8在Td-EC中的表達水平及苦參素對Td-EC中Ets-1 mRNA表達的影響 實時定量逆轉錄PCR顯示,Ets-1在Td-EC中的相對表達量增高,與HUVEC相比,Ets-1 mRNA表達量差異有統計學意義(t=-5.556,P<0.05),見圖3A。同時3.5 mg/ml濃度的苦參素對Td-EC中Ets-1 mRNA的表達有抑制作用,與陰性對照組相比差異有統計學意義(t=28.960,P=0.001),見圖3B。與HUVEC相比,TEM1、TEM8在Td-EC中的相對表達量均增高,差異有統計學意義(P<0.05),見圖3C、3D。

圖3 各組細胞Ets-1、TEM1、TEM8 mRNA相對表達量比較
3 討論
腫瘤可以誘導血管生成,腫瘤血管可以為腫瘤組織輸送氧氣及營養、促進代謝等,以利于腫瘤生長、轉移,Td-EC是腫瘤血管生成的重要參與者,但Td-EC的分離應用研究仍存在困難[11]。大量研究表明,通過條件培養基共培養、三維細胞共培養等體外共培養模式,可以構建與肝癌[10]、肺癌[12]、乳腺癌[13]等多種腫瘤相關的Td-EC。肝癌是一種血管高度異質性的實體腫瘤,血管生成模式多樣,機制復雜,使得抗肝癌血管生成治療效果欠佳[14]。目前苦參素作用肝癌血管內皮細胞方面的研究少有報道,本研究通過構建肝癌細胞條件培養基共培養體系以了解苦參素有無抗肝癌血管生成作用奠定基礎。Croix BS等[15]采用基因序列分析表達技術比較來源正常和惡性結直腸組織的血管內皮細胞的基因表達模式,發現了9個在腫瘤血管內皮細胞特異性表達的基因(TEM1-TEM9),并命名為腫瘤內皮標志物(tumor endothelial markers,TEM)。其中腫瘤內皮標志物1(TEM1,又稱內皮唾液酸蛋白)是由757個氨基酸組成的Ⅰ型跨膜糖蛋白,腫瘤內皮標志物8(TEM8,又稱炭疽毒素受體-1)是由564個氨基酸組成的Ⅰ型跨膜糖蛋白,已有研究表明,它們在正常組織及其血管中不表達或少量表達,但在腫瘤血管內皮細胞中表達明顯增高,TEM1、TEM8高表達的血管內皮細胞具有腫瘤特異性[10,16-17]。本實驗qRT-PCR結果顯示,與HUVEC相比,Td-EC中TEM1及TEM8 mRNA表達量明顯增高,從基因表達水平上驗證了在HepG2細胞條件培養基作用下HUVEC向Td-EC的轉變。
苦參素能影響腫瘤的血管生成,有研究發現,苦參素可抑制人肝癌SMMC-7721細胞條件培養基誘導的血管內皮細胞增殖,可能通過抑制MAPK/ERK信號傳導通路來抑制肺腺癌A549細胞條件培養基誘導的HUVECs增殖與遷移,同時其聯合化療藥物對肝癌、胃癌等移植瘤的血管生成有協同抗血管生成作用[12,18-20]。本研究結果顯示,Td-EC增殖的抑制作用隨著苦參素作用濃度增加而增強,同時,經IC50濃度苦參素作用24 h后的Td-EC與對照組相比,細胞遷移能力及小管形成能力明顯下降,說明苦參素能抑制Td-EC的細胞增殖、細胞遷移及成管能力,這些數據表明苦參素可能有抗肝癌血管生成的作用,與前述文獻[12,18-20]中的研究結果是一致的。Ets轉錄因子家族是一類含有高度保守DNA結合結構域的轉錄因子,調控著機體許多正常發育及病理過程,在實體腫瘤中通過驅動癌細胞自我更新、調節染色質表觀遺傳學等方式調控腫瘤生長,Ets-1是最早被發現的Ets轉錄因子,主要作為轉錄激活因子調節生理和病理條件下的血管生成[21]。有研究表明[22]Ets-1在非小細胞肺癌癌組織中過表達并且與腫瘤組織中的微血管密度呈正相關,它可以誘導非小細胞肺癌細胞向內皮樣細胞分化以促進腫瘤肝轉移。Furlan A等[13]研究發現乳腺癌細胞中過表達的Ets-1促進腫瘤細胞對內皮細胞黏附而利于腫瘤毛細血管形成,并且內皮細胞也通過募集腫瘤細胞分泌的基質金屬蛋白酶-9(MMP-9)而誘發血管生成。本研究通過qRT-PCR檢測結果發現,經HepG2細胞條件培養基誘導獲得的Td-EC中Ets-1 mRNA表達高于HUVEC,經過苦參素作用后,Td-EC中Ets-1 mRNA表達降低,提示苦參素可能通過抑制Td-EC中Ets-1 mRNA的表達,從而抑制Td-EC的細胞增殖、細胞遷移及成管能力。
綜上所述,本實驗研究證實,HepG2細胞條件培養基能促使HUVEC向Td-EC轉變,苦參素能抑制Td-EC增殖、遷移及成管能力,其分子機制可能與抑制Ets-1 mRNA表達有關。

