紫甘薯花色苷通過調控KTN1-AS1表達對肺癌細胞的增殖和凋亡的影響
范智彥,劉金菊
(1.臨沂市第三人民醫院,山東 臨沂 276004;2.臨沂市腫瘤醫院,山東 臨沂 276004)
肺癌是一種常見的惡性腫瘤,其惡性程度高,5年生存率較低,嚴重威脅患者生命健康[1]。目前,肺癌的治療手段主要有手術、放療及化療,但腫瘤細胞易對化療藥物產生耐藥性,導致治療效果不佳[2]。因此,尋找并開發低毒且高效的天然藥物尤為重要。紫甘薯屬旋花科一年生草本植物,富含天然花色苷。花色苷具有抗氧化、抗腫瘤和降血糖等作用,且無毒副作用[3-4]。研究顯示,紫甘薯花色苷可有效抑制膀胱癌細胞增殖,阻滯細胞周期進程,并促進細胞凋亡,發揮抗腫瘤作用[5]。但目前還未見紫甘薯花色苷影響肺癌細胞惡性生物學行為的相關報道。KTN1-AS1是近年新發現的一種長鏈非編碼RNA(long non-coding RNA,lncRNA),其在肺鱗癌組織中表達上調,且高表達的患者預后較差[6]。但目前KTN1-AS1對肺癌發生發展的影響還未知。因此,本研究以肺癌A549細胞為研究對象,KTN1-AS1為切入點,探討了紫甘薯花色苷對A549細胞增殖和凋亡的影響及分子機制。
1 儀器與材料
1.1 儀器
CO2培養箱(美國Thermo公司);Statfax 4300全自動酶標儀(北京華泰和合商貿有限公司);FACScan流式細胞儀(美國Becton Dickinson公司);PCR儀(美國Applied Biosystems公司);凝膠成像系統(美國Bio RAD公司)。
1.2 材料
肺癌A549細胞(中國科學院上海細胞庫);胎牛血清(FBS,浙江天杭生物科技股份有限公司);RPMI 1640培養基,細胞計數試劑盒-8(CCK-8),胰蛋白酶,LipofectamineTM2000試劑盒,二喹啉甲酸(BCA)蛋白檢測試劑盒和Annexin V-FITC/PI細胞凋亡試劑盒(北京索萊寶科技有限公司);KTN1-AS1小干擾RNA(si-KTN1-AS1)及亂序無意義陰性序列(si-NC),KTN1-AS1過表達載體(pcDNA-KTN1-AS1),空載體(pcDNA,上海吉瑪制藥技術有限公司);逆轉錄試劑盒和PCR試劑盒(大連寶生物工程有限公司);Trizol試劑(美國Invitrogen公司);PCR引物(上海生工生物工程有限公司);兔抗人細胞周期蛋白D1(cyclin D1),p21多克隆抗體(北京博奧森生物科技有限公司);B淋巴細胞瘤-2 蛋白(Bcl-2),B淋巴細胞瘤-2相關蛋白(Bax),甘油醛-3-磷酸脫氫酶(GAPDH)多克隆抗體(北京中杉金橋生物技術有限公司)。
2 方法
2.1 紫甘薯花色苷的制備
參照文獻方法紫甘薯花色苷[7]。選取新鮮、無病蟲害、無腐爛的紫甘薯,自來水洗凈,晾干后切成薄片,置于干燥機中干燥,溫度50 ℃。干燥后粉碎,過80目篩。準確稱取100 g紫甘薯粉,加入6000 ml蒸餾水,調整pH為6.0,加入50 g果膠酶,40 ℃水浴提取120 min。濾液經旋轉蒸發濃縮后,冷凍干燥,得25 mg花色苷。超純水配制為濃度為10 mg/ml的花色苷母液,過濾除菌,-20 ℃保存備用。使用時培養基稀釋為所需濃度。
2.2 細胞培養和轉染
A549細胞復蘇后,加入含10 % FBS的RPMI 1640培養基培養。取對數生長期的A549細胞,以1×105個/孔接種于6孔板中,采用LipofectamineTM2000脂質體法,將si-KTN1-AS1、si-NC、pcDNAKTN1-AS1和pcDNA分別轉染至A549細胞。轉染6 h后,換為含10 % FBS的RPMI 1640培養基。繼續培養48 h后,收集細胞用于后續實驗。
2.3 細胞分組
未進行轉染操作的A549細胞分為對照組、紫甘薯花色苷不同劑量組。其中對照組細胞常規培養基培養24 h;紫甘薯花色苷不同劑量組細胞分別用含紫甘薯花色苷終200,400,800 μg/ml[8]的培養基培養24 h。轉染si-KTN1-AS1、si-NC的細胞常規培養基培養24 h,記為si-KTN1-AS1組、si-NC組。轉染pcDNA-KTN1-AS1、pcDNA的細胞用紫甘薯花色苷終濃度為800 μg/ml的培養基培養24 h,記為紫甘薯花色苷800 μg/ml+pcDNA-KTN1-AS1組、紫甘薯花色苷800 μg/ml+pcDNA組。
2.4 CCK-8法檢測細胞增殖
將A549細胞以0.5×104個/孔接種于96孔板中,按2.3項下步驟分組處理,每組設3個復孔。培養后,加10 μl CCK-8試劑,繼續培養1.5 h后,采用酶標儀于450 nm處測吸光度值(A),計算細胞抑制率。抑制率(%)=(1-A實驗組/ A對照組)×100 %。重復3次。
2.5 流式細胞儀檢測細胞凋亡
將A549細胞以2.5×104個/孔接種于24孔板中,按2.3項下步驟分組處理,每組設3個復孔。培養后,收集細胞。參照Annexin V-FITC/PI試劑盒說明書,采用流式細胞儀檢測細胞凋亡。
2.6 實時熒光定量PCR(RT-qPCR)檢測細胞中KTN1-AS1表達
將A549細胞以2.5×104個/孔接種于24孔板中,按2.3項下步驟分組處理,每組設3個復孔。培養后,收集細胞。Trizol試劑提取細胞中總RNA,逆轉錄為cDNA,進行PCR擴增。擴增條件:95 ℃3 min,95 ℃15 s,60 ℃30 s,72℃30 s,共35個循環。引物序列:KTN1-AS1上游5'-GGGTCCAGGCTATACGAGAC-3',下游5'-GGACAGTTGGAAGATGGTGC- 3';內參GAPDH上游5'-GGCCTCCAAGGAGTAAGACC-3',下游5'-CAAGGGGTCTACATGGCAAC-3'。2-ΔΔCt法計算KTN1-AS1表達水平。
2.7 蛋白印跡法(Western Blot)檢測細胞中cyclin D1、p21、Bcl-2和Bax蛋白表達水平
將A549細胞以每孔2.5×104個接種于24孔板中,按2.3項下步驟分組處理,每組設3個復孔。培養后,收集細胞。RIPA試劑提取細胞中總蛋白,BCA法對蛋白定量后,行12 %十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)。電泳后,將分離蛋白電轉移至聚偏乙烯二氟(PVDF)膜,于5 %脫脂奶粉中封閉1 h。分別置于cyclin D1(1:1000)、p21(1:1000)、Bcl-2(1:800)、Bax(1:800)和GAPDH(1:1000)一抗孵育液中,4 ℃過夜。置于辣根過氧化酶標記的山羊抗兔二抗(1:5000)孵育液中,37 ℃孵育1 h。加入化學發光試劑避光顯影,曝光拍照,Image J軟件分析蛋白條帶灰度值。
2.8 統計學分析
利用SPSS.22.0軟件分析實驗數據。符合正態分布的計量資料以均數±標準差(±s)表示。兩組間比較采用獨立樣本t檢驗。多組間比較采用單因素方差分析,進一步兩兩比較采用SNK-q檢驗。以P<0.05表示差異有統計學意義。
3 結果
3.1 紫甘薯花色苷對肺癌A549細胞增殖的影響
與對照組比較,紫甘薯花色苷不同劑量組細胞抑制率升高(P<0.05),cyclin D1蛋白表達降低(P<0.05),p21蛋白表達升高(P<0.05),且呈劑量依賴性(P<0.05)。見圖1、表1。
表1 紫甘薯花色苷對A549細胞增殖和相關蛋白表達的影響(±s,n=9)
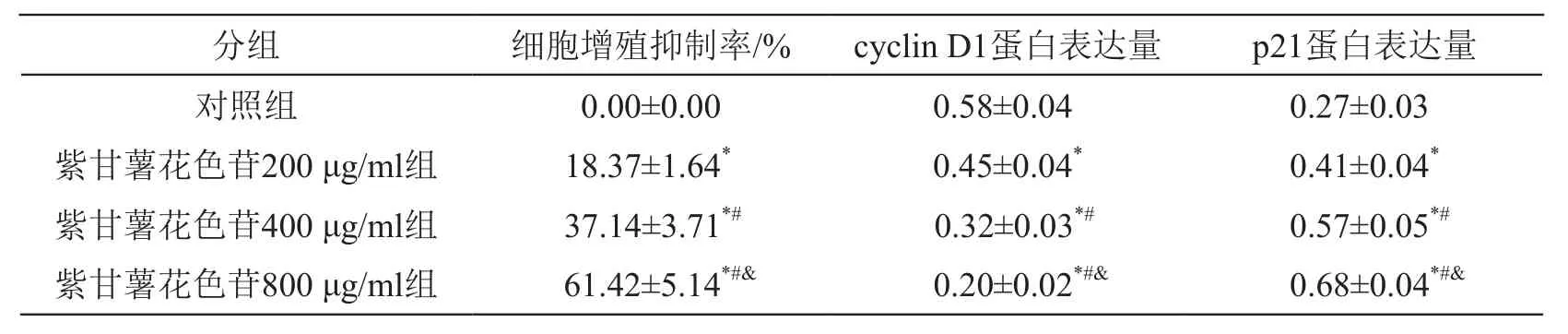
表1 紫甘薯花色苷對A549細胞增殖和相關蛋白表達的影響(±s,n=9)
注:*P<0.05 vs 對照組;#P<0.05 vs 紫甘薯花色苷200 μg/ml組;&P<0.05 vs 紫甘薯花色苷400 μg/ml組
分組 細胞增殖抑制率/% cyclin D1蛋白表達量 p21蛋白表達量對照組 0.00±0.00 0.58±0.04 0.27±0.03紫甘薯花色苷200 μg/ml組 18.37±1.64* 0.45±0.04* 0.41±0.04*紫甘薯花色苷400 μg/ml組 37.14±3.71*# 0.32±0.03*# 0.57±0.05*#紫甘薯花色苷800 μg/ml組 61.42±5.14*#& 0.20±0.02*#& 0.68±0.04*#&
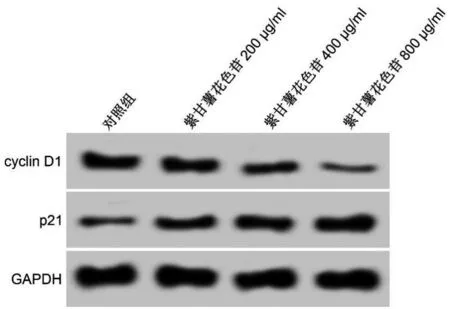
圖1 紫甘薯花色苷對A549細胞中cyclin D1和p21蛋白表達的影響
3.2 紫甘薯花色苷對肺癌A549細胞凋亡的影響
與對照組比較,紫甘薯花色苷不同劑量組細胞凋亡率和Bax蛋白表達升高(P<0.05),Bcl-2蛋白表達降低(P<0.05),且呈劑量依賴性。見圖2、表2。
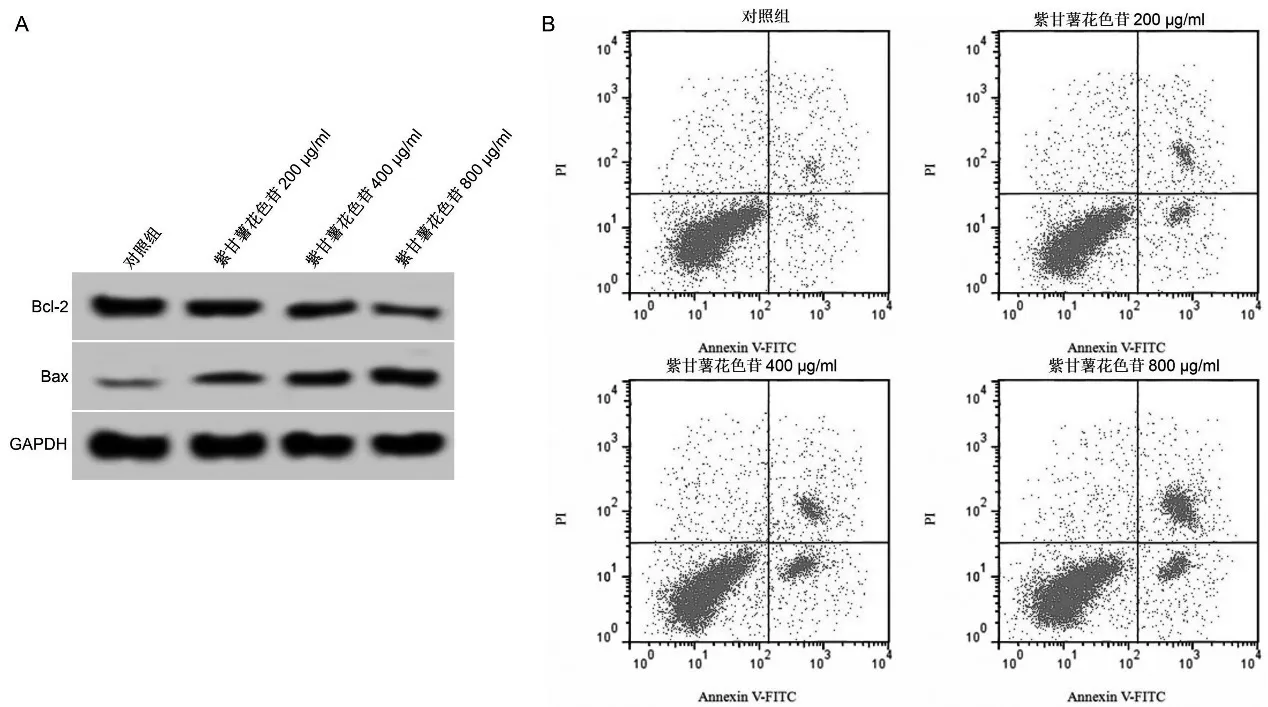
圖2 紫甘薯花色苷對A549細胞中Bcl-2和Bax蛋白表達及凋亡的影響
表2 紫甘薯花色苷對A549細胞凋亡及Bcl-2和Bax蛋白表達的影響(±s,n=9)
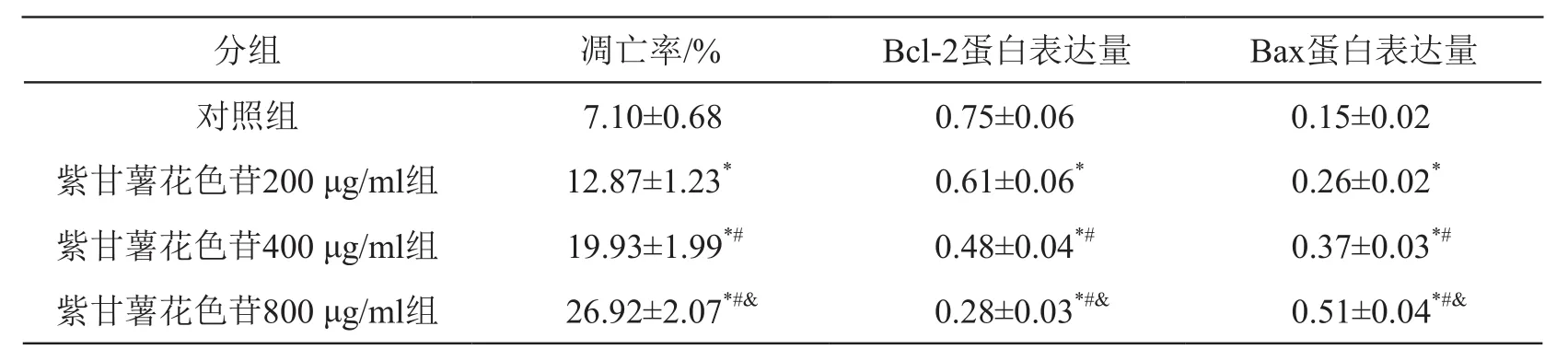
表2 紫甘薯花色苷對A549細胞凋亡及Bcl-2和Bax蛋白表達的影響(±s,n=9)
注:*P<0.05 vs 對照組;#P<0.05 vs 紫甘薯花色苷200 μg/ml組;&P<0.05 vs 紫甘薯花色苷400 μg/ml組
分組 凋亡率/% Bcl-2蛋白表達量 Bax蛋白表達量對照組 7.10±0.68 0.75±0.06 0.15±0.02紫甘薯花色苷200 μg/ml組 12.87±1.23* 0.61±0.06* 0.26±0.02*紫甘薯花色苷400 μg/ml組 19.93±1.99*# 0.48±0.04*# 0.37±0.03*#紫甘薯花色苷800 μg/ml組 26.92±2.07*#& 0.28±0.03*#& 0.51±0.04*#&
3.3 紫甘薯花色苷對肺癌A549細胞中KTN1-AS1表達的影響
與對照組比較,紫甘薯花色苷不同劑量組細胞中KTN1-AS1表達水平降低(P<0.05),且呈劑量依賴性。見表3。
表3 紫甘薯花色苷對A549細胞中KTN1-AS1表達的影響(±s,n=9)
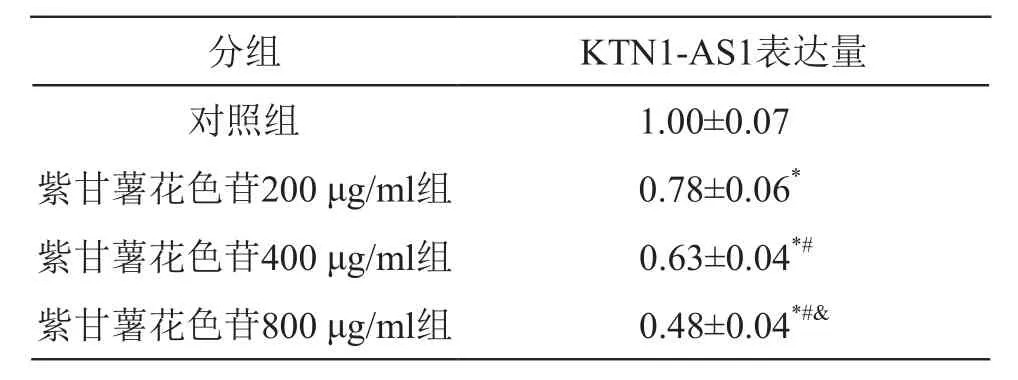
表3 紫甘薯花色苷對A549細胞中KTN1-AS1表達的影響(±s,n=9)
注:*P<0.05 vs 對照組;#P<0.05 vs 紫甘薯花色苷200 μg/ml組;&P<0.05 vs 紫甘薯花色苷400 μg/ml組
分組 KTN1-AS1表達量對照組 1.00±0.07紫甘薯花色苷200 μg/ml組 0.78±0.06*紫甘薯花色苷400 μg/ml組 0.63±0.04*#紫甘薯花色苷800 μg/ml組 0.48±0.04*#&
3.4 下調KTN1-AS1表達對肺癌A549細胞增殖和凋亡的影響
與si-NC組比較,si-KTN1-AS1組細胞中KTN1-AS1表達水平降低(P<0.05),細胞抑制率、凋亡率及p21和Bax蛋白表達升高(P<0.05),cyclin D1和Bcl-2蛋白表達降低(P<0.05)。見圖3、表4。
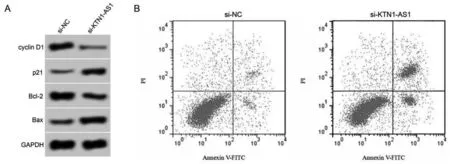
圖3 下調KTN1-AS1表達對A549細胞增殖和凋亡的影響
表4 下調KTN1-AS1表達對A549細胞增殖和凋亡及相關蛋白表達的影響(±s,n=9)
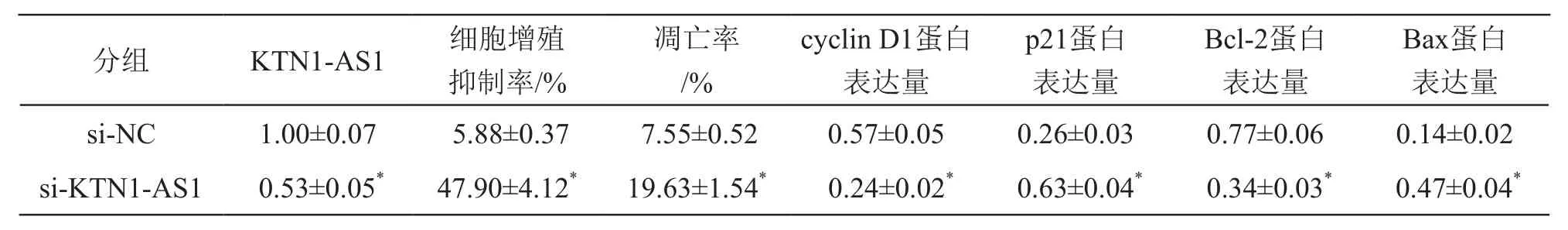
表4 下調KTN1-AS1表達對A549細胞增殖和凋亡及相關蛋白表達的影響(±s,n=9)
注:*P<0.05 vs si-NC組
Bax蛋白表達量si-NC 1.00±0.07 5.88±0.37 7.55±0.52 0.57±0.05 0.26±0.03 0.77±0.06 0.14±0.02 si-KTN1-AS1 0.53±0.05* 47.90±4.12* 19.63±1.54* 0.24±0.02* 0.63±0.04* 0.34±0.03* 0.47±0.04*分組 KTN1-AS1 細胞增殖抑制率/%凋亡率/%cyclin D1蛋白表達量p21蛋白表達量Bcl-2蛋白表達量
3.5 上調KTN1-AS1表達逆轉紫甘薯花色苷對肺癌A549細胞增殖和凋亡的影響
與紫甘薯花色苷800 μg/ml+pcDNA組比較,紫甘薯花色苷800 μg/ml+pcDNA-KTN1-AS1組細胞抑制率、凋亡率及p21和Bax蛋白表達降低(P<0.05),KTN1-AS1及cyclin D1和Bcl-2蛋白表達升高(P<0.05)。見圖4、表5。
表5 上調KTN1-AS1表達逆轉紫甘薯花色苷對A549細胞增殖和凋亡及相關蛋白表達的影響(±s,n=9)
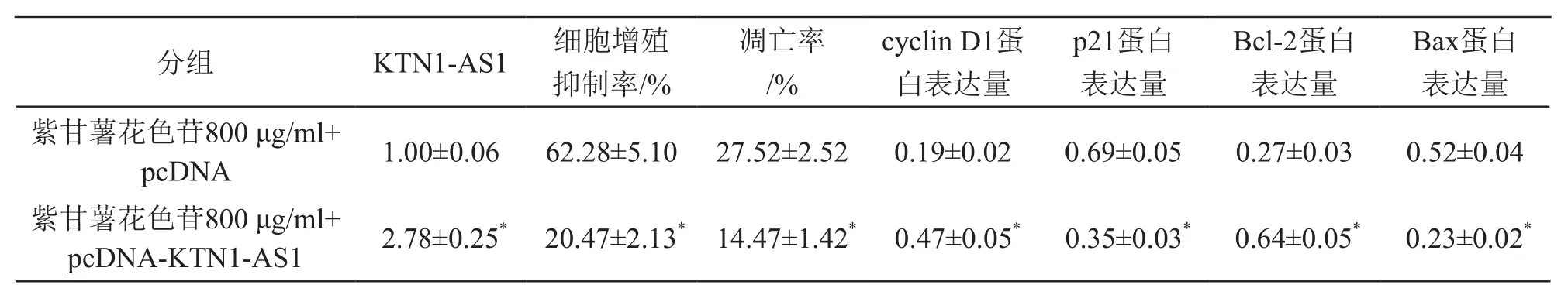
表5 上調KTN1-AS1表達逆轉紫甘薯花色苷對A549細胞增殖和凋亡及相關蛋白表達的影響(±s,n=9)
注:*P<0.05 vs 紫甘薯花色苷800 μg/ml+pcDNA組
Bax蛋白表達量紫甘薯花色苷800 μg/ml+pcDNA 1.00±0.06 62.28±5.10 27.52±2.52 0.19±0.02 0.69±0.05 0.27±0.03 0.52±0.04紫甘薯花色苷800 μg/ml+pcDNA-KTN1-AS1 2.78±0.25* 20.47±2.13* 14.47±1.42* 0.47±0.05* 0.35±0.03* 0.64±0.05* 0.23±0.02*分組 KTN1-AS1 細胞增殖抑制率/%凋亡率/%cyclin D1蛋白表達量p21蛋白表達量Bcl-2蛋白表達量
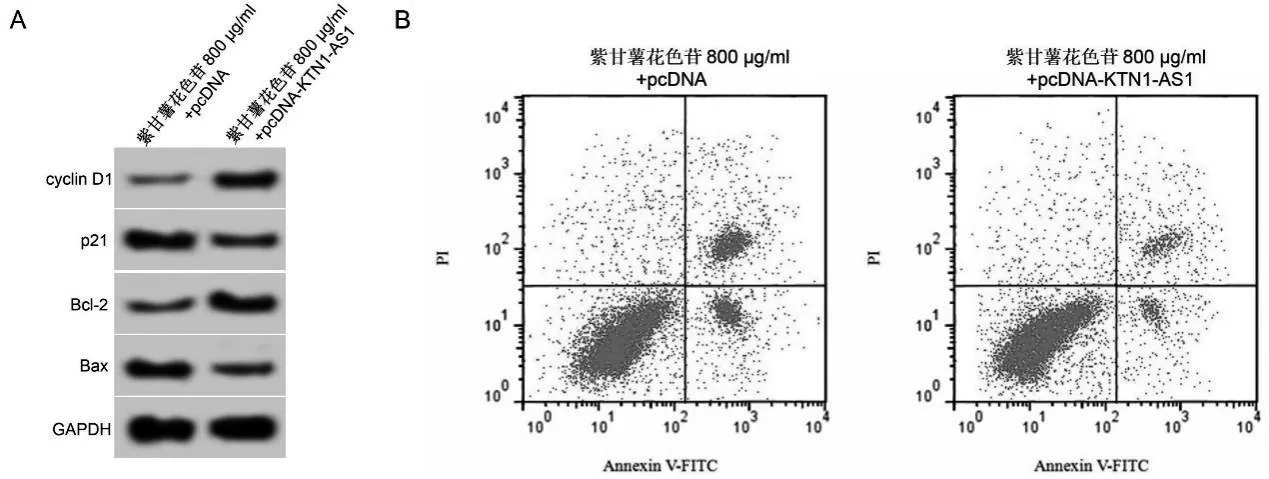
圖4 上調KTN1-AS1表達逆轉紫甘薯花色苷對A549細胞增殖和凋亡的影響
4 討論
肺癌是世界范圍內的常見腫瘤,具有較高的病死率,嚴重威脅人類生命健康。近年,肺癌的治療取得了一定進展,但由于肺癌發病隱匿,多數患者確診時已處于晚期,預后仍不佳。因此,尋找治療肺癌的新方法尤為重要。紫甘薯花色苷是從紫甘薯中獲得的天然色素,無毒、無異味,且性質穩定。研究顯示,紫甘薯花色苷具有抑菌[9]、抗氧化[10]等功效。但目前,紫甘薯花色苷在抗腫瘤方面的研究還很少見。
正常細胞增殖和凋亡處于動態平衡,而惡性腫瘤細胞增殖和凋亡平衡被打破,細胞無限增殖而凋亡降低。cyclin D1可促進細胞周期由G1期進入S期,加速細胞增殖[11]。p21是一種腫瘤抑制因子,主要通過調控細胞周期維持細胞的生長和增殖[12]。本研究顯示,紫甘薯花色苷可呈劑量依賴性降低肺癌A549細胞中cyclin D1蛋白表達,促進p21蛋白表達,說明其可有效抑制A549細胞增殖。誘導腫瘤細胞凋亡是抗癌藥物發揮作用的一種途徑。細胞的凋亡受多種基因的調控,抗凋亡蛋白Bcl-2和促凋亡蛋白Bax參與調控細胞凋亡[13]。Bcl-2主要位于線粒體膜和外膜,可通過抑制細胞色素C等促凋亡分子的釋放抑制細胞凋亡[14]。Bax可改變線粒體通透性,誘導細胞色素C等促凋亡分子的釋放,誘導細胞凋亡[15]。本研究顯示,紫甘薯花色苷可劑量依賴性抑制提高A549細胞凋亡率及細胞中中Bcl-2蛋白表達,而促進Bax蛋白表達,表明紫甘薯花色苷可誘導肺癌A549細胞凋亡。這些結果表明紫甘薯花色苷在一定程度上具有抗肺癌的作用,具有開發為治療肺癌藥物的潛在價值。
lncRNA是一類參與調控細胞增殖、凋亡和分化等生命學過程的小分子非編碼RNA,與人類腫瘤的發生發展密切相關[16-17]。研究顯示,KTN1-AS1在肝癌組織中表達升高,其高表達的患者預后不良,下調其表達可抑制肝癌細胞增殖和集落形成,并促進細胞凋亡[18];KTN1-AS1在頭頸部鱗狀細胞癌(HNSCC)中表達升高,其促進HNSCC細胞增殖、遷移、侵襲和上皮間質轉化,是HNSCC治療的潛在分子靶標[19]。但KTN1-AS1對肺癌發生發展的影響還未知。本研究通過轉染KTN1-AS1小干擾RNA下調KTN1-AS1表達后,A549細胞增殖能力降低,凋亡加劇,表明下調KTN1-AS1表達可抑制A549細胞增殖,并誘導細胞凋亡,提示KTN1-AS1可能作為促癌基因參與肺癌發生發展,是肺癌治療的潛在分子靶點。本研究還顯示,紫甘薯花色苷可劑量依賴性抑制肺癌A549細胞中KTN1-AS1表達,而上調KTN1-AS1表達則逆轉了紫甘薯花色苷對A549細胞增殖的抑制作用及凋亡促進作用,提示紫甘薯花色苷可能通過下調KTN1-AS1表達來抑制A549細胞增殖,并誘導細胞凋亡。
綜上,紫甘薯花色苷可劑量依賴性抑制肺癌A549細胞增殖,并誘導細胞凋亡,其可能通過下調細胞中KTN1-AS1表達發揮作用,可能為肺癌治療藥物的研發提供了新途徑。

