低溫脅迫下魚類鰓中RPL11/MDM2/P53信號通路相關基因及蛋白表達差異分析
劉明麗,楊文意,王金鳳,陳良標*
(1.上海海洋大學 水產種質資源發掘與利用教育部重點實驗室,上海 201306;2.國家海洋生物科學國際聯合研究中心, 上海201306;3.水產科學國家級實驗教學示范中心,上海201306)
變溫動物無法使身體的溫度保持恒定,其體溫只能隨環境的變化而變化。魚類作為典型的變溫動物,其行為和體內生理變化都在一定范圍內受到水溫變化的影響,因此,水溫對魚類的生存具有重要的影響。當水溫急劇降低,會使魚類產生冷應激。然而即使在同一低溫脅迫下,不同的魚類對于冷脅迫耐受卻存在較大的差別,而造成這種低溫耐受差異的分子機制還有待進一步研究。
模式動物斑馬魚Daniorerio是一種廣溫性的魚類,其體型較小,性成熟周期短,能夠忍受水溫季節性較廣的溫度波動[1-2]。有試驗表明,斑馬魚在一定時間內能夠忍受9 ℃的低溫[1],與斑馬魚相比,羅非魚Oreochromisniloticus忍受低溫的能力則較弱。同樣的降溫策略下比較羅非魚和斑馬魚的耐寒性發現,經歷8 ℃、12 h的低溫后羅非魚出現了死亡的現象,但是斑馬魚只是出現了身體失去平衡的現象,并沒有死亡,這表明在這種降溫策略下斑馬魚比羅非魚的耐寒能力更強[3]。研究者通過對兩種魚類死亡前各時間點各組織的凋亡信號檢測,發現羅非魚的鰓組織在8 ℃、6 h時出現大量的凋亡信號,但是斑馬魚鰓中卻幾乎沒有凋亡信號,并且這種凋亡信號只在鰓組織中比較明顯,在其他組織幾乎檢測不到[3]。除此之外,一些魚類的鰓組織在應對低溫刺激時表現出很強的形態可塑性[4-6],并且有許多關于魚類鰓組織響應低溫刺激的轉錄表達譜分析[7-8],這些均表明鰓組織細胞凋亡可能是魚類耐受低溫的薄弱環節。
細胞凋亡(apoptosis)是一種機體在一定程度的壓力條件下為了避免受到壓力的損傷而采取的一種積極主動的適應性措施[9]。在細胞凋亡早期,可以通過對受到壓力導致的不能恢復的細胞進行清除以達到保護組織免受壓力損傷的目的,但是當細胞凋亡積累到一定程度時也會使組織受到不可恢復的損傷甚至最終導致機體死亡。腫瘤抑制因子P53是一種能夠促凋亡的轉錄因子,同時也能抑制抗凋亡基因的轉錄,所以在凋亡發生中其起到重要作用[10]。但是過量的P53對細胞來說是有毒的,因此,細胞會形成一種負反饋機制監測P53發揮作用[11-12]。在這個負反饋調控中MDM2(murine double minutes 2)是一個主要的調控子[13],其N末端結構域和P53的N末端結構域特異性結合,一方面遮住了P53的N末端轉錄結構域直接阻止其轉錄活性[14],另一方面啟動P53泛素化導致其被蛋白酶體系統降解[15]。除此之外,MDM2包含核輸出信號,可以通過直接的相互作用誘導P53核輸出,從而抑制細胞凋亡[16-17]。由于MDM2既能受到P53的誘導也反過來能抑制P53的功能[12],因此,這種調控呈現出一種反饋回路的調控模式。此外,MDM2-P53反饋回路會受到核糖體生物發生過程的調控[18],如核糖體蛋白(ribosomal proteins,RPs)RPL11與MDM2結合抑制其泛素化連接酶的活性,從而激活P53[18-19]。
由于斑馬魚和羅非魚在同樣的低溫處理下,其鰓組織凋亡的信號出現的時間差異很大[3],那么這種差異是否與RPL11/MDM2/P53通路有關,為了研究這個問題,本試驗中將羅非魚和斑馬魚暴露在同一梯度低溫下,觀察羅非魚、斑馬魚在低溫下呈現出不同的運動能力和反應情況,通過Western blot和實時熒光定量PCR(Quantitative real time polymerase chain reaction,RT-qPCR)技術檢測RPL11/MDM2/P53通路中相關蛋白和基因表達量的變化,分析這些信號通路在不同低溫耐受能力的魚中呈現出的表達模式,旨在為不同魚類低溫耐受能力機制研究提供參考。
1 材料與方法
1.1 材料
野生型羅非魚親魚取自青島羅非魚良種場,野生型斑馬魚親魚取自中科院生物化學與細胞生物學研究所,均在水產種質資源發掘與利用教育部重點實驗室恒溫魚房內人工繁殖和飼養。試驗用羅非魚和斑馬魚發育到4個月時分別按雌雄比為1∶1的比例篩選試驗用魚,然后統一在28 ℃下條件下暫養2個月,最后取6月齡的魚用于試驗研究。
1.2 方法
1.2.1 低溫處理方法和樣品采集 按照Hu等[3]的降溫策略,待水溫降到8 ℃后,分別于0、3、6、9 h取斑馬魚和羅非魚的鰓組織存放于液氮中,用于組織蛋白提取和RNA樣品制備。然后取28 ℃下養殖的斑馬魚和羅非魚鰓組織作為對照樣品。在每個取樣時間點分別取3尾羅非魚和18尾斑馬魚,其中每3尾斑馬魚的鰓組織混合作為一個樣品提取蛋白,每個樣品設3個重復,另取9尾斑馬魚每3尾魚的鰓組織單獨作為一個樣品用來提取RNA。
1.2.2 鰓組織蛋白提取和RNA樣品收集 將斑馬魚鰓組織從液氮中取出,放置于冰上的錫箔紙上,待其將要融化時放到潔凈的提前加入RIPA裂解液(購自Sigma,使用前加入PMSF)的玻璃勻漿器中,于冰上輕輕勻速研磨組織直到組織裂解,然后將裂解液移至離心管中,放置于冰上繼續裂解。
羅非魚鰓組織取出后置于提前加入液氮的研缽中研磨至粉末狀,用藥匙將粉末分別轉移到提前加入RIPA裂解液和TRIZOL reagent(購自Thermo Fisher Scientific公司)的離心管中,放置于冰上繼續裂解15 min,直至組織完全裂解。待組織樣品充分裂解后,將其在4 ℃、12 000 r/min的條件下離心20 min,將上清液轉移到新的離心管中。對獲得的上清液蛋白進行BCA法蛋白濃度測定(試劑盒購自Thermo Fisher Scientific公司),根據測得濃度添加裂解液至所有樣品保持在同一濃度水平。然后根據獲得的蛋白體積按比例加入4×Protein SDS PAGE loading(購自TaKaRa),混勻后于95~100 ℃水中煮15 min,保存于-20 ℃冰箱中用于后續Western blot試驗。
1.2.3 蛋白Western blot試驗 按照常規方法配制12%(體積分數)SDS-PAGE 蛋白凝膠。將蛋白樣品加入蛋白膠孔中,給予合適的電壓使蛋白在凝膠上面分離,然后將蛋白轉移到PVDF膜上,用50 g/L脫脂牛奶封閉2 h,吸出封閉牛奶,直接加入20 g/L脫脂牛奶稀釋過的一抗(anti-β-actin抗體購自杭州華安生物有限公司,anti-P53抗體和anti-RPL11抗體購自Abcam公司)于4 ℃孵育過夜或者室溫孵育2 h,然后吸出一抗,加入1×TBST漂洗液(購自生工生物工程(上海)股份有限公司)洗滌3次,每次5 min。再加入二抗于室溫孵育2 h,回收二抗后加入1×TBST漂洗液洗滌3次,每次5 min。在洗好的膜中盡快加入ECL顯影液(購自Thermo Fisher Scientific公司)曝光拍照。
1.2.4 RNA提取和定量PCR試驗 將斑馬魚鰓組織從液氮中取出置于冰上面的錫箔紙上,待其將要融化時放到潔凈的提前加入TRIZOL reagent的玻璃勻漿器中,于冰上輕輕勻速研磨組織直到組織裂解,然后將裂解液移至離心管中,放置于冰上繼續裂解,直至組織完全裂解;待組織樣品充分裂解后,嚴格按照TRIZOL reagent的操作說明提取樣品中RNA,最后加入40 μL DEPC水(購自生工生物工程(上海)股份有限公司)溶解RNA;對得到的RNA樣品進行濃度測定并置于超低溫冰箱(-80 ℃)中凍存。對提取的RNA樣品進行去基因組的反轉錄試驗(去DNA反轉錄試劑盒購自TaKaRa公司)得到cDNAs。用在線IDT軟件設計qPCR引物,引物序列見表1和表2。用SYBR Green法對目的基因及內參基因表達量進行檢測。

表1 用于定量PCR的羅非魚引物Tab.1 Primers for tilapia qPCR
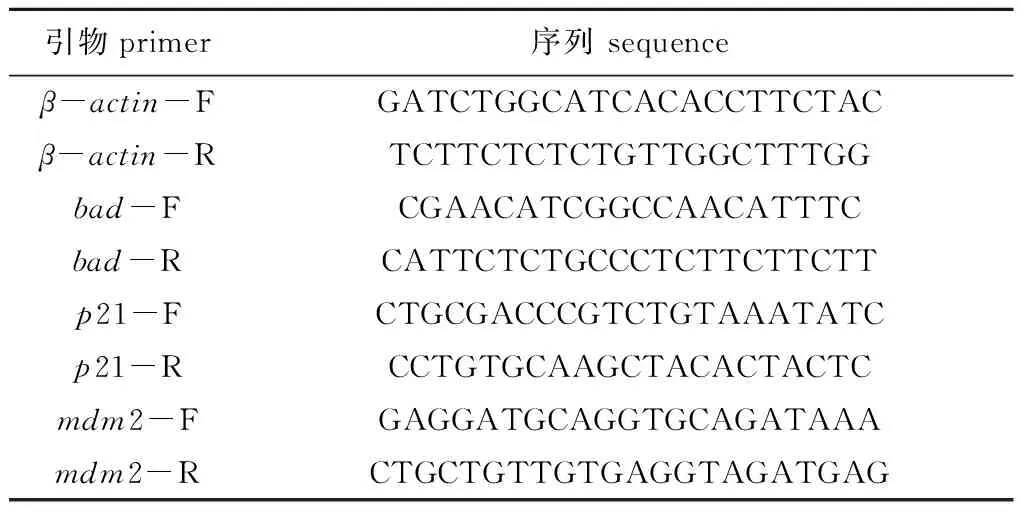
表2 用于定量PCR的斑馬魚引物Tab.2 Primers for zebrafish qPCR
1.3 數據處理
利用Image J軟件對Western blot試驗結果進行定量分析。試驗結果以平均值±標準差(mean ± S.D.)表示。用t檢驗對低溫各組與常溫下蛋白或基因表達進行差異顯著性分析。用SPSS 20軟件進行單因素方差分析(One-way ANOVA),用Turkey’s法進行組間多重比較,顯著性水平設為0.05。
2 結果與分析
2.1 羅非魚和斑馬魚對低溫脅迫的耐受差異
使用Hu等[3]的降溫步驟,將養殖魚類的水溫從28 ℃勻速降到18 ℃,這個過程耗時12 h;在18 ℃停留12 h后,繼續勻速降到8 ℃,這個降溫過程耗時12 h;然后在8 ℃低溫下再經歷9 h。在整個降溫過程中會停止投喂食物以免因水質破壞導致多重不可控制的應激發生。剛開始降溫時,在水溫到達8 ℃之前兩種魚都能保持身體平衡,但是運動能力出現不同程度的減弱,鰓的張合頻率稍稍變快。待水溫剛降到8 ℃后斑馬魚還能繼續保持身體的平衡,但是不喜運動,而羅非魚則慢慢出現失去平衡的狀態,直至到達6 h以后,斑馬魚逐漸開始出現失去平衡的現象。9 h后羅非魚的鰓不再張合,但是解剖發現其心臟還在跳動,故判斷此時羅非魚并沒有死亡;但是斑馬魚在9 h后鰓還能張合。以上的現象均說明,在緩慢降溫的策略下斑馬魚比羅非魚更耐低溫。
2.2 低溫對羅非魚和斑馬魚RPL11/MDM2/P53通路的影響
2.2.1 低溫對RPL11和P53蛋白表達水平的影響低溫下,兩種魚的RPL11和P53蛋白表達量見圖1。
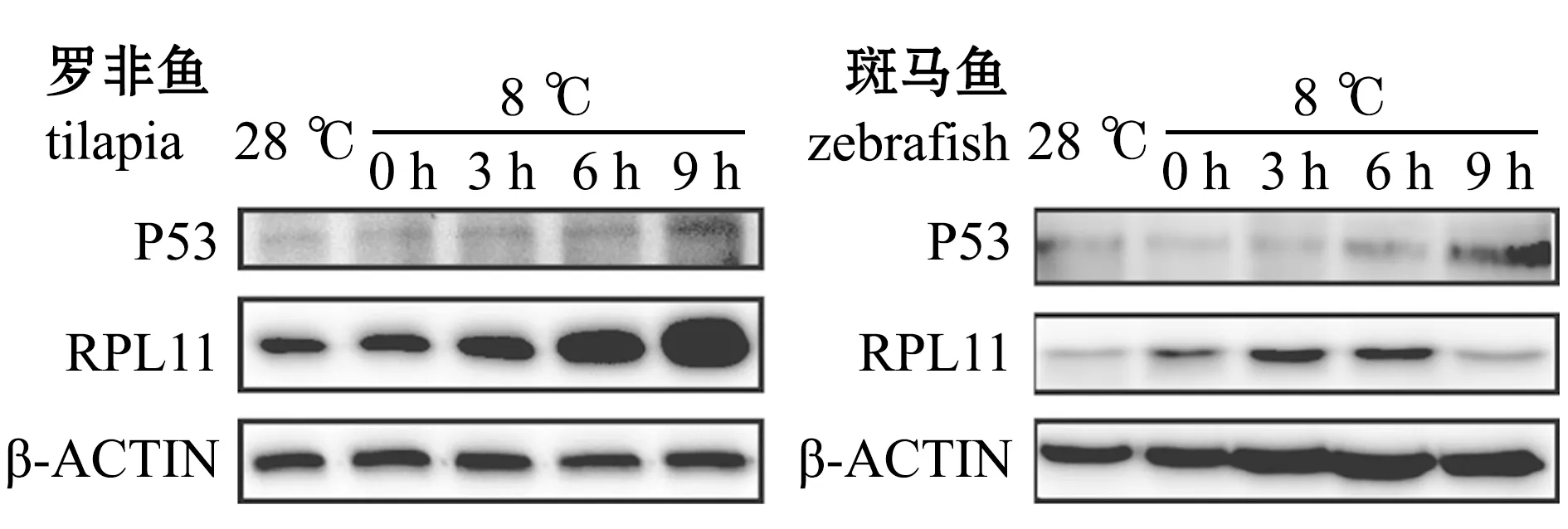
圖1 各個溫度和時間點P53和β-ACTIN的Western blot結果Fig.1 Western blot of P53 and β-ACTIN at different temperature and time
從圖2可見:羅非魚的P53和RPL11蛋白表達量隨著低溫處理時間的延長呈現升高的趨勢,特別是在0 h和3 h均出現了非常明顯的表達量增加,6 h后RPL11表達量趨于穩定,但是P53表達量持續累積,這可能是低溫壓力激活核糖體的壓力響應程序,誘導RPL11蛋白表達量升高,RPL11與MDM2結合抑制其泛素化連接酶的活性,導致P53累積引起凋亡;斑馬魚P53表達量在0 h和3 h幾乎沒有變化,直至6 h才出現明顯的升高,這與羅非魚鰓組織出現凋亡信號早于斑馬魚的現象[3]是一致的,但是RPL11表達量在0 h后表現出顯著下降趨勢,這與羅非魚中0 h后RPL11表達量顯著升高的現象相反。
這表明,在羅非魚體內核糖體生物發生進程可能是對低溫壓力進行響應,通過抑制P53被泛素化達到快速積累P53的目的,大量積累的P53誘導鰓組織的凋亡。與羅非魚相比較,斑馬魚P53表達量升高的時間點明顯更晚,并且此過程中也沒有伴隨著RPL11的表達量升高。
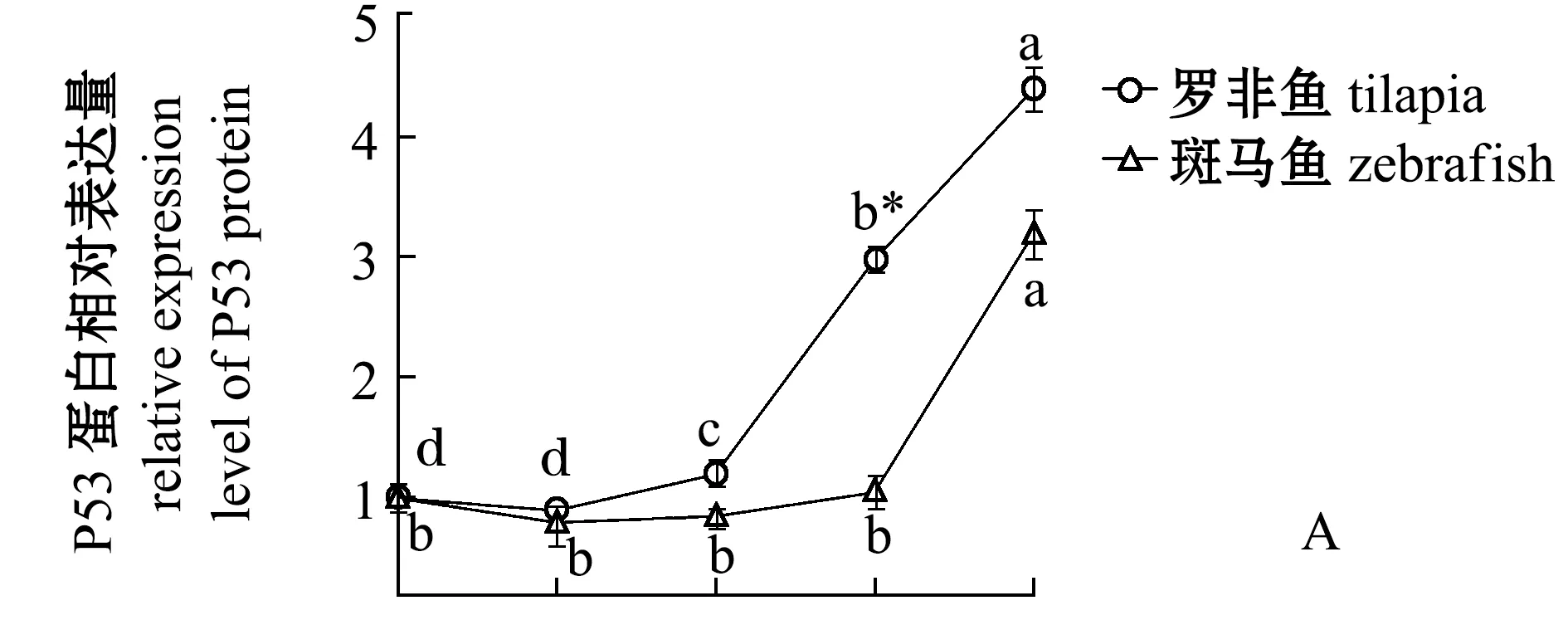
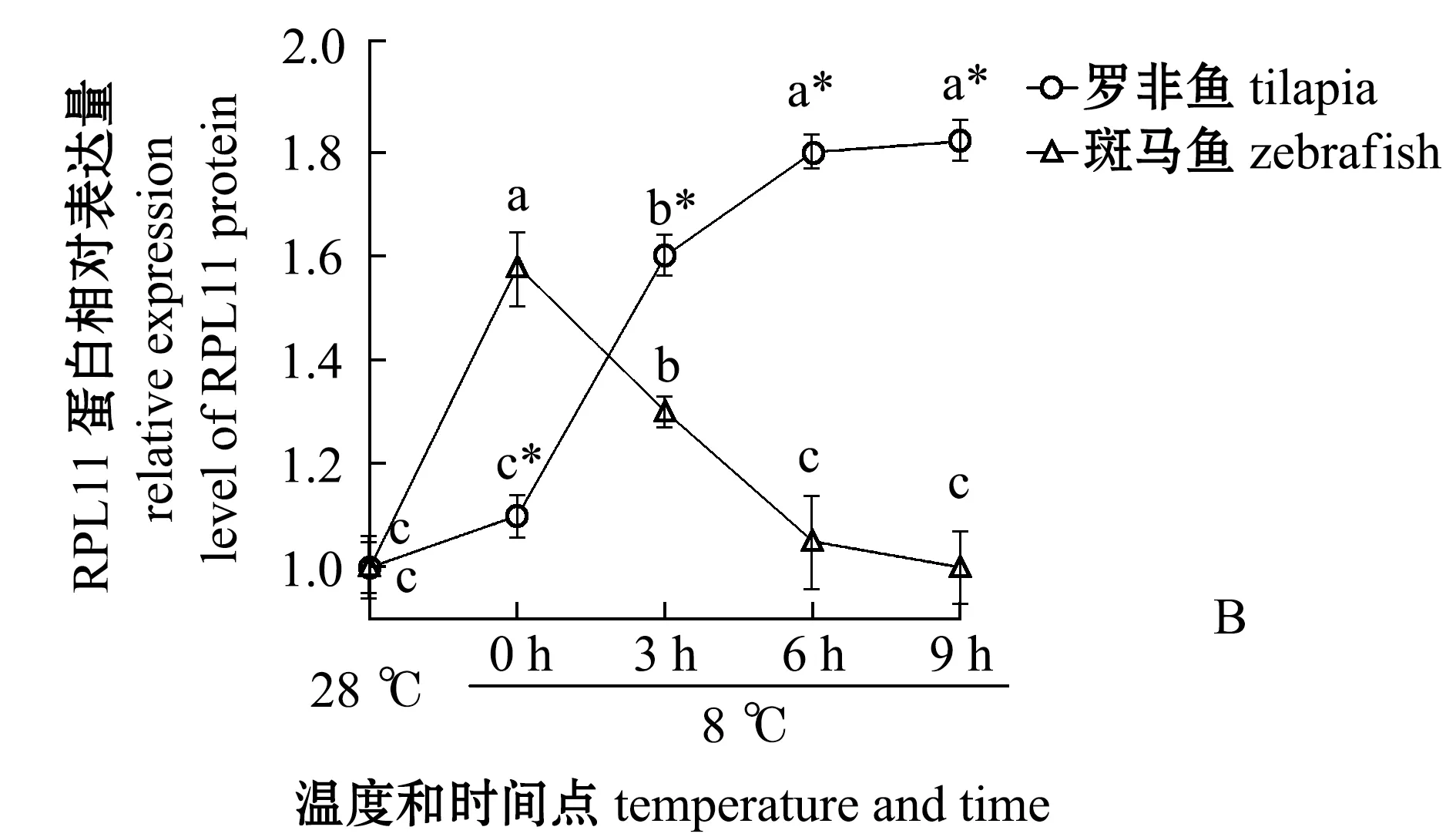
*表示同一時間下兩個基因組間有顯著性差異(P<0.05);標有不同字母者表示同一基因不同時間下有顯著性差異(P<0.05),標有相同字母者表示組間無顯著性差異(P>0.05),下同。Note: *means significant difference within two gene groups at same time (P<0.05);The means with different letters within the same gene are significantly different in the different time at the 0.05 probability level, and the means with the same letter within the same gene are not significant differences, et sequentia.圖2 在羅非魚和斑馬魚中各個溫度和時間點P53和RPL11蛋白水平的定量分析Fig.2 Quantitative analysis of P53 and RPL11 in tilapia and zebrafish at different temperature and time
2.2.2 低溫對羅非魚和斑馬魚RPL11/MDM2/P53通路中mdm2 mRNA表達水平的影響 為了確定P53表達量升高是由于MDM2-P53這條信號通路所起的作用,對mdm2轉錄水平表達量進行分析。從圖3可見:在羅非魚中,8 ℃、6 h 前mdm2表達量變化不大,并且處于低表達水平,此時有利于P53蛋白表達量的積累,6 h后mdm2表達量顯著升高(P<0.05),這可能是由于RPL11的表達量趨于穩定,并且P53大量積累誘導mdm2表達量升高導致的;在斑馬魚中,8 ℃、0 hmdm2表達量出現升高的變化,這不利于P53的積累,直到 8 ℃、6 h后mdm2表達量開始下降,P53開始大量積累。
2.3 低溫對羅非魚和斑馬魚RPL11/MDM2/P53通路中P53下游靶基因表達量的影響
為了研究P53凋亡活性的分子機制,對羅非魚和斑馬魚各個時間點的鰓組織中P53下游靶基因bad和p21在mRNA水平上的表達變化進行分析。bad屬于Bcl2家族的基因[20],具有促進細胞凋亡的作用。從圖4可見,羅非魚在6 h后bad和p21兩個基因都表現出明顯的轉錄上調,這暗示低溫下這兩個基因可能被激活的P53上調。
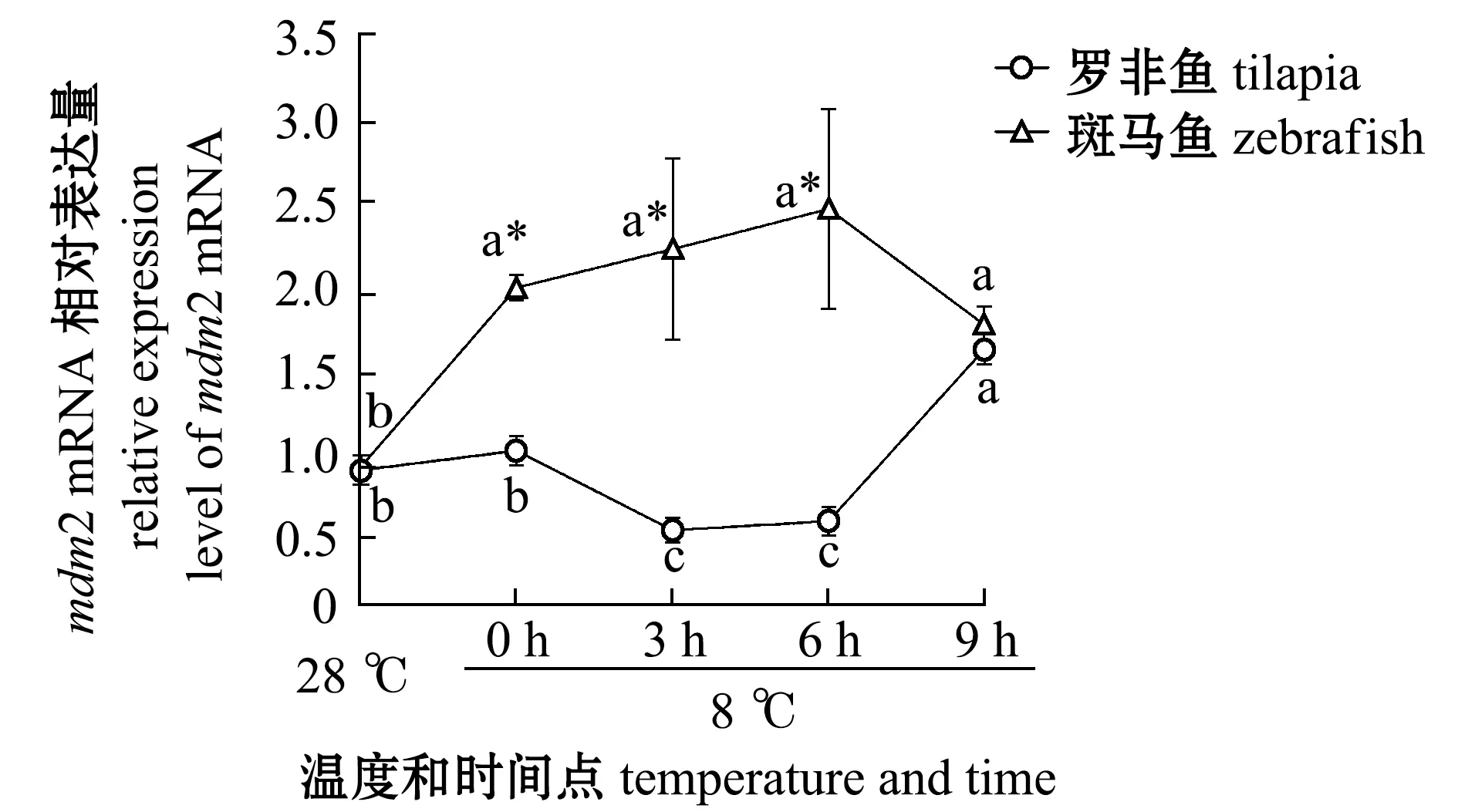
圖3 兩種魚在不同溫度和時間點的mdm2轉錄水平定量PCRFig.3 qPCR of mdm2 transcript levels relative to β-actin in the two fish species at different temperature and time
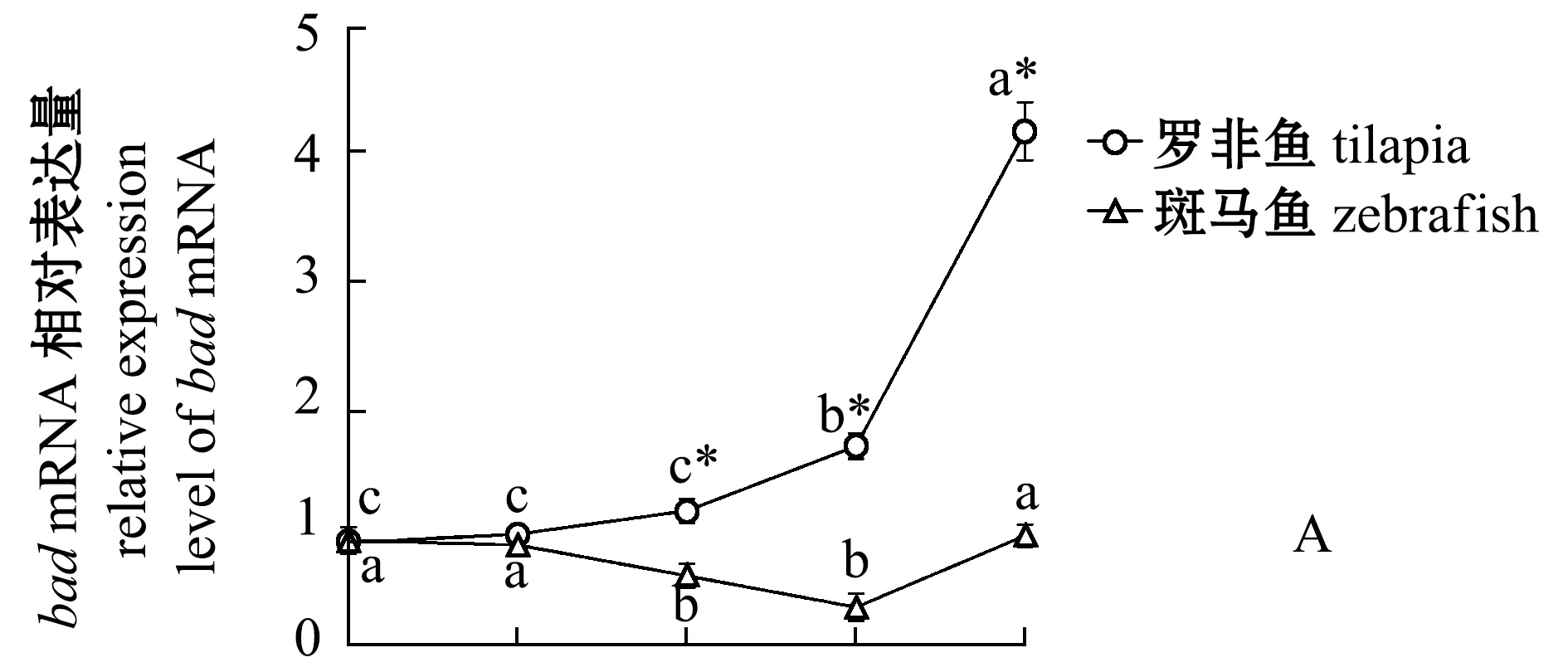

圖4 兩種魚在不同溫度和時間點的bad 和 p21轉錄水平定量PCRFig.4 qPCR of bad and p21 transcript levels in the two fish species at different temperature and time
3 討論
3.1 低溫下細胞內P53積累導致其發生凋亡
魚鰓組織最先與外部環境溫度波動有直接的接觸,因此,可能是魚類低溫耐受的薄弱環節。有研究表明,對低溫下斑馬魚和羅非魚的各個組織進行凋亡信號檢測,發現羅非魚鰓組織在8 ℃、6 h時是最早出現凋亡的,而同一時間點下斑馬魚并未出現凋亡[3]。本試驗中通過蛋白定量分析發現,在羅非魚鰓組織中試驗3 h后P53蛋白表達量持續性顯著升高,但是斑馬魚鰓組織中在6 h時才開始積累P53蛋白(圖2)。因此,羅非魚比斑馬魚更早出現凋亡信號的原因可能與P53的積累有關。
3.2 MDM2與RPL11相互作用誘導P53積累
有研究表明,核糖體蛋白(ribosomal proteins,RPs),如 RPL5[21]、RPL11[22]和RPL23[23]能夠通過與MDM2結合阻止其對P53的降解和泛素化,從而實現P53的積累。還有研究表明,敲降RPS6能誘導RPL11激活P53[21],敲降RPL29或RPL30能提高MDM2與RPL11的相互作用,從而誘導P53[22]。本試驗結果顯示,羅非魚試驗中8 ℃、0 h時RPL11蛋白表達量開始出現升高,而mdm2的轉錄水平維持在較低水平(圖3),導致P53表達量到3 h出現顯著升高,P53表達量的不斷升高最終導致6 h時出現凋亡信號[3]。雖然在8 ℃、6 h后斑馬魚鰓中P53的表達量有一定的升高,但是在8 ℃、9 h前在斑馬魚鰓中并未檢測到凋亡信號[3],這可能是由于其體內P53的表達水平和羅非魚相比還是較低的,并且P53下游靶基因的表達也未升高。這表明,在斑馬魚體內低溫誘導RPL11/MDM2/P53信號發生的時間比羅非魚晚或者是斑馬魚響應低溫的途徑和羅非魚是不同的,這種差異化的表達模式對研究魚類在響應低溫脅迫時所產生差異的分子機制提供了研究思路。
通過比較分析這兩種魚RPL11/MDM2/P53通路中各組分的表達情況發現,參與到該通路的基因和蛋白的表達量在兩種魚體內表達模式有所差異。根據本試驗結果及Hu等[3]的研究,作者推測羅非魚中低溫誘導RPL11高表達,通過RPL11/MDM2的調控導致P53快速并且大量積累,激活P53下游凋亡相關基因表達,最終導致凋亡信號大量積累并造成鰓組織不可逆的損傷(圖5A);但是在斑馬魚中低溫誘導下RPL11表達量反而降低,導致P53表達量緩慢升高,最終出現凋亡的時間較羅非魚晚(圖5B),這可能是其較羅非魚更耐低溫的原因之一。因此,鰓組織凋亡信號的時間及強度可以作為低溫下組織受損程度的指示劑。并且低溫能誘導羅非魚中與凋亡相關的RPL11/MDM2/P53通路中相關蛋白的變化,并且這種表達變化模式和耐低溫能力較強的斑馬魚是不同的,這些不同物種差異性的基因表達模式可能是羅非魚和斑馬魚低溫耐受能力差異的原因之一,但是其確切的分子機制有待進一步研究。
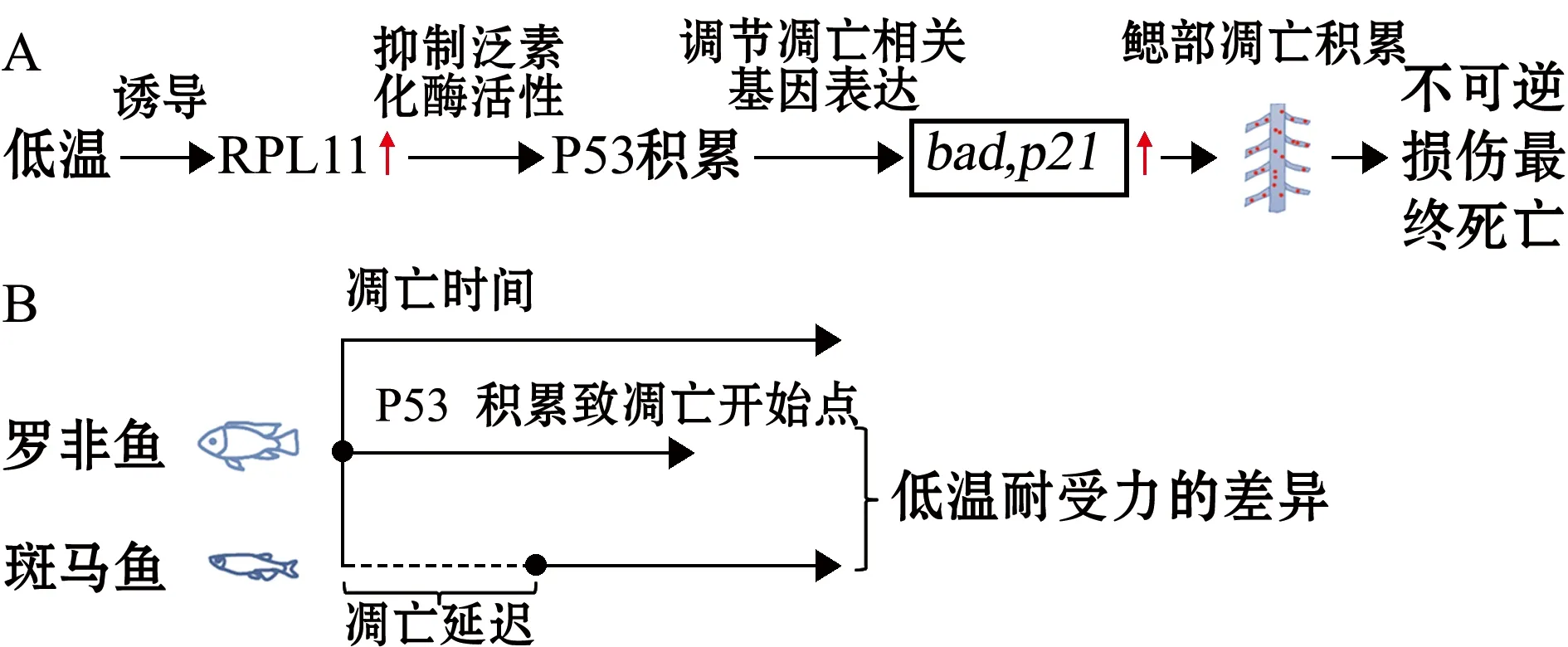
圖5 低溫下RPL11/MDM2/P53信號通路參與細胞凋亡調控模式Fig.5 Pattern diagrams of RPL11/MDM2/P53 pathway involved in cell apoptosis under cold stress
4 結論
1) 與斑馬魚相比較,羅非魚積累P53的過程較快,并且此過程中伴隨著PRL11表達量的升高,而斑馬魚則相反。
2) 在羅非魚中,8 ℃、6 h前mdm2處于低表達水平,此時有利于P53蛋白表達量積累,6 h后mdm2表達量出現顯著升高,可能是P53大量積累導致的;在斑馬魚中,8 ℃、0 h時mdm2表達量出現升高的變化,這不利于P53積累,8 ℃、6 h后mdm2表達量開始下降,P53開始大量積累。
3) 本試驗中發現,參與到該通路的基因和蛋白的表達量在兩種魚體內表達模式有所差異,這可能是導致其耐寒能力差異的原因之一。

