附子理中湯對非酒精性脂肪肝細胞模型脂肪沉積的影響與相關機制研究?
楊家耀,易宏鋒,廖 艷,舒 磊,杜念龍,陳 露,黎晨玉,安 柳,鄒 琦,時昭紅△
(1. 武漢市第一醫院消化內科,武漢 430022; 2. 湖北中醫藥大學, 武漢 430065)
隨著人們生活水平的提高,飲食的不規律性,以肝內脂肪過度沉積為主要臨床特征的非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)已成為一種發病率較高的疾病,對人們的健康產生極大威脅[1-3]。近些年,中醫因整體思維及辨證論治優勢,在NAFLD的理論、臨床及實驗研究中均取得了大量的成績。中醫療法治療NAFLD主要有單味藥及其有效成分、中藥復方、針灸及推拿等[4]。其中通過臨床研究表明,一些中藥復方對治療NAFLD療效較為顯著[5-6]。過往中藥復方治療NAFLD的研究主要集中于臨床及動物水平,而細胞水平的研究還相對較少。本課題前期成果已證明,3種湯藥中附子理中湯對NAFLD的作用效果最佳,但尚未深入探究其具體作用機制[7]。本研究在前期研究的基礎上,擬通過細胞水平實驗揭示附子理中湯對NAFLD的作用機制,為臨床治療奠定基礎。
1 材料與方法
1.1 實驗材料
細胞來源及培養:正常人肝細胞株HL-7702購自中國科學院細胞庫(貨號GNHu6)。細胞經復蘇后,培養于含10% FBS、100 U/ml PNC以及100 mg/ml鏈霉素的DMEM中。細胞在常規條件下培養至80%融合,洗滌、收集細胞繼續培養用于后續造模實驗。
1.2 主要藥物及試劑
中/長鏈脂肪乳注射液(貨號C6-24)購自華瑞制藥有限公司;附子理中湯出自《三因極一病證方論》卷二中寒治法,按傳統方法制備煎煮液濃縮后備用(所有藥物在使用時均采用無血清培養基稀釋至指定濃度);Human INF-α ELISA Kit(貨號HM10251)、Human INF-β ELISA Kit(貨號HM10099)和Human IL-10 ELISA Kit(貨號HM10203)購自武漢貝茵萊生物科技有限公司;兔一抗Toll樣受體4(TLR4;貨號ab13867;稀釋比:1∶1000)、兔一抗腫瘤壞死因子受體相關因子3(TRAF3;貨號ab36988;稀釋比:1∶1000)、兔一抗TRIF相關的接頭分子(TRAM;貨號ab96106;稀釋比:1∶1000)、兔一抗干擾素調節因子3(IRF3;貨號ab25950;稀釋比:1∶1000)、兔一抗磷酸甘油醛脫氫酶(GAPDH;貨號ab9485;稀釋比:1∶2500)及辣根過氧化物酶(HRP)標記的二抗(貨號ab97051;稀釋比:1∶5000)均購自英國Abcam公司。
1.3 實驗方法
1.3.1 非酒精性脂肪肝細胞模型構建及藥物處理 本研究采用1 ml/l的脂肪乳劑加入正常DMEM培養肝細胞建立NAFLD模型[8]。取對數生長期的HL-7702細胞,以104/孔接種培養于12孔板,設置正常培養基為對照組;含1 ml/l的脂肪乳劑的培養基為模型組;采用培養基稀釋的高(1.5 g/ml)、中(1 g/ml)、低(0.5 g/ml)附子理中湯及易善復(5 μmol/l)預先處理細胞1 h,后不經洗滌直接加1 ml/l脂肪乳劑繼續培養細胞制造非酒精性脂肪肝細胞模型。每組按培養時間不同,每間隔12 h細分一小組,共12 h、24 h、36 h和48 h 4個小組,每小組設置3重復。
1.3.2 MTT法檢測細胞活力 MTT法檢測細胞活力,嚴格按照相關試劑盒進行操作處理樣本,最后在酶標儀上測量吸光度(OD)并記錄。
1.3.3 油紅O染色 分別于上述分組對應時間點取各組細胞少許,棄盡細胞培養基,PBS清洗一遍;10%甲醛固定10 min,同時將油紅O染液置于60~65 ℃恒溫箱中預熱;用PBS漂洗細胞2次,加入預熱后的油紅O染液,并置于60~65 ℃恒溫箱中反應15 min;80%丙二醇分化2~5 min,在顯微鏡下觀察至背景接近無色位置;用PBS漂洗細胞3次,鏡檢、拍照并記錄。單獨收集48 h的各組細胞約1.0×104個,PBS洗凈細胞表面油紅O;每組加200 μL異丙醇抽提細胞內的油紅O,離心收集上清液,然后在510 nm波長下測定OD值,每組OD值代表該組細胞積累的脂肪定量值并統計分析。
1.3.4 生化檢測及炎癥因子水平檢測 細胞培養48 h后分別收集各組細胞的培養上清液分成兩份,一份經全自動生化分析儀檢測丙氨酸氨基轉移酶(alanine transaminase,ALT)、天冬氨酸氨基轉移酶(aspartate transaminase,AST)及甘油三酯(triglyceride,TG)含量,同時檢測胎牛血清中上述3指標水平,排除培養基血清中各指標潛在含量對本實驗數據的干擾;另一份根據ELISA試劑盒說明書操作分別檢測干擾素-α(Interferon alpha,INF-α)、干擾素-β(Interferon beta,INF-β)和白介素-10(Interleukin-10,IL-10)的分泌水平。
1.3.5 Annexin V-FITC/PI雙染檢測各組細胞凋亡水平 取培養48 h的各組細胞,后根據Annexin V-FITC/PI雙染試劑盒操作檢測各組細胞凋亡率,總凋亡率為第二象限與第四象限細胞占比之和。
1.3.6 qRT-PCR檢測各組細胞中TLR4、TRAM、TRAF3及IRF3的表達水平 根據NCBI公布的人TLR4、TRAM、TRAF3、IRF3及內參基因GAPDH序列分別設計qRT-PCR用引物:TLR4 F/R:5'-ACCTGTCCCTGAACCCT-3',5'-CTCCCAGAACCAAACGA-3';TRAM F/R:5'-TGTGGCAGACAGCATT-3',5'-TGTGGCAGACAGCATT-3';TRAF3 F/R:5'-AGGGTCTACCTGAACGG-3',5'-GGGTCGGGCTTGAATG-3';IRF3 F/R:5'-CAAGAGGCTCGTGATGG-3',5'-TGTACTGGTCGGAGGTGA-3'及GAPDH F/R:5'-CCACTCCTCCACCTTTG-3',5'-CACCACCCTGTTGCTGT-3',上述引物由上海生工合成。qRT-PCR采用常規方法進行,選取GAPDH為內參基因,采用2-△△CT算法計算基因的相對表達量。
1.3.7 Western blot檢測TLR4、TRAM、TRAF3及IRF3蛋白表達量 Western blot實驗具體操作步驟參考本課題組前期發表文獻[9]。選取GAPDH為內參蛋白,后采用Quantity One圖像分析軟件進行半定量分析。
1.4 統計學方法
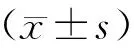
2 結果
2.1 附子理中湯促進NAFLD模型細胞增殖活性
圖1示,與同組12 h比較,對照組細胞24 h、36 h及48 h OD值均顯著增加(P<0.01),模型組細胞僅48 h OD值顯著增加(P<0.01);高劑量FZLZD組及YSF組細胞24 h、36 h及48 h OD值均顯著增加(P<0.01),中、低劑量FZLZD組細胞36 h及48 h OD值均顯著增加(P<0.05,P<0.01)。與同時間點對照組比較,模型組細胞OD值均顯著降低(P<0.01),與同時間點模型組比較,各治療組細胞OD值均呈不同程度顯著增加(P<0.05,P<0.01),其中以高劑量FZLZD組及YSF組細胞OD值變化最明顯。

注:FZLZD:附子理中湯;YSF:易善復;與同組12 h比較:*P<0.05,**P<0.01;與同時間點對照組比較:##P<0.01;&&P<0.01圖1 不同時間點各組細胞OD值變化
2.2 附子理中湯抑制NAFLD模型細胞與脂肪沉積
圖2示,對照組細胞邊緣清晰,多為多角形或梭形,呈鋪路石樣排列,細胞間結合緊密、間隙小、細胞核大且胞內極少見紅色脂滴;而模型組細胞內出現明顯紅色脂滴,部分細胞內脂滴成環狀位于細胞膜內側且將細胞核擠向一側,細胞多呈圓形,細胞間結合較松散,且隨著時間推移松散程度進一步加大,脂滴更大更集中;而各藥物干預組細胞內脂滴積累情況呈現不同程度的緩解,且隨時間推移,脂滴含量逐漸減少且細胞結合趨于緊密,其中尤以高劑量附子理中湯和易善復組細胞變化最為顯著。
2.3 附子理中湯降低NAFLD模型細胞ALT、AST及TG釋放量
表1示,各組細胞培養上清液的生化檢測結果顯示,與對照組比較,胎牛血清中ALT、AST及TG含量差異顯著(P<0.01),提示ALT、AST及TG的來源主要為細胞代謝,而非培養基血清本底。同時與對照組比較,模型組細胞上清液中ALT、AST及TG含量均顯著升高(P<0.01);與模型組比較,附子理中湯呈一定劑量依賴性地降低ALT、AST及TG含量(P<0.01),其中以高劑量附子理中湯及易善復組變化最為顯著。
2.4 附子理中湯提高NAFLD模型細胞INF-α、INF-β和IL-10分泌水平
表2示,與對照組比較,模型組細胞上清液中INF-α、INF-β和IL-10的分泌水平均顯著降低(P<0.01);與模型組比較,附子理中湯呈一定劑量依賴性地提升INF-α、INF-β和IL-10的分泌水平(P<0.01),其中以高劑量附子理中湯及易善復組變化最為顯著。
2.5 附子理中湯降低NAFLD模型細胞凋亡率
圖3示,與對照組比較,模型組細胞的總凋亡率顯著增加(P<0.01);與模型組比較,附子理中湯呈一定劑量依賴性地降低細胞的凋亡水平(P<0.01),其中以高劑量附子理中湯及易善復組變化最為顯著。
2.6 附子理中湯調控NAFLD模型細胞TLR4/TRAM/TRAF3信號通路
圖3示,TLR4/TRAM/TRAF3信號通路關鍵靶標mRNA及蛋白表達水平檢測結果顯示,相較于對照組,模型組細胞TLR4在mRNA水平表達顯著增加(P<0.01),而TRAM、TRAF3及IRF3表達水平顯著降低(P<0.01);與模型組比較,除低劑量附子理中湯組外,其余各治療組細胞TLR4表達水平顯著降低(P<0.01),而TRAM、TRAF3及IRF3表達水平顯著升高(P<0.01),其中以高劑量附子理中湯及易善復組變化最為顯著。在蛋白水平與對照組比較,模型組細胞TLR4蛋白水平顯著增加(P<0.01),提示TLR4被激活,而TRAM、TRAF3及IRF3蛋白水平顯著降低(P<0.01);與模型組比較,各治療組細胞TLR4蛋白水平顯著降低(P<0.01),而TRAM、TRAF3及IRF3蛋白水平顯著升高(P<0.05,P<0.01),其中以高劑量附子理中湯及易善復組變化最為顯著。
3 討論
近年來,“二次打擊”學說作為NAFLD的經典發病機制已被廣泛接受。脂類在肝臟細胞的細胞質內過度聚集(一次打擊)會觸發一系列細胞毒性反應(二次打擊),導致肝臟炎癥反應[10]。NAFLD發病相對隱匿,且發病過程中的每個程序都不是獨立的,他們彼此間互為因果、交互影響;而中醫藥講究辨證論治,即綜合分析各相關因素遣方用藥,這更符合NAFLD的病因病機[11]。研究組前期細胞水平實驗已證明,附子理中湯能有效促進NAFLD細胞的增殖并抑制其凋亡,但附子理中湯與調控脂質積累誘發的過度炎癥反應是否有關尚不清楚。

注:A.不同時間點各組細胞油紅O染色結果(×200);B.48 h各組細胞內脂肪積累定量結果;箭頭所示為典型的脂肪積累位置;FZLZD:附子理中湯;YSF:易善復;對照組比較:**P<0.01;模型組比較:#P<0.05,##P<0.01圖2 不同時間點各組細胞油紅O染色及48 h脂肪積累定量比較

表1 各組細胞培養上清液中ALT、AST及TG含量比較

表2 各組細胞培養上清液中INF-α、INF-β和IL-10分泌水平比較

注:A.流式檢測細胞凋亡,總凋亡細胞占比為二象限和四象限細胞占比之和;B.總凋亡率統計;FZLZD:附子理中湯;YSF:易善復;與對照組比較:**P<0.01;與模型組比較:##P<0.01圖3 各組細胞凋亡水平檢測

注:A.mRNA水平表達定量;B.SDS-PAGE電泳;C.蛋白水平表達定量;FZLZD.附子理中湯;YSF:易善復;與對照組比較:**P<0.01;與模型組比較:#P<0.05,##P<0.01圖4 各組細胞TLR4/TRAM/TRAF3信號通路關鍵靶標表達水平檢測
中醫學認為NAFLD的治療應以溫陽化氣為主,恢復其脾胃功能[12]。本研究所擬附子理中湯主要成分干姜與炮附子分別具有溫運健脾、回陽救逆的功效;且實驗結果顯示,其能呈濃度依賴性地促進NAFLD模型細胞的增殖活性,抑制NAFLD模型細胞的凋亡,降低脂肪沉積能力,有效降低肝細胞因脂質積累過多而釋放的ALT、AST及TG水平。此外,本方還含有中藥人參,其主要成分人參皂苷被證明通過抗氧化發揮保肝護肝作用[13]。本方中的白術在治療NAFLD上早有臨床報道。王峰發現,采用參苓白術散加味治療NAFLD療效顯著,且有效改善患者血脂情況[14];而孟勝喜等采用含白術多糖的復方對高脂飲食誘導大鼠NAFLD進行治療,發現其主要通過抑制肝臟脂肪合成發揮保肝作用[15]。實際臨床譚茂卿等從“治未病”思路出發,證明附子理中湯近期可降低血脂和轉氨酶,改善臨床癥狀,遠期可調節人體代謝功能改變體質[16]。
本研究同時發現,附子理中湯還能通過抑制TLR4表達,活化TRAM/TRAF3通路,上調抗炎因子INF-α、INF-β和IL-10分泌水平。TLR4是Toll樣受體家族(TLRs)中發現最早且研究最清楚的一員,其廣泛存在于多種免疫細胞的表面[17]。TLR4與配體結合后主要通過活化髓樣分化因子88(MyD88)依賴性和非依賴性信號途徑,激活一系列的炎癥和免疫反應[18]。其中TLR4介導的MyD88依賴性信號通路已被證明為多種中藥治療NAFLD的有效靶點,但TLR4介導的MyD88非依賴性信號通路與NAFLD的相關性研究還十分少見[19]。TLR4介導的MyD88非依賴性信號傳導途徑的主要接頭蛋白為TRAM和TRIF,TLR4通過招募TRAM/TRIF,激活另一些蛋白酸磷化激酶(如TBK1、IKKs/IKKi),導致轉錄因子干擾素調節因子3(IRF3)激活并入核,以誘導IFN-α、IFN-β的轉錄最終引起免疫反應[20]。在Th1活化的研究中發現,TLR信號通路中TRAF6上調可促進Th1活化,而TRAF3上調則引起相反的作用,TLR4介導的MyD88/TRAF6途徑以及MyD88非依賴途徑(TRIF依賴性途徑)在調節免疫細胞活化中存在一定的拮抗作用[21]。而我們發現,附子理中湯呈劑量依賴性地抑制TLR4表達,且激活TRAM/TRAF3信號通路,進而觸發INF-α、INF-β和IL-10等抗炎因子的表達,在炎癥反應后期發揮炎癥損傷修復作用。由此可見,TLR4介導的TRAM/TRAF3信號通路在NAFLD的發生中扮演著不可或缺的角色,TLR4/TRAM/TRAF3信號通路可作為附子理中湯的有效作用靶點。
綜上所述,本研究揭示中藥附子理中湯能顯著降低NAFLD模型細胞脂肪沉積能力,緩解炎癥反應,這可能與附子理中湯對TLR4/TRAM/TRAF3信號通路的有效調節密切相關。后期我們將從動物水平及臨床試驗出發,進一步驗證附子理中湯治療NAFLD的有效性及其他潛在機制,為NAFLD的治療提供更多可靠的思路。

