細胞外組蛋白通過促進凋亡參與新生大鼠缺氧缺血性腦病損傷過程
朱融和,孫媛媛,王凱,王楸
溫州醫科大學附屬第一醫院 兒科,浙江 溫州 325015
新生兒缺氧缺血性腦病(hypoxic-ischemic encephalopathy,HIE)是由于各種圍生期因素引起的腦缺氧或缺血而形成的常見腦損傷,是兒童神經系統損傷引起的新生兒期的重要疾病之一,探索HIE的發病機制是尋求該病有效治療方案的根本途徑[1]。炎癥反應和細胞凋亡在HIE發病過程中起重要的作用,細胞死亡可釋放出細胞外組蛋白[2]。在體外研究中,細胞外組蛋白可損傷內皮細胞[3]、刺激細胞因子的釋放[4],并能誘導嗜中性粒細胞細胞外誘捕網的形成和髓過氧化物酶的釋放。因此,若能將細胞外組蛋白阻斷,中和或降解其細胞毒性作用,對減少HIE的發生具有重要的臨床意義。本研究通過建立7日齡新生SD大鼠缺氧缺血性腦損傷(hypoxic-ischemic brain damage,HIBD)模型,外源性給予抗組蛋白中和抗體,觀察其對HIBD是否有保護作用,并且研究細胞外組蛋白是否通過凋亡途徑參與HIBD的發生與進展。
1 材料和方法
1.1 材料
1.1.1 實驗動物及分組:7日齡新生SD大鼠54只,體質量12~15 g,雌雄不限,由溫州醫科大學實驗動物中心提供,動物許可證號:SYXK(浙)2015-0009。利用隨機數余數分組法將其分成3組,分別 為:假手術組、HIBD組和治療組,每組18只。造模后各組又隨機分為3個亞組:6 h組、24 h組和72 h組。每個亞組6只。
1.1.2 主要試劑:8%氧氮混合氣體購自廣州氣體廠;檢測細胞外組蛋白ELISA試劑盒(Cell Death Detection Kit)購自德國Roche公司;特異性組蛋白H4中和抗體購自南京金斯瑞生物科技有限公司;兔抗鼠anti-cleaved casepase-3 抗體,antiβ-actin抗體及山羊抗兔二抗購自美國Abcam公司,TUNEL染色試劑盒、尼氏(Nissl)染色液及Western blot相關試劑均購自南通碧云天生物技術研究所,其他試劑為國產分析純。
1.2 方法
1.2.1 動物模型制備:缺氧缺血動物模型參考文 獻[5]。7日齡新生SD大鼠游離并結扎左側頸總動脈,術后2 h后置于37 ℃恒溫水浴的缺氧艙,以2 L/min 的速度輸入8%氧氣和92%氮氣的混合氣體,2 h后 取出并返回母鼠身邊繼續喂養。假手術組僅分離左側頸總動脈,不做結扎和缺氧處理。治療組在造模前5 min尾靜脈注射特異性組蛋白H4中和抗體 20 mg/kg,假手術組和HIBD組尾靜脈注射等量0.9%氯化鈉溶液。
1.2.2 ELISA法檢測血漿細胞外組蛋白水平:各組動物在造模后6 h、24 h和72 h,采取心臟采血法。收集血液標本,3 000 r/min離心10 min分離血清,ELISA法檢測血清中組蛋白水平,具體操作步驟嚴格按照試劑盒說明書進行。
1.2.3 HE染色:取各組造模后24 h及72 h亞組的左側腦組織標本(n=3/亞組)以4%多聚甲醛固定,常規脫水、石蠟包埋,連續切片,厚度5 μm,行HE染色,光學顯微鏡下觀察腦組織病理變化。
1.2.4 腦含水量檢測:取各組造模后24 h亞組的完整腦組織(n=3/亞組),沿大腦中線將左右側大腦分開并稱量濕重。然后,在105 ℃恒溫箱中干燥48 h 并稱量干重。根據公式計算腦含水量:腦含水量= (濕重-干重)/濕重×100%。
1.2.5 尼氏染色:腦組織石蠟切片脫蠟、水化、 0.5%甲基紫避光染色20 min,PBS漂洗后分化6 s、無水乙醇脫水,二甲苯透明、封片觀察,利用Imagepro plus6.0 圖像分析軟件分析結果,計算公式:腦組織損失率=(右側正常腦組織面積-左側剩余正常腦組織面積)/右側正常組織面積×100%。
1.2.6 組織蛋白提取及Western blot分析:分離造模72 h后的左側大腦皮層(n=3/組),加入組織裂解液,組織勻漿機勻漿后低溫下12 000 r/min離心10 min,取上清液,測定蛋白濃度并稀釋到相同濃度,按比例加入5×上樣緩沖液,100 ℃金屬浴5 min。取30 μg蛋白進行凝膠電泳,PVDF膜轉膜,5%脫脂奶粉封閉30 min,抗cleaved casepase-3、β-actin抗體4 ℃孵育過夜,二抗室溫孵育2 h,ECL發光暗室顯影后對膠片進行拍攝,利用ImageJ軟件進行灰度值分析。
1.2.7 TUNEL染色:石蠟切片脫蠟至水,用蛋白酶K工作液處理15 min,PBS漂洗3次,滴加TUNEL反應液避光孵育60 min,PBS漂洗3次后加DAPI染色 5 min,再用PBS漂洗3次,顯微鏡拍照。
1.3 統計學處理方法 采用SPSS23.0軟件進行統計學分析。計量資料用±s表示,多組間比較采用單因素方差分析,組內兩兩比較采用LSD檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 腦組織肉眼大體觀察及腦含水量測定 造模后24 h的大體觀察,與假手術組相比,HIBD組左側腦組織有明顯水腫;治療組與HIBD組相比,左側腦組織水腫程度明顯輕(見圖1A)。HIBD組腦含水量比假手術組高(P<0.05),治療組較HIBD組含水量低 (P<0.05),見圖1B。
2.2 腦組織HE染色觀察 假手術組在6 h、24 h和72 h腦組織結構層次均清晰,細胞輪廓正常,細胞核界限清晰,核仁明顯,尼氏體均勻分布在核周圍。HIBD組造模24 h后左側腦細胞大片壞死,神經元細胞及膠質細胞可見核固縮、核碎裂;72 h后左側腦組織在大片壞死的背景下,神經元細胞及膠質細胞數量明顯減少,嗜神經細胞現象明顯(黑色箭頭),可見大量的核固縮、核碎片。治療組造模24 h后可見左側腦細胞輕度水腫,較HIBD組明顯好轉;72 h后可見少數嗜神經細胞現象(黑色箭頭)。見圖2。

圖1 腦組織大體形態學觀察及腦含水量測定
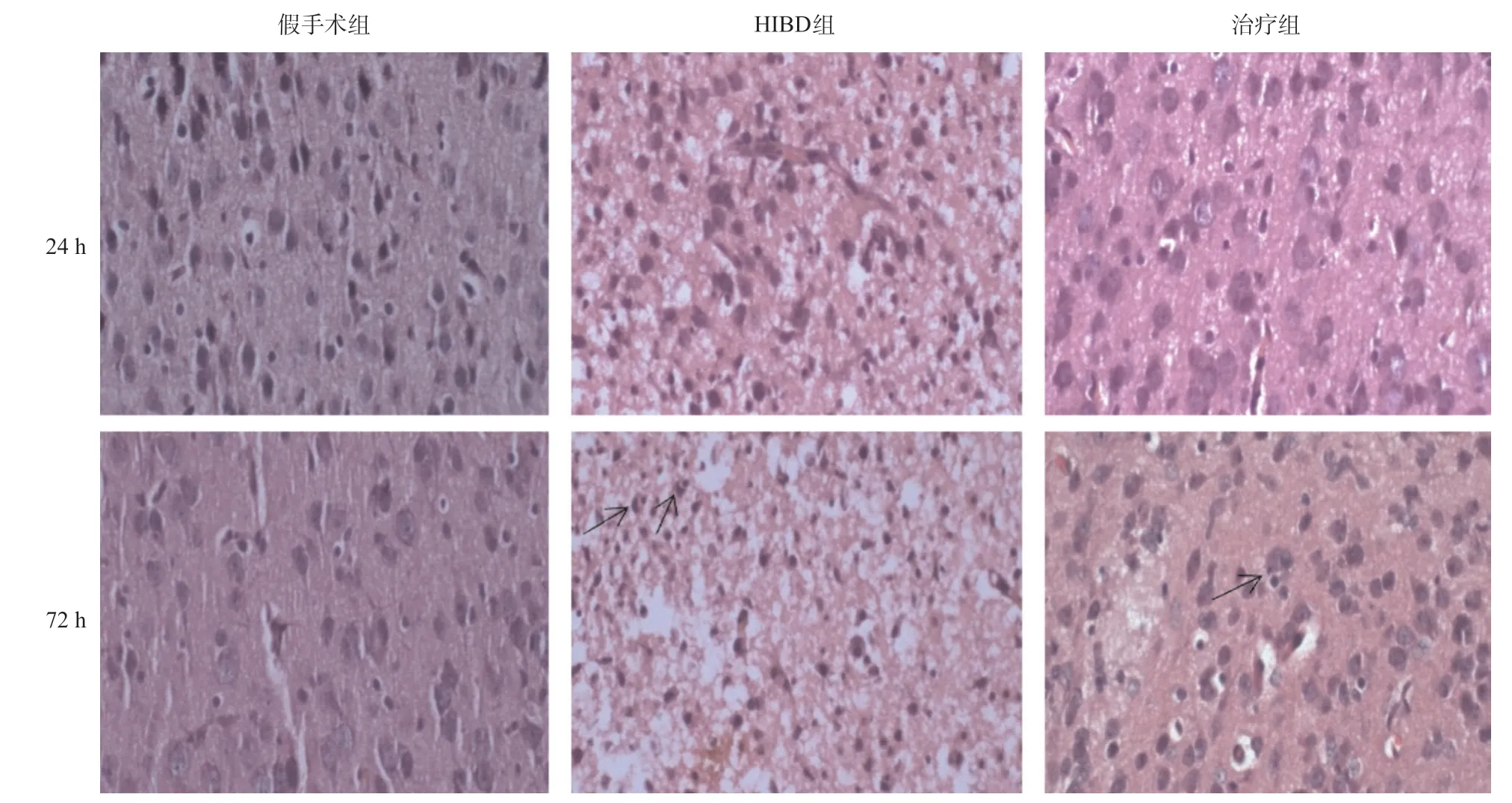
圖2 新生大鼠左側大腦組織HE染色結果(×400)
2.3 腦組織尼氏染色觀察 假手術組大腦皮層、海馬區和紋狀體細胞排列有序,結構分明(見圖3A)。HIBD組出現明顯的損傷,結構紊亂,細胞大量丟失(見圖3B)。與HIBD組相比,治療組細胞變性和壞死情況減輕(見圖3C),腦組織損失率測定HIBD組較假手術組增加,而治療組較HIBD組減少(P <0.01),見圖3D。
2.4 各組血漿細胞外組蛋白水平變化 假手術組在造模后6 h、24 h和72 h時血漿細胞外組蛋白水平差異無統計學意義(P>0.05);HIBD組在造模后6 h、24 h和72 h時血漿細胞外組蛋白水平差異無統計學意義(P>0.05),并且分別明顯高于假手術組相同3個時間點的組蛋白水平(均P<0.05);治療組在造模后6 h、24 h和72 h時血漿細胞外組蛋白水平差異無統計學意義(P>0.05),并且分別低于HIBD組相同3個時間點的組蛋白水平(均P <0.01)。見圖4。


圖3 造模72 h后的腦組織尼氏染色

圖4 各組不同時間點血漿細胞外組蛋白水平
2.5 各組細胞凋亡情況 造模72 h后TUNEL染色檢測腦組織細胞凋亡情況,假手術組基本沒有細胞凋亡,HIBD組較假手術組細胞凋亡量高(P<0.01);而治療組較HIBD組細胞凋亡的數量低(P<0.01)。見圖5。
2.6 各組凋亡相關蛋白表達情況 檢測造模72 h后組織凋亡蛋白的表達情況,HIBD組凋亡蛋白cleaved caspase-3較假手術組表達高(P<0.05),而治療組較HIBD組cleaved caspase-3表達低(P<0.05)。見圖6。
3 討論
組蛋白是染色質的主要成分之一,在細胞核內含量豐富且非常恒定,主要包括5種類型:H1、H2A、H2B、H3和H4[6]。細胞凋亡或壞死時染色質降解,核內組蛋白被釋放至細胞外成為細胞外組蛋白[7]。細胞外組蛋白具有較強的細胞毒性,不僅能殺傷入侵的微生物病原體,同時其自身毒性與敗血癥[8]、血栓[9]、自身免疫性疾病[10-11]及腫瘤[12]等相關,還 會對肺[13]、肝[14]、腎[15]等臟器造成損傷,表明細胞外組蛋白可能是一種參與各種炎癥損傷過程的致病 因子[16]。但是,目前關于細胞外組蛋白對于中樞神經系統疾病,特別是HIBD中的作用效應仍不清楚。
國內學者通過建立大鼠腦缺血再灌注(I/R)損傷模型,發現I/R損傷后腦內局部的組蛋白濃度和細胞外組蛋白水平均升高,而細胞外組蛋白可直接導致培養的原代神經細胞死亡,提示細胞外組蛋白在腦I/R損傷中發揮重要作用[17]。DE MEYER等[18]研究發現,腦組織在I/R損傷后會出現細胞外染色質水平升高,而用抗組蛋白抗體中和細胞外組蛋白可以明顯改善小鼠的神經功能及運動功能,保護腦組織并減少梗死灶體積。相關的臨床研究[19-20]也證實了上述的觀點,腦卒中患者外周血核小體水平顯著增加,且與嚴重程度正相關。然而在HIE患兒中,外周血中細胞外組蛋白水平變化規律及其是否存在加重腦損傷的直接效應,阻斷其表達是否對HIE有一定的保護作用,目前尚缺乏相關報道。本研究在發現HIBD模型中細胞外組蛋白含量明顯上升的基礎上,進一步通過在缺氧缺血前尾靜脈注射特異性組蛋白H4中和抗體,結果顯示在3個時間點治療組血漿中細胞外組蛋白含量較HIBD組明顯下降,并且腦組織水腫壞死減少,提示細胞外組蛋白參與HIBD的過程。
LEE等[21]的研究發現細胞凋亡參與了HIBD的損傷過程。FANG等[22]的研究發現可以通過抑制凋亡減輕HIBD。為了進一步探索細胞外組蛋白是否參與HIBD的損傷及其可能的機制,本研究進一步檢測了各組腦組織中凋亡相關指標,發現HIBD組的腦組織凋亡程度增加,而注射抗組蛋白中和抗體的治療組腦組織凋亡程度較HIBD組減輕,提示細胞外組蛋白可以促進凋亡引起腦損傷,這可能是其參與HIBD過程的機制。


圖5 TUNEL染色檢測凋亡情況(×100)
本研究結果顯示,細胞外組蛋白可能是通過凋亡途徑參與缺氧缺血后腦損傷的進程,抗組蛋白中和抗體對新生大鼠缺氧缺血后引起的腦損傷具有一定的保護作用。

圖6 Western blot檢測cleaved caspase-3蛋白表達情況

