α-茄堿通過ROS/線粒體途徑促進鼻咽癌細胞凋亡的分子機制
吳賢敏,張杰,楊子飛,葉凡,張悅,陳曉云
溫州醫科大學附屬第一醫院 耳鼻咽喉頭頸外科,浙江 溫州 325015
鼻咽癌(nasopharyngeal carcinoma,NPC)是一種起源于鼻咽部鱗狀上皮細胞的惡性腫瘤,具有較高的發病率和病死率,因其解剖位置隱蔽和癥狀非特異性等特點,70%~80%的NPC患者往往出現局部晚期癥狀時才得以確診[1]。目前,NPC的主要治療手段主要包括早期放療和晚期放化療。然而,放療會引起許多并發癥,例如前庭功能障礙,放射誘發的視振蕩,感覺神經性聽力下降,滲出性中耳炎(otitis media exudative,OME)和顳骨放射性骨壞死(osteoradionecrosis,ORN),甚至是危及生命的大出血[1-2]。一些化療藥物(如順鉑)對NPC患者的療效已經得到證實,但其耳毒性等不良反應限制了它們在臨床上的應用[3]。因此,尋找新型低毒高效的藥物對于治療NPC具有重要意義。
α-茄堿是一種三糖糖苷生物堿,主要存在于馬鈴薯塊莖和茄屬植物中[4-6]。近年來,關于α-茄堿對各種人類癌細胞株的體內、外抗增殖活性的研究均有報道[7-11],然而,其潛在的細胞和分子機制尚未被完全闡明。本研究探究了α-茄堿在體外對NPC CNE-2細胞的抑制作用,旨在闡明α-茄堿對腫瘤細胞生物學行為的影響及其具體細胞分子機制,以期為NPC的治療提供新思路,為新型抗腫瘤藥物的研發提供實驗基礎和理論依據。
1 材料和方法
1.1 材料 人鼻咽癌細胞系CNE-2購自中國科學院上海生命科學研究所細胞庫。α-茄堿和青霉素G購自美國Sigma公司;CCK-8試劑盒、RIPA裂解緩沖液及TRIzol試劑均購自北京Protein Biotechnology 公司;Annexin V-FITC/PI凋亡檢測試劑盒購自美國BD Biosciences公司;Mito-SOX試劑盒購自美國Life Technologies公司;SDS-PAGE凝膠配制試劑盒購自美國Bio-Rad公司;ECL顯色液購自美國 Abcam公司;一抗、二抗均購自美國Sigma公司;cDNA合成試劑盒購自美國Thermo Fisher Scientific 公司;FastStart Universal SYBR Green Master (Rox)試劑盒購自美國Roche Life Science公司;戊二醛、鋨酸及乙酸鈾酰均購自美國Sigma-Aldrich公司;丙酮購自上海國藥集團化學試劑有限公司;環氧樹脂購自英國TAAB公司;枸櫞酸鉛購自美國Polysciences公司。
1.2 方法
1.2.1 細胞培養:將CNE-2細胞系維持在RPMI-1640培養基中(培養基中加入10%胎牛血清以及100 kU/L 的青霉素G),置于37 ℃,5% CO2的培養箱中培養,每3天進行一次細胞傳代。
1.2.2 給藥處理:制備CNE-2細胞懸液,接種于96孔板或6孔板中,放置在37 ℃,含5% CO2的培養箱預培養。按0、5、10、15 μmol/L的濃度梯度,計算用量后將α-茄堿分別加入含RPMI-1640培養基的離心管中混勻。棄去舊培養液,每孔加入含不同濃度(0、5、10、15 μmol/L)α-茄堿的培養基,作用一段時間(12、24、48 h)后,用于后續實驗。
1.2.3 CCK-8法檢測細胞增殖:取對數生長期的CNE-2 細胞,以每孔2 000個細胞接種在96孔板中。24 h 后,用不同濃度的α-茄堿(0、5、10和15 μmol/L) 作用CNE-2細胞。經過不同的作用時間(12、24、 48 h)后,加入CCK-8試劑,避光孵育2 h后在酶標儀 上檢測各孔OD值。根據結果選擇出適宜作用時間。
1.2.4 流式細胞術檢測細胞凋亡和ROS水平變化:用不同濃度(0、5、10、15 μmol/L)的α-茄堿作 用CNE-2細胞后,用胰蛋白酶消化并重懸細胞,離 心5 min收集細胞。PBS洗滌細胞2次,并以1×106個/mL的濃度重懸于1×結合緩沖液中,與ANXA5-FITC和碘化丙啶輕輕混勻,在37 ℃,5% CO2的環境下避光孵育30 min后,立即使用流式細胞儀分析細胞。每個實驗至少重復3次。使用Mito-SOX試劑盒檢測ROS水平。用不同濃度的α-茄堿(0、5、10、15 μmol/L)處理細胞后,用胰蛋白酶消化,并離心5 min。隨后將細胞重懸于含有Mito-SOX的溶液中10 min,用PBS輕柔洗滌2次,通過流式細胞儀進行分析。
1.2.5 Western blot檢測細胞凋亡相關蛋白的表達:將CNE-2細胞裂解后,通過BCA蛋白質定量試劑盒 測量蛋白質濃度。在10% SDS聚丙烯酰胺凝膠上分離樣品,并將蛋白質轉移到PVDF膜上。室溫封閉緩沖液封閉膜1 h,然后與稀釋后的一抗在4 ℃冰箱中孵育過夜。將膜在TBST中洗滌3次,然后在與HRP偶聯的二抗溶液中(1:5 000配制)孵育1 h,再用TBST洗滌3次,用ECL顯色液顯色。每個實驗至少重復3次。
1.2.6 qRT-PCR檢測凋亡相關基因的表達:用TRIzol試劑提取CNE-2細胞的總RNA,并使用cDNA合成試劑盒進行反轉錄獲得cDNA。使用FastStart Universal SYBR Green Master(Rox)試劑盒,在Applied Biosystems CFX96 實時PCR系統上進行qRT-PCR。所有設計的靶向mRNA的引物均經過驗證。 qRT-PCR的條件如下:95 ℃預變性15 s,1個循環;然后95 ℃變性15 s,60 ℃退火60 s,72 ℃延伸20 s,共40個循環。用GAPDH對每種mRNA表達量進行標準化。
1.2.7 透射電子顯微鏡(transmission electron microscope,TEM)觀察細胞超微結構變化:收集CNE-2細胞,2.5%戊二醛中固定24 h,1%鋨酸中固定1~2 h。丙酮脫水,包埋在環氧樹脂中。超薄切片用檸檬酸鉛和乙酸鈾酰染色,用蒸餾水輕輕洗滌,最后在JEM 1230 TEM上進行觀察。
1.3 統計學處理方法 使用Microsoft Excel和GraphPad Prism6 軟件進行統計分析。計量資料以±s表示,2組比較采用雙尾非配對t檢驗,多組比較采用單因素方差分析,然后進行Dunnett多重檢驗。P<0.05為差異有統計學意義。
2 結果

圖1 α-茄堿對CNE-2細胞存活的影響
2.1 α-茄堿顯著抑制CNE-2細胞的生長并誘導細胞凋亡 經不同的加藥時間(12、24、48 h)以及不同濃度的α-茄堿(0、5、10、15 μmol/L)處理后,隨著藥物濃度和加藥時間的增加,存活細胞數量顯著減少(P <0.01)。當用5 μmol/L α-茄堿處理細胞12 h或24 h時,活細胞的比例與對照組比差異無統計學意義(P>0.05)。α-茄堿作用48 h對CNE-2細胞的抑制作用處于一個較為適宜的水平,因此在后續實驗中也作用48 h。細胞活性檢測結果表明,當藥物濃度增加時,凋亡和死亡的CNE-2細胞的比例均顯著增加(P<0.01)。見圖1。
2.2 α-茄堿增加CNE-2細胞中ROS的產生 采用Mito-SOX Red線粒體超氧化物熒光探針(一種氧化還原熒光基團,可選擇性檢測線粒體超氧化物)檢測α-茄堿處理48 h后CNE-2細胞中線粒體ROS水平。流式細胞術分析結果表明,與對照組比,當α-茄堿濃度增加時,線粒體ROS水平顯著升高(P<0.01),見圖2。
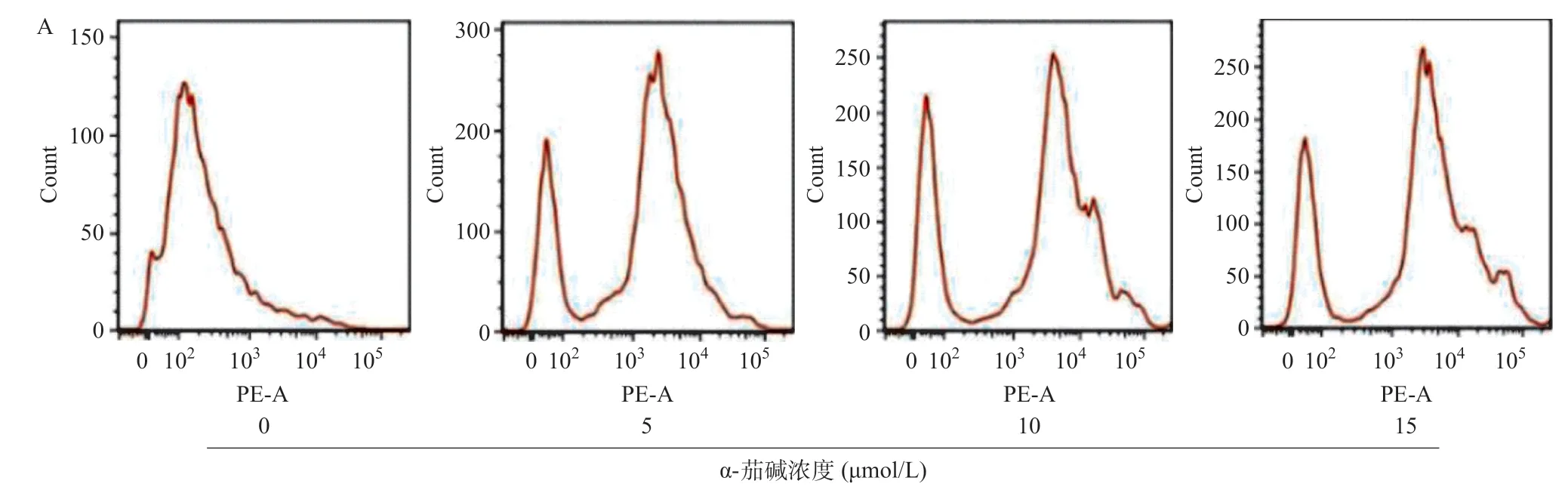

圖2 α-茄堿作用后CNE-2細胞中ROS水平的變化
2.3 α-茄堿在CNE-2細胞中引起線粒體損傷 TEM顯示CNE-2細胞線粒體損傷,表現為線粒體嚴重腫脹和線粒體嵴網絡消失。正常細胞線粒體形態正 常,線粒體嵴豐富而清晰。我們還觀察到,升高濃度的α-茄堿增加了功能障礙的線粒體的數量,同時減少了CNE-2細胞中自噬體的數量(見圖3)。
2.4 α-茄堿影響凋亡相關基因的表達水平 10 μmol/L α-茄堿處理48 h后,CNE-2細胞中Aif(凋亡誘導因子)和Caspase-8的mRNA表達與對照相比明顯增加 (P<0.01);FADD(Fas相關死亡域蛋白)的表達也增加,但與對照組相比差異無統計學意義(P>0.05)。α-茄堿處理后Bcl-2 表達量顯著下降,盡管Bax的表達量沒有顯著變化,但Bcl-2/Bax比值顯著降低 (P<0.05)。蛋白檢測結果顯示α-茄堿作用48 h后,Bcl-2表達及Bcl-2/Bax比值均明顯低于對照組(P<0.05),這與qRT-PCR的實驗結果基本一致。見圖4。
3 討論

圖3 α-茄堿作用后CNE-2細胞的超微結構變化(紅色三角形為腫脹線粒體,黃色三角形為自噬體)
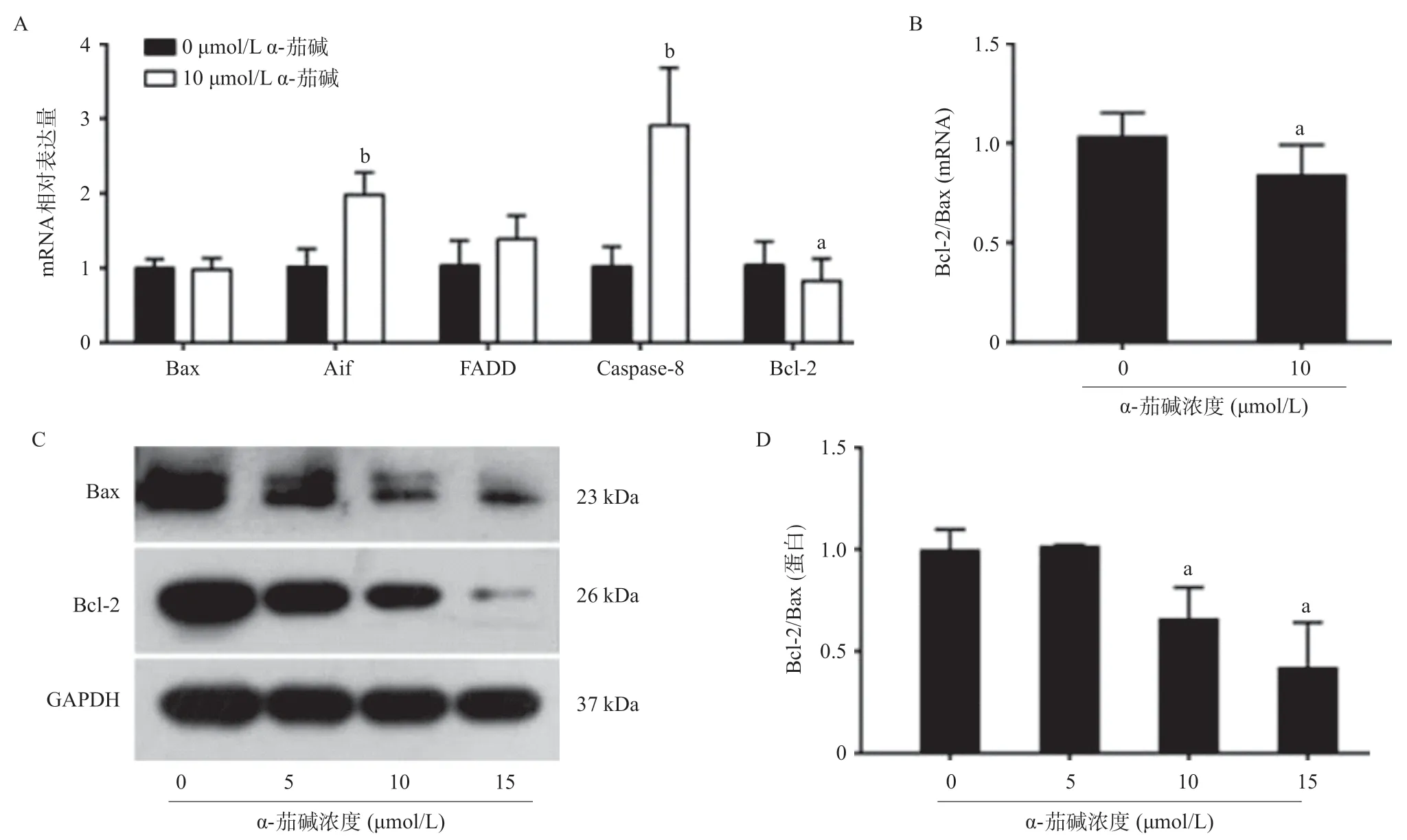
圖4 不同濃度α-茄堿作用于CNE-2細胞48 h后凋亡相關基因mRNA及蛋白表達水平的變化
NPC是一種頭頸部惡性腫瘤,具有明顯的地區和種族分布特征,在東亞和東南亞尤為常見。遺傳、種族、環境、飲食、EB病毒感染等因素均與NPC的發病相關[12]。目前,放射治療是NPC的主要治療方法。隨著影像學技術的進步,調強放射治療的出現以及同步放化療在晚期腫瘤患者中的應用,NPC患者的生存率得到了顯著提高,并發癥相較以往也明顯減輕[13]。然而,放療仍會不可避免地損傷從顱底到頸部的受輻射區域的腫瘤相鄰組織,進而導致一系列并發癥,例如吞咽困難、聽力下降、口干癥,以及中耳炎等,嚴重影響患者的生活質量和治療的依從性,有時甚至會引起危及生命的大出血[12-14]。因 此,開發特異和有效地靶向癌細胞的新型治療藥物具有重要的臨床意義。α-茄堿是茄屬植物中的主要糖苷生物堿,體外實驗[15-18]及動物實驗[9-10]均證實其具有良好的抗腫瘤效應。然而,目前α-茄堿對NPC的作用報道甚少,作用機制亦不明確。
細胞凋亡是抑制腫瘤細胞增殖的重要途徑,可被多種細胞信號激活,其中氧化損傷引起的羥自由基等ROS是眾多因素中至關重要的一種,ROS的生成增多能夠增加細胞凋亡。線粒體途徑作為細胞內源性凋亡的主要通路,由多種凋亡蛋白及抗凋亡蛋白調節,其中促凋亡蛋白Bax可以改變線粒體膜的通透性并促進細胞色素C的釋放。與此相反,具有抗凋亡功能的Bcl-2 家族蛋白可以調節線粒體凋亡因子(如細胞色素C和凋亡誘導因子)的釋放。當Bcl-2蛋白家族與Bax蛋白結合時,可以阻斷細胞凋亡過程。Bcl-2 和Bax之間的比例失衡將導致細胞色素C的釋放和Caspase-9的激活,進一步激活下游Caspase-3形成裂解的Caspase-3,最終導致細胞凋亡[19-20]。已有研究報道α-茄堿通過細胞凋亡途徑來抑制腫瘤細胞增殖。有學者將α-茄堿用于食管惡性腫瘤細胞發現α-茄堿能夠降低該細胞內Bcl-2 的表達,增加Bax表達并增加Caspase-3/7的活性[21]。有學者還發現在乳腺癌細胞上α-茄堿可以逆轉細胞內Bcl-2/Bax比例并誘導細胞凋亡[10]。本研究通過Mito-SOX的流式細胞術分析顯示,α-茄堿顯著增加了線粒體ROS的生成水平,表明α-茄堿的抗腫瘤機制具有ROS依賴性;同時我們觀察到Bcl-2/Bax比值的降低,Aif表達的增加以及線粒體的改變,表明α-茄堿在CNE-2細胞中誘導了線粒體介導的細胞凋亡。這些結果與先前的研究基本一致。然而,LEE等[22]在結腸癌細胞上發現α-茄堿會導致細胞色素C釋放和Caspase-3的激活,但通過不依賴于ROS的線粒體凋亡途徑介導細胞死亡。雖然這與我們以及之前的研究有所區別,但α-茄堿可以通過線粒體途徑誘導腫瘤細胞凋亡可以得到證實,可能在不同腫瘤細胞上存在生物學差異性。
FADD(Fas相關死亡域蛋白)是細胞外源性凋亡途徑的一個重要因子,能促進Caspase-8的活化,誘導死亡誘導信號復合物的形成,最終導致細胞發生凋亡[23]。我們的數據表明,α-茄堿可增加CNE-2細胞中的FADD和Caspase-8的表達,這也提示α-茄堿可以通過Fas介導CNE-2細胞外源性凋亡。
綜上所述,本研究發現α-茄堿能引起CNE-2線粒體內ROS升高,進而導致線粒體損傷,最終引起細胞凋亡,而且其抗腫瘤效應隨著藥物濃度增加而增加,呈現出劑量依賴性。α-茄堿通過線粒體途徑和Fas介導的死亡受體途徑共同誘導細胞凋亡。總之,α-茄堿在體外對CNE-2細胞具有強大的抑制作用,可以作為NPC治療的一種潛在的候選藥物。

