甲基潑尼松沖擊對小細胞肺癌神經系統副腫瘤綜合征的療效分析
馮會方 肖彩霞 顏立坤
小細胞肺癌是一種增殖比率高、倍增速度快、轉移早及生存時間顯著縮短的侵襲性神經內分泌惡性腫瘤, 2年內存活率在5.20%~19.50%、5年內存活率僅為7%,因此需引起臨床足夠關注[1-2]。查閱近三年文獻資料,有關小細胞肺癌的研究主要涉及發病機制、早期診斷、手術及輔助放化療方面且已具有突破性進展,使得小細胞肺癌患者臨床獲益頗多[3-4]。但隨著小細胞肺癌群體數量增加及疾病關注度升高,小細胞肺癌副腫瘤綜合征日益進入臨床視野,并認為副腫瘤綜合癥的出現屬于肺癌的非轉移性肺外表現,與腫瘤細胞分泌產生的激素、抗原、酶或代謝產物致機體內環境失衡而誘發多系統、多臟器功能異常有關[5-6];其中神經系統是小細胞肺癌最常累及的系統且作用范圍廣泛、臨床表現尤為復雜,常涉及周圍神經、肌肉、脊髓或是腦部等,因此不同程度增加了臨床診治難度且預后往往不佳[7-8]。目前對于小細胞肺癌合并神經系統副腫瘤綜合癥的治療并無特效措施,仍以切除原發性腫瘤,輔助全身化療等非手術干預以及結合對癥處理等方案為主,并配合一定劑量的皮質類固醇、免疫抑制劑、維生素類藥物和血漿置換等進行干預;上述方法雖然能在一定程度上緩解副腫瘤綜合癥,但并不能實現較為理想的治療目標[9]。近年來研究顯示大劑量的糖皮質激素沖擊療法具有強大的抗炎效應且能提高機體應激狀態、減輕組織細胞水腫、有效保護神經細胞、促進病情好轉等優勢,因此常被應用于神經系統損傷等疾病治療中且收效滿意[10]。本研究根據小細胞肺癌神經系統副腫瘤綜合癥發病特點、機制等原理,嘗試運用大劑量甲基潑尼松沖擊療法輔助治療小細胞肺癌神經系統副腫瘤綜合癥,以期初步評價其治療作用,進一步提高治療效果、改善病情,現報告如下。
1 資料與方法
1.1 一般資料
研究結合本地區及科室實際情況且在保證整體抽樣準確性及完整性的前提下,根據Poisson(泊松分布)、采用整體隨機抽樣法,最終納入本地區62例小細胞肺癌神經系統副腫瘤綜合癥患者作為觀察樣本量。男性39例、女性23例,年齡42~68歲、平均(56.00±2.00)歲,均以神經系統為首發癥狀就診,病程1~6個月、平均(3.50±1.00)個月。亞型分布:Lambert-Eaton綜合征30例、感覺神經元神經病21例、亞急性小腦變性9例,多部位受累2例。副腫瘤抗體檢測:抗神經元抗體(抗-Hu抗體)陽性25例。研究采用SPSS 21.0統計學軟件,產生隨機數字,將納入樣本隨機分為觀察組和對照組(各31例)。對比兩組納入樣本臨床資料,其均衡性強(P>0.05),因此具有一定可比性,見表1。本研究符合醫學倫理委員會要求且告知觀察對象有關本研究的目的、意義且均自愿參加。
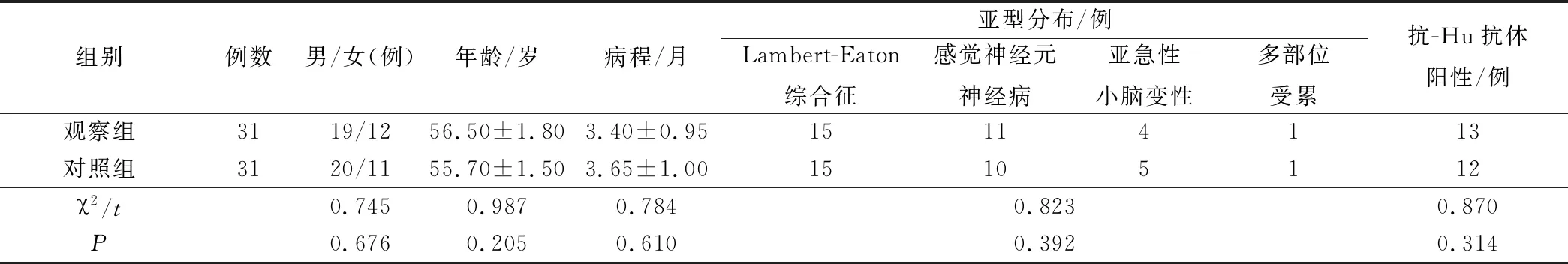
表1 兩組納入樣本臨床資料比較
1.2 納入及排除標準
1.2.1 納入標準 ①神經系統副腫瘤綜合癥診斷符合《神經病學》[11]有關標準。②經活檢或手術病理組織學明確為小細胞肺癌。③初次接受丙種球蛋白及大劑量甲基潑尼松沖擊干預且為小細胞肺癌放化療間歇期進行。④卡氏體力評分(Karmofsky,KPS)≥60分。
1.2.2 排除標準 ①精神疾病、認知障礙等無法進行有效研究。②既往存在中樞、外周神經病變史和精神活性物質或非成癮物質使用史。③合并其他組織來源的惡性腫瘤且臟器功能出現嚴重障礙、免疫缺陷性疾病。④因其他原因難以界定的神經系統癥狀。⑤對免疫抑制劑不耐受。⑥研究期間病情變化或改變治療方案。
1.3 方法
兩組患者在確診小細胞肺癌后,均針對小細胞肺癌進行了相關治療,包括手術切除腫瘤及化療;對照組同時針對神經系統副腫瘤綜合癥,連續靜脈注射丙種球蛋白(山西康寶生物制品股份有限公司,國藥準字S19994004,規格2.5g/瓶)0.4 g/(kg·d)共計5天;觀察組在對照組基礎上聯合甲基潑尼松沖擊療法,即15~20 mg/(kg·d)甲基潑尼松(Pfizer Manufacturing Belgium NV,批準文號H20130301,規格40 mg/支)+0.9%氯化鈉注射液緩慢靜脈滴注,第3天減半,至60 mg時改為潑尼松片(天津力生制藥股份有限公司,國藥準字H12020123,規格5mg/片)口服直至減量停藥。
1.4 觀察指標
觀察和比較兩組樣本治療前(T0)、治療1個月(T1)及治療結束后7天(T2)血清抗-Hu抗體、抗普肯野細胞抗體(抗-Yo抗體)、抗神經元骨架蛋白抗體(抗-Ri抗體)水平和美國國立衛生院神經功能缺損評分(NHISS)、日常生活活動能力評分(ADL)及T細胞亞群、活化、調節性T細胞水平。
血液標本來源與采集:分別于T0、T1及T2次日清晨空腹抽取兩組樣本外周靜脈血液10~15 ml,并分別置于兩個真空抗凝采血管內作為相應檢測標本;采用安徽中科佳科學儀器有限公司提供的KDC-2046型離心機以1500 r/min速度離心5 min,分離血清與血漿即刻檢測。其中血清抗-Hu抗體、抗-Yo抗體、抗-Ri抗體水平檢測:采用雙抗體夾心-酶聯免疫吸附法(ELISA法)進行定量測定,試劑盒由上海西唐生物科技有限公司提供。T細胞亞群、活化及調節性T細胞水平檢測:應用BD公司提供的FACS Calibur流式細胞儀測定,并經Cellquest軟件進行數據相關分析。
1.5 評定標準
NHISS評分[12]:含有意識情況(包括意識水平0~3分、意識水平提問0~2分、意識水平指令0~2分)、凝視(0~2分)、視野(0~3分)、面肌功能(0~3分)、上肢運動(0~9分)、下肢運動(0~9分)、共濟失調(0~2分)、感覺(0~2分)、言語(0~3分)、構音障礙(0~3分)、忽視癥(0~2分)、遠端運動功能(0~2分)12個條目;評分越高說明患者神經功能缺損程度越嚴重,其中正常或基本正常:0~1分,輕度神經功能缺損2~4分、中度缺損5~15分、中-重度缺損16~20分、重度缺損21~42分。
ADL評分[13]:參考Barthel指數評定,包括進餐、洗澡、修飾、穿衣、控制大小便、入廁、床椅轉移、平地行走45米、上下樓梯,分別按照獨立、部分獨立或需要部分幫助、需極大幫助和完全依賴分別賦值,共計四個依賴程度,其中輕度依賴:75~95分、中度依賴:50~74分,重度依賴:25~49分,完全依賴:0~24分。
1.6 統計學處理
2 結果
2.1 兩組樣本治療前后血清抗-Hu抗體、抗-Yo抗體、抗-Ri抗體水平比較
T0時,兩組樣本血清抗-Hu抗體、抗-Yo抗體、抗-Ri抗體水平比較,差異無統計學意義(P>0.05);隨著治療進展(T0-T1-T2),兩組樣本血清抗-Hu抗體、抗-Yo抗體、抗-Ri抗體水平逐漸下降,差異有統計學意義(P<0.05);且在T1、T2各時刻,觀察組樣本血清抗-Hu抗體、抗-Yo抗體、抗-Ri抗體水平均低于對照組,差異有統計學意義(P<0.05),見表2。
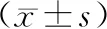
表2 兩組樣本治療前后血清抗-Hu抗體、抗-Yo抗體、抗-Ri抗體水平比較
2.2 兩組樣本治療前后NHISS、ADL水平比較
T0時,兩組樣本NHISS、ADL評分比較,差異無統計學意義(P>0.05);隨著治療進展(T0-T1-T2),兩組樣本NHISS評分逐漸下降、ADL評分升高,差異有統計學意義(P<0.05);且在T1、T2各時刻,觀察組樣本NHISS評分低于對照組、ADL評分高于對照組,差異有統計學意義(P<0.05),見表3。
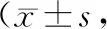
表3 兩組樣本治療前后NHISS、ADL水平比較分)
2.3 兩組樣本治療前后T細胞亞群、活化及調節性T細胞水平比較
T0時,兩組樣本CD4+T細胞、CD8+T細胞、總活化T細胞、活化CD4+T細胞、調節性T細胞水平比較,差異無統計學意義(P>0.05);T1較T0時,兩組樣本CD4+T細胞、調節性T細胞水平升高,總活化T細胞、活化CD4+T細胞水平下降,差異有統計學意義(P<0.05);T1時,觀察組樣本CD4+T細胞、調節性T細胞水平高于對照組,總活化T細胞、活化CD4+T細胞水平低于對照組,差異有統計學意義(P<0.05)(表4)。
表4 兩組樣本治療前后T細胞亞群、活化及調節性T細胞水平比較
3 討論
研究顯示副腫瘤綜合癥作為一種自身免疫性疾病,可因腫瘤所表達的腫瘤抗原和神經元蛋白誘導的免疫反應而能引起多肽、蛋白質或其前體等具有生物活性物質產生,繼而促使癌性神經系統疾病發生,最終誘發神經病變,造成相應神經功能缺損(常累及外周、中樞神經、肌肉)[14-15]。因此對于小細胞肺癌神經系統副腫瘤綜合癥而言,腫瘤組織的異位表達神經抗原可引起機體產生相關抗體(臨床常在此類患者血清及腦脊液中檢測出較高滴度的抗-Hu抗體、抗-Yo抗體、抗-Ri抗體3種抗神經抗體,而上述3種抗體已被視為神經系統副腫瘤綜合癥的常見生物學標記物)[16],其過程又常常涉及機體體液免疫和細胞免疫(其中細胞免疫由T細胞介導,CD4+T細胞能促進B細胞、T細胞增殖與分化、協調免疫細胞間的相互作用,CD8+T細胞則參與抗腫瘤等免疫反應且能抑制免疫應答活化,而總活化T細胞和活化性CD4+T水平能評定T細胞活化狀態;調節性T細胞可對T細胞活化與增殖活動產生抑制效應且其水平下降能誘導針對腫瘤特異性抗原的免疫反應[17]),最終使之機體免疫反應呈現異常表達狀態[18];例如活化T細胞及其細胞因子能對正常神經元細胞產生不正常的自身免疫應答反應等,說明小細胞肺癌神經系統副腫瘤綜合癥患者存在著嚴重的免疫失衡狀態;總之,抗神經抗體及T細胞介導的細胞免疫在小細胞肺癌神經系統副腫瘤綜合癥發生發展機制中具有重要臨床價值,而加強其水平監控利于提高腫瘤細胞早期檢測率以及做出病情監測、評定,繼而為臨床早期治療提供相關依據。
本研究結果顯示,采用甲基潑尼松沖擊療法能有效抑制血清抗-Hu抗體、抗-Yo抗體、抗-Ri抗體水平和總活化T細胞、活化CD4+T細胞水平,提高CD4+T細胞、調節性T細胞水平,且效果顯著,說明該方法能有效糾正小細胞肺癌神經系統副腫瘤綜合癥患者機體免疫紊亂狀態,對改善病情具有積極作用。同時NHISS、ADL評分變化也再次印證和肯定了甲基潑尼松沖擊療法在小細胞肺癌神經系統副腫瘤綜合癥治療中具有良好的使用價值,能顯著促進受損神經功能恢復,因此是一種有效的治療方法。與以下機制不無關系,例如甲基潑尼松作為一種人工合成的中效類糖皮質激素,屬于甾體激素;研究表明在正常生理情況下,糖皮質激素具有調節糖、蛋白質、脂肪等生物合成與代謝作用,對細胞功能正常發揮具有積極促進作用[19];而當糖皮質激素達到一定藥理濃度時,除上述作用外,同時還存在著強大的抗炎、抗腫瘤、抑制免疫反應等效應,因此被廣泛應用于炎癥性疾病、免疫性疾病治療中且收效滿意。例如甲基潑尼松可通過與T淋巴細胞內的相應受體解密結合而能調節T淋巴細胞數量、功能等且能經過對樹突細胞活性的抑制效應或將其轉化為“致耐受性樹突狀細胞”而影響樹突狀細胞捕捉、處理、呈遞抗原功能,形成T細胞的低反應水平,繼而調節細胞免疫狀態[20];并且大劑量的甲基潑尼松沖擊可使患者血藥濃度快速升高,有助于實現高強度的非特異性免疫抑制效應且能清除自由基、抑制細胞膜脂質過氧化反應而能增加神經元細胞興奮性,繼而利于促進受損神經功能的快速恢復[21]。
綜上所述,甲基潑尼松沖擊療法在小細胞肺癌神經系統副腫瘤綜合癥治療中應用效果滿意,能有效調節患者機體免疫狀態,緩解神經系統癥狀,不失為一種行之有效的治療方案;但本研究并未進行長期隨訪活動,導致研究結論具有一定局限性,因此延長觀察時間并對遠期效果進行評定,有助于夯實本結論,為其臨床使用提供更有價值的參考依據。

