基于化學品生物合成的嗜甲烷菌人工細胞構建及應用進展
郭樹奇,焦子悅,費強,2
(1 西安交通大學化學工程與技術學院,陜西 西安 710049;2 陜西省能源化工過程強化重點實驗室,陜西 西安710049)
作為一種無色、無味、無毒的可燃性氣體,甲烷(CH4)是目前發現的最簡單、能量密度最大的烷烴(熱值為55 MJ/kg)[1],也是僅次于二氧化碳(CO2)的第二大溫室氣體源頭[2-3]。近期,Feldman等[4]通過實驗和觀測首次證實了甲烷排放增長與全球變暖加速之間的正向關系。當前大部分甲烷排放來自于能源開采(天然氣和石油)、牲畜飼養、垃圾填埋場等人類活動[5-6]。隨著人口增長導致的肉類食品和能源需求的不斷提高,甲烷的排放量還將持續上漲,這將對節能減排和“碳中和”等國家戰略造成一定沖擊。而作為天然氣和沼氣的主要組成部分,甲烷也具有儲量豐富、價格低廉、碳原子還原性強、微生物可利用等優勢,是一種極具潛力的碳源[7]。嗜甲烷菌是一種能夠以甲烷作為唯一碳源和能源進行生長和代謝的微生物,這類菌群在緩解大氣中甲烷排放方面發揮著重要作用[8]。近年來,圍繞嗜甲烷菌開展甲烷生物轉化利用的研究得到了國內外廣泛的關注[9-18]。
由于抗污染能力強,且可在溫和生長條件下實現甲烷的快速氧化和同化代謝,嗜甲烷菌已成為理想的甲烷生物利用工程菌改造宿主,研究證實開發和構建嗜甲烷菌細胞工廠具有重要的科學價值和研究意義[1,13,19-21]。到目前為止,用于化學品和生物燃料合成的微生物多以糖類作為發酵底物,考慮到其原料價格不穩定,開發廉價、非食品的碳源已成為生物制造領域中亟待解決的重要課題之一[22]。研究發現,當甲烷被用作底物生產還原性化學品時,能夠提供更多的電子,可有效促進目標產物得率和產量[23-24]。利用前沿合成生物技術對嗜甲烷菌的代謝網絡進行理性設計和改造,已實現生物轉化甲烷合成多種平臺化合物。由此可見,通過開發甲烷生物轉化技術,不但可以促進甲烷有效利用和減少溫室氣體排放量,還能夠為建立循環經濟模式提供一種全新的研發策略和實踐方向[13]。
本文主要介紹了嗜甲烷菌人工細胞構建的相關研究進展,重點分析了嗜甲烷菌代謝工程改造策略和化學品合成相關研究成果。最后結合在生物制造領域的應用前景,探討了嗜甲烷菌人工細胞構建和改造等方面所面臨的挑戰和機遇。
1 嗜甲烷菌及其改造策略
分離自富含甲烷環境中的嗜甲烷菌是一種天然的甲烷利用菌株。雖然研究發現嗜甲烷菌可在厭氧條件下利用甲烷生長,但是絕大多數可人工培養的嗜甲烷菌均需在好氧環境中完成甲烷的氧化過程[25-26]。因此本文主要圍繞好氧性嗜甲烷菌的相關研究展開一系列討論和分析。如圖1所示,嗜甲烷菌體內獨有的甲烷單加氧酶(methane monooxygenases, MMO)可在胞內將甲烷轉換為甲醇,隨后通過內源代謝途徑完成碳同化[28]。目前,根據甲烷同化途徑的不同,好氧性嗜甲烷菌主要被分為 Group Ⅰ、Group Ⅱ和 Group Ⅲ[29],其分別通過單磷酸核酮糖(ribulose monophosphate,RuMP)循環、絲氨酸循環(serine cycle)和卡爾文循環(Calvin-Benson-Bassham cycle, CBB)實現甲烷的生物轉化。上述3種同化過程已在前期文章中進行了詳細的介紹[1,9,18,25,30],本文不再贅述。
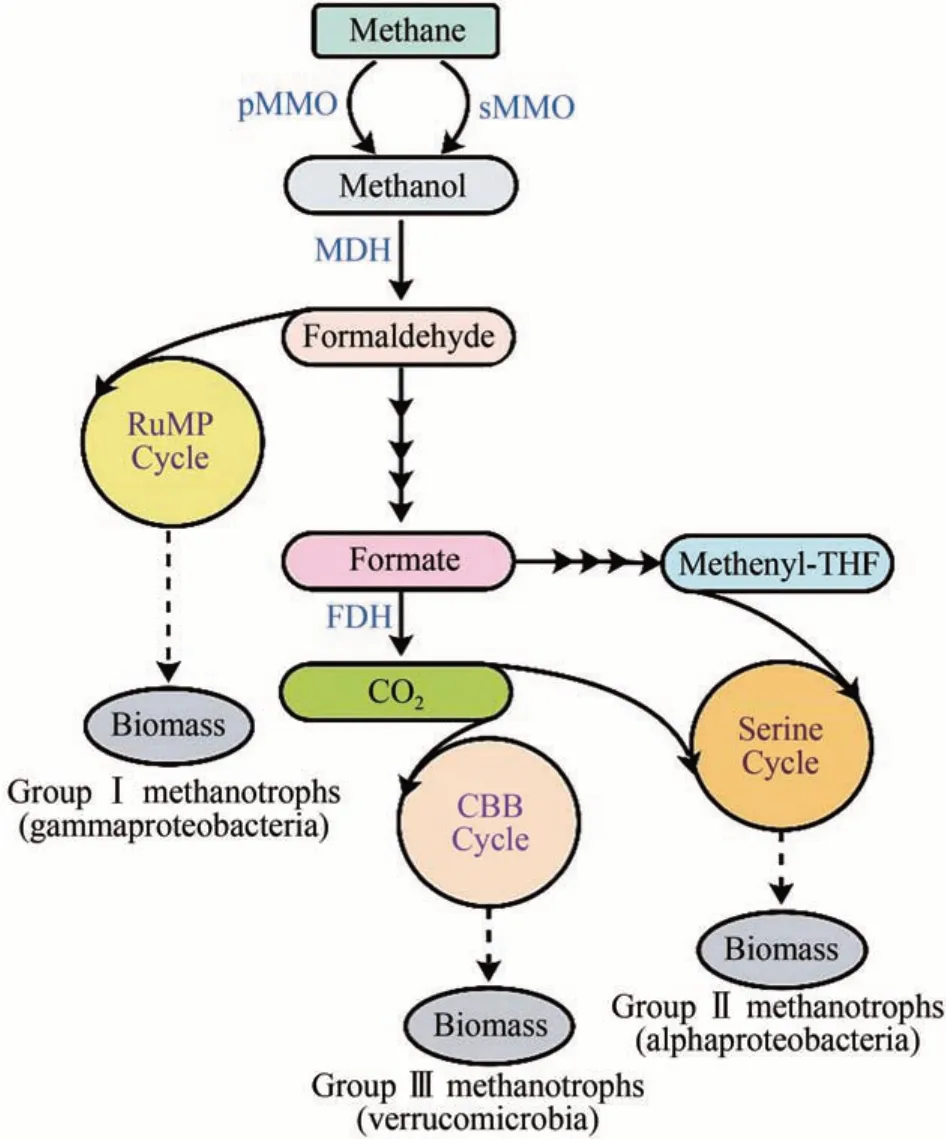
圖1 嗜甲烷菌中甲烷的代謝途徑[8,27]Fig.1 The pathways of methane metabolism in methanotrophs[8,27]
遺傳改造工具在嗜甲烷菌人工細胞構建研究中發揮著重要作用。目前基于嗜甲烷菌報道的基因操作工具主要包括質粒載體和基因轉移方法。質粒載體主要用于基因復制、基因表達和基因敲除的相關工作,而基因轉移方法多用于將質粒或外源基因轉入嗜甲烷菌體內,包括接合轉移和電穿孔。現階段通過優化的接合轉移和電穿孔方法,研究人員在嗜甲烷菌體內已成功實現了基因缺失、整合和位點特異性重組等多種遺傳操作[20]。此外,研究人員基于嗜甲烷菌體系還成功開發了人工誘變技術[31]、適應性進化[32]、基因表達模塊和元件優化(啟動子和其他調節元件)[33]以及前沿基因編輯[10]等人工細胞構建方法[34-35]。在探索鑭系元素開關對甲醇脫氫酶mxaF 調節功能的研究中,Groom 等[31]通過化學誘變(亞硝基胍)方法,基于Methylotuvimicrobium buryatense5GB1C 菌株成功篩選出鑭元素無法抑制mxaF 啟動子的突變體。Lee 等[32]基于Methylomonassp.DH-1 通過適應性進化篩選出一株耐乳酸菌株JHM80,用于提高工程菌株的乳酸耐受性和產量。Puri[34]等報道了M. buryatense5GB1S 中不同表達強度的啟動子元件。Garg 等[33]通過模塊化組裝策略,進一步優化了利用甲烷合成乳酸的M.buryatense5GB1 人工細胞。表1列出了嗜甲烷菌遺傳改造工具。

表1 嗜甲烷菌遺傳改造工具Tab.1 The genetic tool used for metabolic engineering of methanotrophs
近期,CRISPR/Cas9 基因編輯系統也被證實可在嗜甲烷菌體系中應用。Tapscott 等[42]在M. capsulatusBath 體內 利用 CRISPR/Cas9 實 現 了sMMO的敲除及GFP蛋白的修飾。此外,Liu等[10]利用苯丙氨酰tRNA 合酶編碼基因phzSAG,在M. buryatense5GB1C 體系中開發了一種基因無痕敲除方法,有效提升了基因敲除效率。以上這些基因操作方法的建立進一步拓寬了嗜甲烷菌在甲烷轉化中的應用,使嗜甲烷菌成為具有工業應用前景的模式菌株[14],也為實現甲烷基化學品的高效生物合成打通了路徑(表2)。
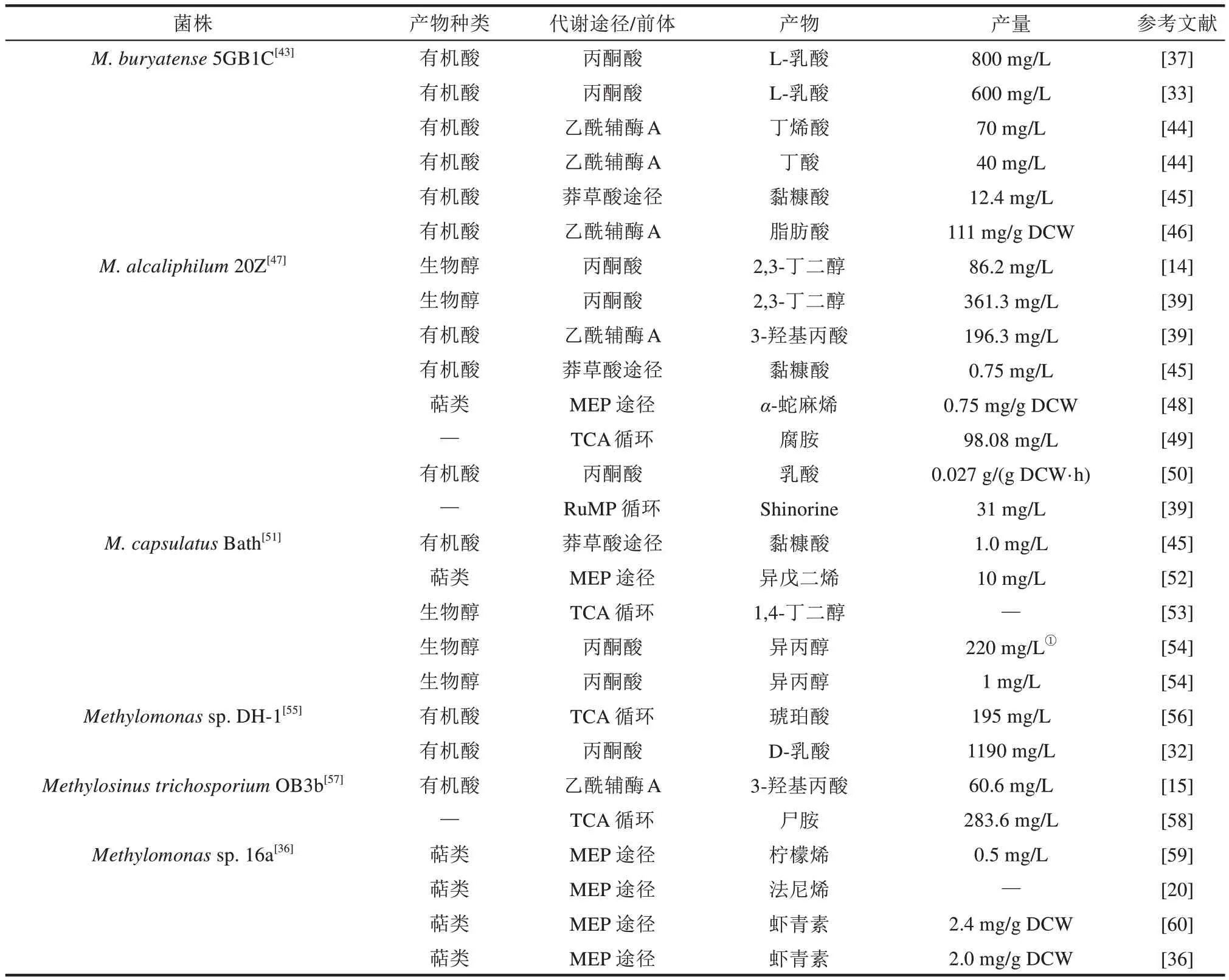
表2 嗜甲烷菌人工細胞轉化甲烷合成化學品和生物燃料Tab.2 Biosynthesis of various chemicals and biofuels from methane by methanotrophic cell factories
當前,基于化學品生物合成的嗜甲烷菌人工細胞的改造工作主要圍繞關鍵代謝節點(丙酮酸和乙酰輔酶A)累積和甲烷同化過程(RuMP 循環、絲氨酸循環)理性改造開展,通過有效地調控甲烷碳通量走向,實現碳轉化效率的提高和目標產物的高效合成。如圖2 所示,RuMP 循環主要通過核酮糖-5-磷酸(ribulose-5-phosphate, Ru5P)利用甲醛以實現甲烷的同化[13]。其中,磷酸轉酮酶(phosphoketolase, PKT)途徑產生的赤蘚糖4-磷酸(E4P)或甘油-3-磷酸(GAP)重新排列,能夠實現Ru5P的再生,從而促進Ru5P對甲烷的同化效率[20,61]。通過磷酸轉酮途徑增加甲烷代謝的碳通量被認為是一種十分有效的代謝工程改造方法,這一途徑的重構已使得多種微生物人工細胞中的乙酰輔酶A 積累量顯著提高,為乙酰輔酶A衍生化學品的生物合成提供了可行的工程改造策略[62-65]。 以M. buryatense5G 為例 , Henard 等[61]研究發現該菌株通過RuMP 途徑可將6 分子甲醛轉化為2 分子的乙酰輔酶A,而利用RuMP-PKT途徑可將6 分子甲醛轉化為3 分子的乙酰輔酶A。同時,RuMP-PKT 途徑能夠避免源于糖酵解(Embden-Meyerhof-Parnas, EMP)途徑中丙酮酸脫羧造成的ATP 消耗,從而在不損失碳和能量的情況下實現乙酰輔酶A 的合成[20]。此外,嗜甲烷菌中絲氨酸循環與乙基丙二酰輔酶(Ethylmalonyl-CoA,EMC)途徑及三羧酸循環緊密相連,絲氨酸循環產生的乙酰輔酶A 可被整合到乙基丙二酰輔酶通路中用于乙醛酸的再生和細胞產物PHB(poly-β-hydroxybutyrate)的生物合成[23]。作為關鍵中間代謝物和乙酰輔酶A 合成前體,丙酮酸合成效率也是甲烷基化學品合成的關鍵瓶頸。目前敲除其競爭途徑是提高丙酮酸累積濃度的最有效、最簡單的方式之一[20]。有研究發現,嗜甲烷菌中的丙酮酸和GAP 的產量分別是乙酰輔酶A 的150 倍和30 倍,而在大腸桿菌中乙酰輔酶 A 的產量遠高于丙酮酸和 GAP[20,66-67]。這可能是由于嗜甲烷菌中內源MEP 途徑代謝通量較強導致丙酮酸和GAP 傾向于縮合形成脫氧-D-木酮糖5-磷酸(deoxy-D-xylulose 5-phosphate, DXP),從而減少了丙酮酸向乙酰輔酶A 合成過程的碳流。
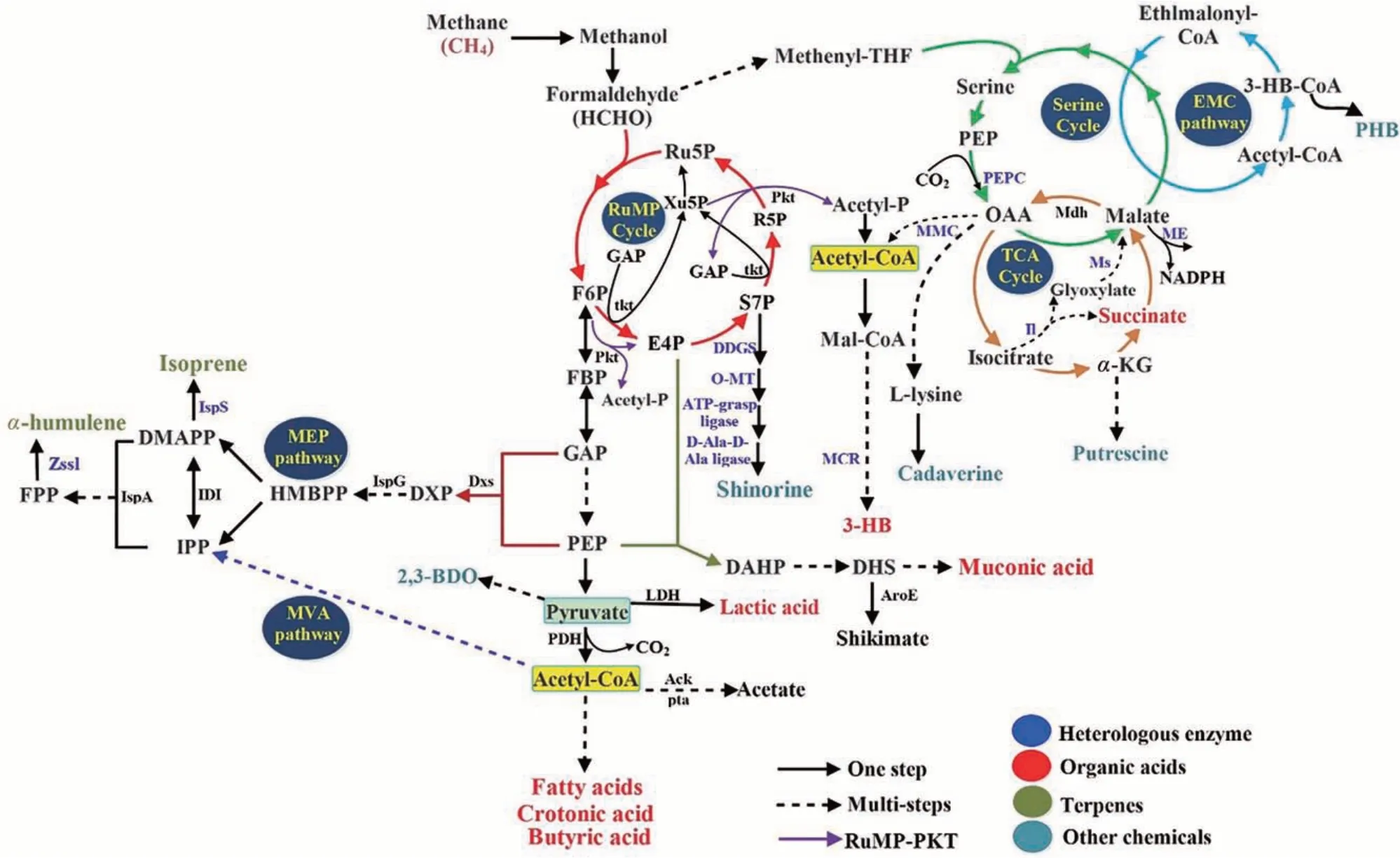
圖2 嗜甲烷菌轉化甲烷合成化學品和燃料的代謝途徑[27]Fig.2 Metabolic pathways for the production of chemicals and fuels by methanotrophs using methane[27]
2 基于化學品合成的嗜甲烷菌人工細胞的構建
2.1 有機酸類化學品
有機酸類化學品作為天然產物,在食品、制藥和生物基材料工業中應用廣泛[68-72]。研究人員基于丙酮酸、乙酰輔酶A 以及磷酸烯醇式丙酮酸(phosphoenolpyruvic acid, PEP)等甲烷代謝中間產物構建的嗜甲烷菌人工細胞已成功將甲烷轉化為C3~C18不同鏈長的有機酸類化學品(表2)。乳酸(lactic acid)在嗜甲烷菌中的生物合成已在途徑構建、模塊篩選以及培養優化等方面均取得了重要進展[33],這主要是得益于應用合成生物學模塊化思路完成了嗜甲烷菌合成乳酸模塊的代謝路徑和表達水平的優化。近期,Lee 等[32]基于適應性進化策略獲得乳酸耐受菌株Methylomonassp.DH-1 JHM80,通過基因組測序發現該菌株啟動子區域突變引發了弱酸耐受調節子(weak acid tolerance regulator,WatR)表達的上調。隨后,該研究通過定向精準調控watR基因的表達水平,使乳酸產量提高到1.19 g/L。嗜甲烷菌M.trichosporiumOB3b 中具有獨特的乙基丙二酰輔酶途徑,能夠利用 3 分子乙酰輔酶 A 同化 1 分子 CO2和 1 分子HCO3-,從而積累 2 分子蘋果酸[73-74]。Nguyen等[15]基于該菌株中特有的絲氨酸循環,通過引入非產氧光合菌Chloroflexus aurantiacus中的還原酶(malonyl-CoA reductase,MCR),構建了3-羥基丙酸(3-hydroxypropionic acid,3HP)合成模塊,并通過過表達蘋果酸酶(malic enzyme,ME)轉化蘋果酸實現了NADPH再生,為MCR催化過程提供了充足的還原力,進而有效提高了3HP的產量。同時,為了避免乙酰輔酶A羧化成丙二酰輔酶A的限速步驟,該研究將來源于費氏丙酸桿菌(Propionibacterium freudenreichii) 中的甲基丙二酰羧基轉移酶(methylmalonyl-CoA carboxyltransferase,MMC)和磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxylase, PEPC)共表達用以構建乙酰輔酶A羧化旁路[15,74-75]。此外,Garg 等[44]利用反向β-氧化途徑成功在M. buryatense5GB1C 內構建了異源丁烯酸(crotonic acid)合成途徑,并在此基礎上進一步優化了異源基因表達的核糖體結合位點和啟動子、敲除磷酸轉乙酰酶基因pta以及過表達乙酰輔酶A合成酶將乙酸再循環為乙酰輔酶A,這些改造策略使該嗜甲烷菌人工細胞可以同時積累丁烯酸(70 mg/L)和丁酸(40 mg/L)[44,76-77],為甲烷基C4羧酸的合成提供了有效的策略。同樣,為了提高琥珀酸(succinic acid)產量,Nguyen等[56]通過引入異源異檸檬酸裂合酶(isocitrate lyase,Il)和蘋果酸合酶(malate synthase, Ms)用以分流乙醛酸并補充TCA循環中的蘋果酸鹽,從而成功將嗜甲烷菌絲氨酸代謝途徑中產生的草酸乙酸和乙酰輔酶A用于合成琥珀酸(圖2)。
近期,Henard 等[45]圍繞莽草酸途徑,利用13C代謝分析建立的基因尺度模型(genome-scale metabolic models, GSMs) 預 測 了M. alcaliphilum20Z 合成黏糠酸的競爭途徑。雖然基于模型分析結果敲除了丙酮酸脫氫酶(pyruvate dehydrogenase,Pdh)和莽草酸脫氫酶(shikimate dehydrogenase,Skd)編碼基因AroE,但黏糠酸的產量僅1.5 mg/g DCW,為預測產量值的6.5%。這可能是由于M.alcaliphilum20Z 中存在莽草酸合成的替代途徑或Skd 的同工酶,敲除競爭途徑并未能充分地將碳流轉向黏糠酸。值得一提的是,基因測序技術及組學(基因組學、轉錄組學、蛋白質組、代謝組)技術也為深入理解嗜甲烷菌的生理學基礎、細胞代謝和反應過程提供了新的方法[46,51,67,77-83]。在嗜甲烷菌中,由于中心代謝途徑與細胞內膜合成相關聯,因而能夠積累大量的長鏈脂肪酸(fatty acids)。Demidenko 等[46]利用轉錄組分析發現M.buryatense5GB1 菌株中脂肪酸降解、乙酰輔酶A和丙二酰輔酶A供給水平是提高脂肪酸產量的瓶頸,在敲除醋酸激酶和過表達乙酰輔酶A 羧化酶后,脂肪酸的積累量較原始菌株提高了20%。而Fei 等[84]則在上述研究的基礎上進一步敲除糖原、蔗糖-6-磷酸等競爭路徑基因,最終在高密度發酵條件下將長鏈脂肪酸的產率提高了3倍。上述研究成果充分說明利用組學數據進而確立代謝改造靶點,可在深入認識嗜甲烷菌的代謝系統及生化反應機制機理的同時,有效提高目標產物和合成效率。
2.2 萜類化學品
雖然在嗜甲烷菌體內有部分甲基赤蘚糖醇-4-磷酸(methylerythritol-4-phosphate, MEP)途徑或甲羥戊酸(mevalonate, MVA)途徑,但考慮到MEP 途徑擁有較高的IPP 的理論合成率,甲烷基萜類化學品主要通過改造和優化MEP 途徑實現[11,20,67]。Leonard 等[52]為了 強 化 IspS 催 化 活性,將葛根(Pueraria montana)中的IspS 經密碼子優化后,利用MDH 強啟動子在M. capsulatusBath 中表達并首次獲得了10 mg/L 異戊二烯。而Donaldson 等[85]試圖利用異源 IspS 以及異戊烯基焦 磷 酸 異 構 酶 (isopentenyl diphosphate isomerase, IDI)雙基因提高異戊二烯合成效率,但遺憾的是異戊二烯的產量僅為0.056 mg/L,這主要是由于雙基因表達效率及催化活性限制造成了該合成模塊較低的碳通量。整體來看,現階段嗜甲烷菌合成異戊二烯的研究主要集中于合成途徑構建,節點累積和輔因子及能量供給平衡等代謝改造策略的研究相對較少。
除了異戊二烯,檸檬烯(limonene)和法尼烯(Farnesene)等萜類化合物也是重要的精細化學品、香料、藥品的合成前體[86]。DiCosimo 等[59]利用pR58 載體,將異源檸檬烯合成酶(limonene synthase)在Methylomonassp.16a 菌株中表達,首次實現在嗜甲烷菌中累積0.5 mg/L 檸檬烯。而Nguyen 等[48]則 基 于M. alcaliphilum20Z 菌 株 中MEP 途徑的中間代謝物法尼焦磷酸(Farnesyl pyrophosphate, FPP),通過引入異源蛇麻烯合成酶(humulene synthase)Zssl[48,87],成功實現了蛇麻烯的從頭合成。圍繞過表達合成關鍵酶(IspA、IspG 及 Dxs)、重新定向 EMP 途徑、NADPH 輔因子再生、電子供應強化、基因尺度模型等策略,該研究首次對萜類化學品的合成途徑進行了系統的理性代謝工程改造和優化,最終將蛇麻烯產量提高到0.75 mg/g DCW,達到出發菌株的18.8 倍[67,81](圖 2)。角黃素(canthaxanthin)、蝦青素(astaxanthin)和番茄紅素(lycopene)[88]等類胡蘿卜素產物也可在嗜甲烷菌中實現生物合成[88],但產量仍有待進一步提高。
2.3 其他化學品
隨著可持續發展戰略的提出,生物醇類物質作為生物能源的前體,近年來備受工業界和科學界的關注[54,89-90]。研究人員結合基因尺度模型i20ZR-BDO的分析數據,預測了2,3-丁二醇(2,3-butanediol, BDO)合成過程的改造靶點,在累計敲除競爭途徑中的ldh、ack和mdh等基因后,將BDO 濃度提升到 86.2 mg/L[14]。為充分發揮基因尺度模型在嗜甲烷菌人工細胞設計、構建及優化中的重要作用,Nguyen 研究組又建立了基于尸胺(cadaverine)和腐胺(putrescine)生物合成的基因尺度模型,預測了關鍵代謝節點和終端產物的代謝工程改造靶點。通過過表達目的基因、敲除競爭途徑或強化產物分泌效率,有效地提高了碳通量,并最終分別將尸胺和腐胺的產量提高到283.64 mg/L[14]和 98.08 mg/L[49]。此外,與大腸桿菌及釀酒酵母相比,嗜甲烷菌在RuMP途徑代謝中更具優勢。研究人員通過將異源2-脫甲基4-脫氧葡萄糖醇合酶(2-demethyl 4-deoxygadusol synthase,DDGS)、氧甲基轉移酶(O-methyltransferase,OMT)、ATP-連接酶(ATP-grasp ligase)和丙氨酸連接酶(D-Ala-D-Ala ligase)整合到M.alcaliphilum20Z 中,成功設計并合成了具有防曬功能的類菌胞素氨基酸 Shinorine[91,92]。與此同時,研究人員基于銅、鈣等微量元素對MMO 及MDH 活性的影響機理,在微生物培養過程添加上述微量元素并利用操縱子計算器(operon calculator) 進一步優化了Shinorine 合成模塊,將產量提高到31 mg/L[39,78,93](圖 2)。上述基于系統生物學及合成生物學的代謝工程策略已廣泛應用于嗜甲烷菌人工細胞的構建和優化。
3 總結與展望
隨著全球甲烷供應量的增加,特別是天然氣和沼氣產量的提高[94-96],人們對甲烷的生物轉化利用產生了更廣泛關注。近年來,由于具有相對高效的甲烷固定途徑以及能夠實現高密度發酵,嗜甲烷菌作為甲烷轉化人工細胞在化學品合成中表現出了良好的應用前景[37,97]。利用其特有的甲烷氧化和同化系統,結合前沿的基因編輯工具及代謝途徑調控策略,目前已開發了不同類型和功能的嗜甲烷工程菌用于生物合成化學品,并展現出了獨特的優勢[15,67,98-99]。雖然通過代謝工程改造已實現多種甲烷基化學品生物合成,但目前嗜甲烷菌人工細胞相關研究仍然處在關鍵共性基礎技術的研發階段,在設計、構建和優化等方面仍然面臨很多挑戰[67,82,98,100-101]。
盡管基于嗜甲烷菌工業菌株已開發出多種基因操作工具,但相較于大腸桿菌和釀酒酵母等模式菌株,嗜甲烷菌中可用于人工細胞構建的生物技術仍十分有限,而針對外源基因在嗜甲烷菌人工細胞內穩定表達的基因轉化方法也亟需進行拓展。此外,嗜甲烷菌中電子傳遞系統、生物固氮/固硫機制、磷酸鹽代謝調控等關鍵科學問題的研究也有待探究。未來相關工作需進一步提高嗜甲烷菌基因尺度模型預測的準確性,并基于對代謝機制機理的探索,有針對性地改造和優化化學品合成路徑。同時,結合各類組學分析數據,從系統生物學角度加深對嗜甲烷菌細胞行為的認識,明確嗜甲烷菌特異性基因表達調控機制、甲烷代謝過程的酶活性以及代謝流分布,為高效關鍵基因元件挖掘和人工細胞構建提供理論指導,為甲烷的高效生物利用和化學品合成提供全新的研究思路和工業應用。
符號說明



