5-氨基乙酰丙酸生物合成技術的發展及展望
陳久洲,王鈺,蒲偉,鄭平,孫際賓
(中國科學院天津工業生物技術研究所,中國科學院系統微生物工程重點實驗室,天津 300308)
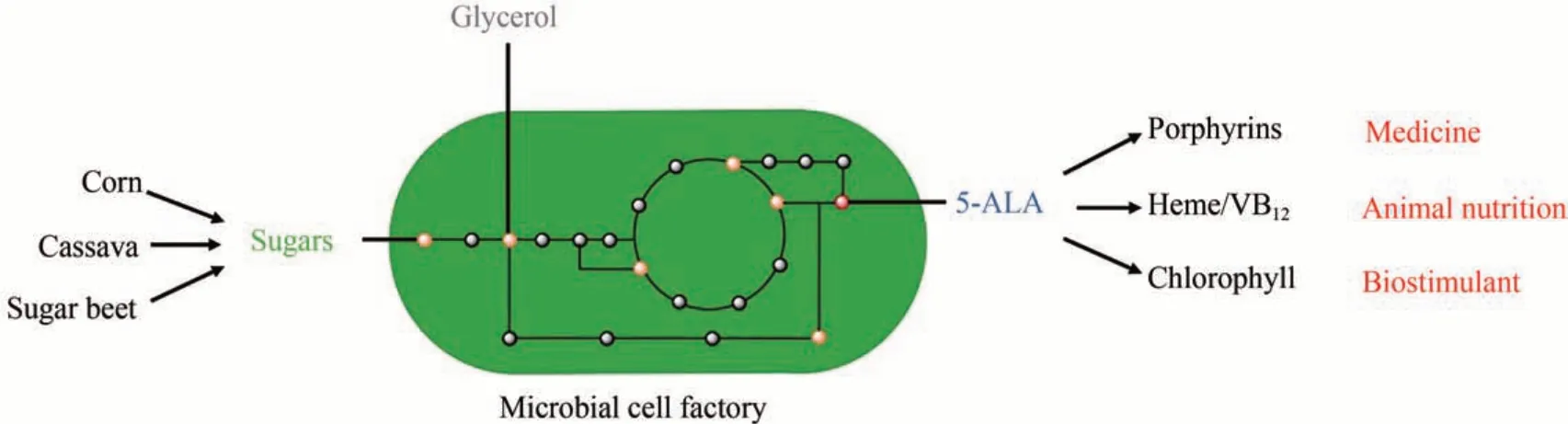
5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)是一種非蛋白質氨基酸,在生命體中廣泛存在,是血紅素、葉綠素、維生素B12等四吡咯化合物生物合成的必需前體。由于在生物體內所處的關鍵代謝節點及其下游代謝物的重要生理功能,5-ALA在醫藥、保健、動物健康和植物營養等方面具有重要的應用價值和廣闊的應用前景[1]。作為第二代光敏劑,5-ALA 從20 世紀90 年代就開始用于皮膚類疾病的光動力學治療以及癌癥的光動力學診斷和輔助切除[2-3]。基于血紅素和維生素B12在動物能量和物質代謝中的重要作用,外源補充5-ALA可以促進人體和畜禽的新陳代謝,增強機體活力和免疫力[4]。由于具有生物可降解和無毒無殘留的特性,5-ALA 還被用作綠色安全的植物生長調節劑,用于促進作物在逆境條件下的生長以及果實著色等[5]。廣闊的應用前景也吸引了研究人員不斷嘗試開發并改進5-ALA 的合成技術。目前,5-ALA 主要通過化學合成法生產,然而化學合成工藝的高復雜性和高污染限制了其工業化生產的規模,目前國內甚至沒有企業能夠一次性提供百公斤規模的產品;多步催化反應以及低產物收率也進一步推高了產品的生產成本,從而限制了其在各領域中的大規模應用推廣[6]。
生物體內有兩條5-ALA 生物合成途徑,即C4途徑和C5途徑,分別以琥珀酰輔酶A 和甘氨酸、谷氨酸為底物,通過一步或三步酶促反應合成5-ALA,然后再經過多步酶促反應生產血紅素等終產物(圖1)[7]。血紅素是胞內電子傳遞的載體以及多種酶的輔酶,對于細胞能量代謝至關重要,生物體進化出多種調控方式,以維持胞內血紅素的穩態[8]。由于5-ALA 是血紅素生物合成的必需前體,其生物合成也受血紅素的嚴緊調控。因此,盡管5-ALA 生物合成技術的研究幾乎與化學合成技術同時開始,但早期生物合成技術的水平很低,無法滿足產業化生產的要求。伴隨著生物技術的多輪重大變革,5-ALA 生物合成技術也不斷發展,技術水平得到了顯著的提升[9-14]。5-ALA 生物合成技術替代傳統化學合成技術,降低生產成本,并在農業和畜牧等領域大規模推廣應用已經是大勢所趨。本文以技術發展為主線,綜述了5-ALA 生物合成技術的發展歷程,詳細介紹了近年來系統代謝工程和合成生物技術對5-ALA 生物合成的重要推動作用,并展望了在合成生物技術時代5-ALA 的生物合成策略的發展方向。
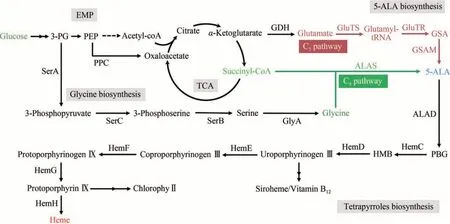
圖1 5-ALA及四吡咯化合物生物合成途徑Fig.1 Biosynthesis of 5-ALA and tetrapyrrole compounds
1 天然菌株誘變篩選
從20 世紀70 年代開始,研究者從自然界中篩選能夠天然高產5-ALA 的微生物,單細胞的藻類和光合細菌是主要的菌株種類。1970 年,Beale等[15]篩選到一株小球藻(Chlorella),可以利用CO2積累ALA,開啟了5-ALA 生物合成研究的序幕。1987—1998 年,Sasaki 等[6,16-17]篩選到一株類球紅細菌(Rhodobacter sphaeroides),通過大量發酵條件優化后,以琥珀酸和甘氨酸為底物合成5-ALA 的最高產量達到2.1 g/L。由于胞內嚴緊調控和自身代謝能力的限制,自然選育獲得的菌種產量普遍較低,且一般培養過程需要光照,工藝過程復雜,對裝備要求較高,產業化生產受限。
為了進一步提升菌種合成能力,誘變育種技術逐步用于ALA 高產菌株的篩選。1999—2002 年,Nishikawa 等[18-19]對前期自然選育獲得的類球紅細菌進行連續誘變育種,最終篩選得到一株高產ALA菌株CR-702,在好氧和無光條件下發酵74 h,5-ALA 產量達到了7.2 g/L。日本科斯莫石油公司利用上述菌種開發了工業化規模生產工藝,在5 t/a設施中5-ALA產量為10 g/L,并將生產成本降至化學合成法的1/10[20]。
盡管利用基于天然菌株誘變篩選的生物合成技術已經實現了5-ALA 的產業化,但是由于發酵周期較長,技術水平也相對較低,使得5-ALA 生產成本仍然較高,難以滿足農業和畜牧等低附加值領域的推廣應用。此外,誘變育種技術的自身限制也使得5-ALA 產量繼續提升的難度較大,隨著基因工程技術的出現和快速發展,這種傳統的微生物育種技術也逐漸被新興技術所取代。
2 利用重組外源C4途徑的E.coli 催化合成5-ALA
20 世紀90 年代以來,隨著基因測序和克隆表達技術的快速發展,異源酶在模式微生物中的表達技術日漸成熟。1996 年,van der Werf 等[21]首次將來源于類球紅細菌的5-ALA 合成酶(5-aminolevulinic acid synthase,ALAS)編碼基因在大腸桿菌(Escherichia coli)DH1 中克隆表達,開創了5-ALA 異源生物轉化的先河。通過外源添加前體物質琥珀酸和甘氨酸,利用表達異源ALAS的大腸桿菌合成5-ALA,也成為了這一時期5-ALA 生物合成的主要研究方向和常用技術手段。由于只涉及一步酶催化反應,ALAS 的表達是這一技術策略的核心要素。因此,在之后的近20年間,大量不同來源的ALAS被挖掘以期獲得更高的生產水平[22-28]。其中,浙江大學林建平研究團隊[26,29-33]通過不同來源ALAS 的篩選和表達優化,結合下游代謝抑制劑的添加和溶氧控制等發酵工藝優化,將基因工程菌株生產5-ALA 的最高產量提高到了9.4 g/L,而發酵周期只需要22 h。
利用重組外源C4途徑的菌株可以在更短的生產周期內,將5-ALA 的產量積累到10 g/L 左右,與前一階段的光合細菌相比具有顯著的優勢,展現了基因工程菌株的強大競爭力。然而,該技術策略前期只是關注天然酶源的挖掘和過表達,未能從調控層面解決酶受血紅素反饋抑制等問題,導致技術水平難以繼續提升。近年來,一些新的策略開始用于上述重組菌株的優化提升。Yu 等[34]利用TrxA 融合標簽,結合伴侶蛋白GroELS 的共表達,提高了可溶性蛋白的比例,5-ALA 產量從1.21 g/L 提高到了3.67 g/L,進一步優化發酵工藝后5-ALA 產量達到了5.66 g/L。針對ALAS 的酶學性質,本文作者團隊首次關注并挖掘鑒定了新型抗血紅素反饋抑制的ALAS——沼澤紅假單胞菌(Rhodopseudomonas palustris)來源的HemO,在野生型大腸桿菌MG1655 中表達后5-ALA 產量達到了6.3 g/L,與其他ALAS 相比具有明顯的優勢[35];進一步解除產物毒性的限制因素以后,5-ALA產量達到了11.5 g/L,突破了長期以來10 g/L左右的產量限制[36]。
盡管利用重組外源C4途徑的E. coli催化合成5-ALA 的技術已經取得了一定的研究進展,然而基于該技術的5-ALA 產業化生產規模還非常有限,原因主要在于其菌種水平仍然較低,底物琥珀酸和甘氨酸以及乙酰丙酸等下游代謝抑制劑的同時添加也使得該技術成本較高,工業放大穩定性差,難以大規模工業化應用。未來基于蛋白結構的ALAS 酶學性質的改造提升或將有助于進一步突破現有技術屏障,實現技術指標的繼續提升。
3 基于代謝工程的5-ALA 生物合成技術
1991 年,代謝工程概念的提出將基因工程技術的發展帶入了一個新階段,在此后的30 年間,系統代謝工程技術不斷完善,并實現了一大批生物能源和精細化學品的生物合成[37-38]。代謝工程技術在5-ALA 生物合成中的應用起步相對較晚,主要使用的菌種是大腸桿菌和谷氨酸棒桿菌(Corynebacterium glutamicum),特別是大腸桿菌因為遺傳背景相對清晰,分子操作手段和工具相對完善,成為該時期分子改造的主力菌種。2007 年,Shin 等[39]在引入異源 C4途徑的大腸桿菌中共表達蘋果酸酶,厭氧條件下通過TCA 還原臂以葡萄糖為底物提供琥珀酰輔酶A,5-ALA 的產量比出發菌株提高了50%,開創了基于代謝工程的5-ALA 生物合成新紀元。系統代謝工程技術強調途徑的整合構建以及細胞生理的系統分析和迭代改造,從細胞整體層面解析產物高產的限制,提升菌種的發酵性能。具體到5-ALA 高產菌株的構建,技術層面涵蓋了改造提升關鍵酶、重構優化合成途徑、強化前體供給、控制下游代謝、加速產物外排以及整體調控代謝通路等系統代謝工程的常用改造策略,構建了一系列菌種(表1)。
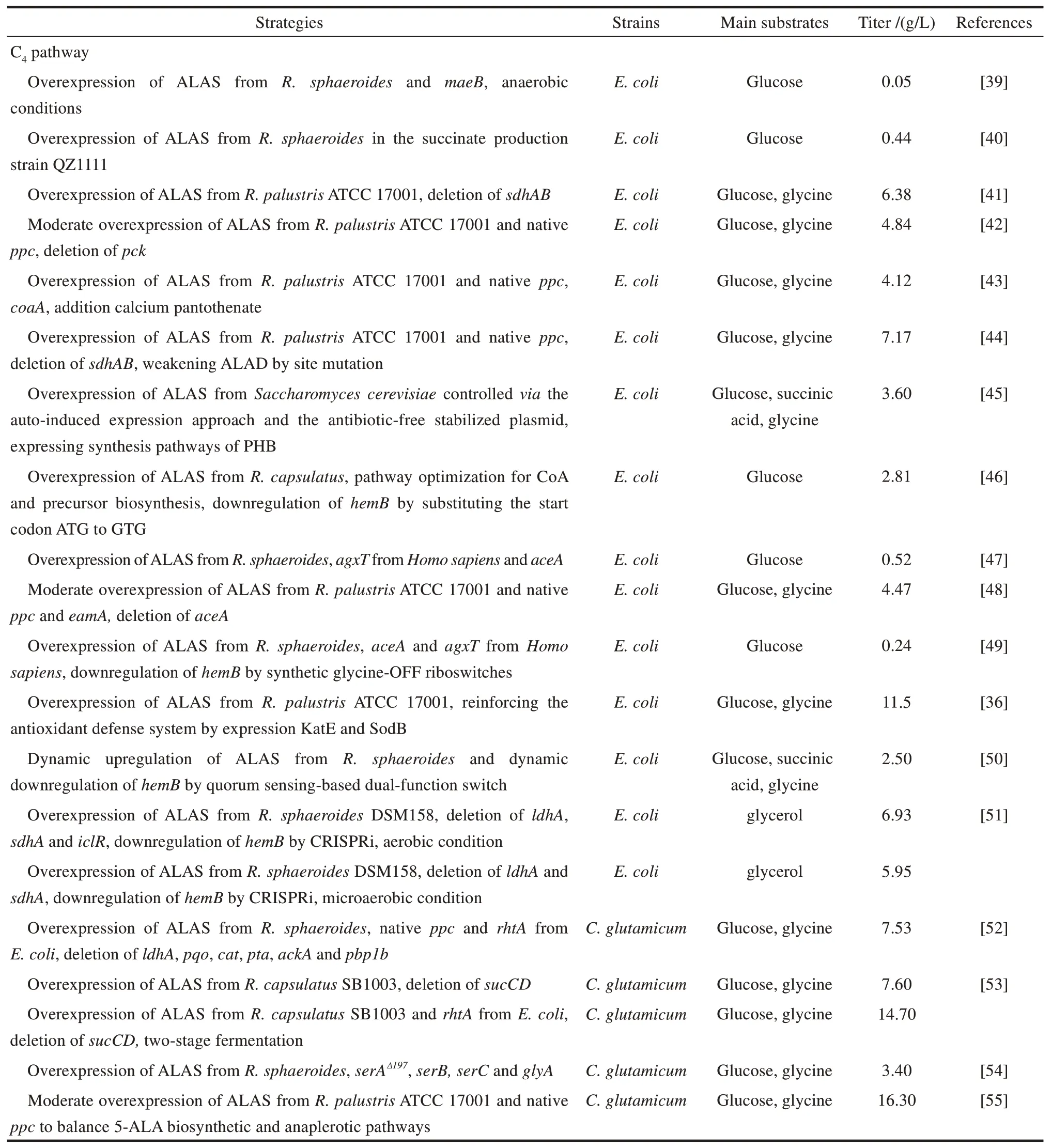
表1 利用代謝工程改造的大腸桿菌和谷氨酸棒桿菌合成5-ALATab.1 Bioproduction of 5-ALA by metabolically engineered E.coli and C.glutamicum
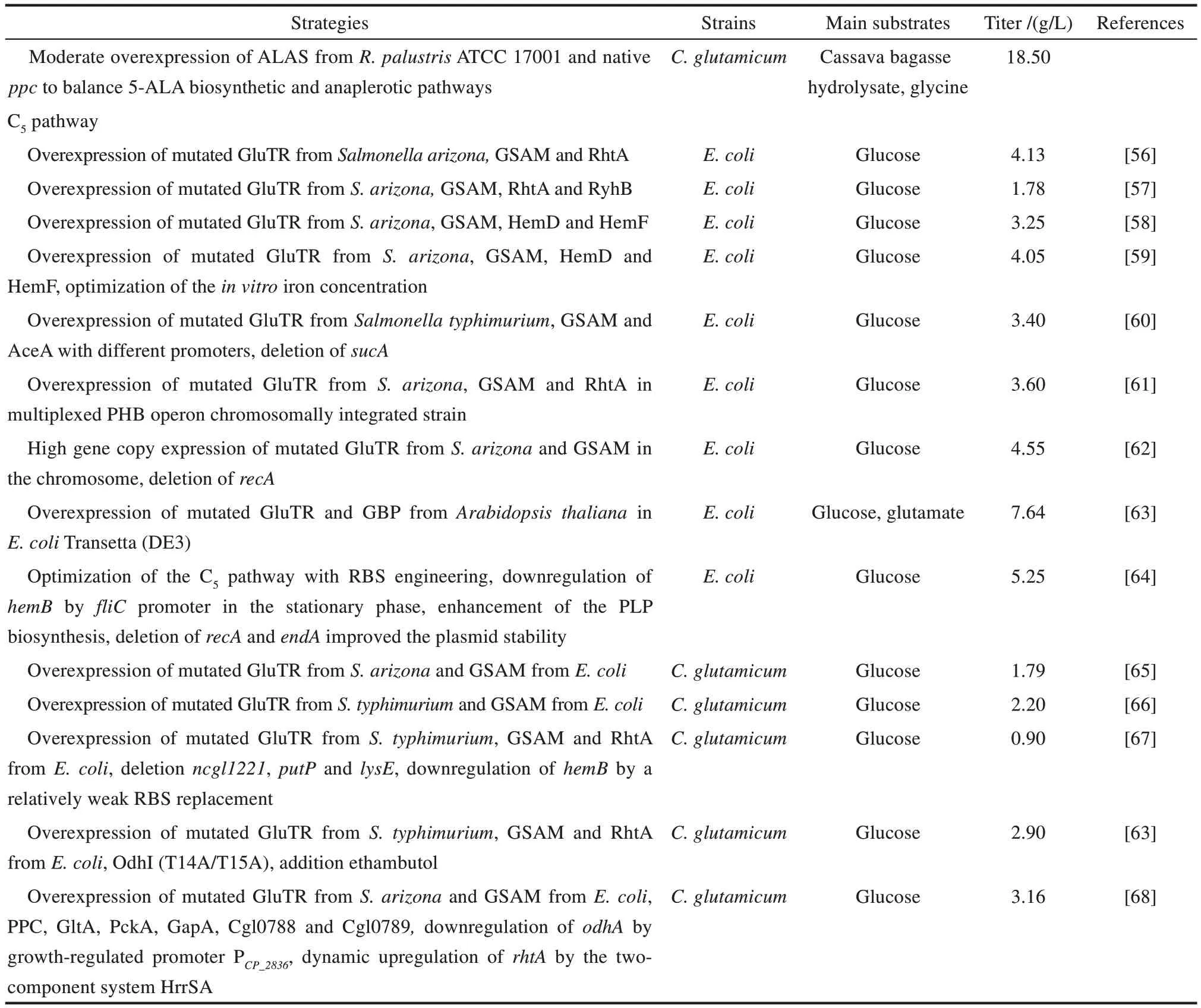
續表
3.1 5-ALA合成途徑關鍵酶的性能提升
合成途徑的關鍵酶具有良好的酶學性質和胞內活性,可以快速催化底物轉化為目標產物,并將代謝流持續引入產物的合成途徑,這是高效細胞工廠構建的關鍵。C4和C5途徑的關鍵酶ALAS和谷氨酰tRNA 還原酶(glutamyl-tRNA reductase,GluTR)不僅受到血紅素的反饋抑制,同時也存在蛋白不穩定的問題[8]。因此,上述兩種酶催化性質的提升和活性的維持也就成為5-ALA 細胞工廠構建需要解決的第1個關鍵問題。
盡管ALAS的蛋白結構很早就已經被解析并報道[69],但目前針對5-ALA 合成途徑關鍵酶改造的研究相對較少。作者團隊[70]基于本實驗室挖掘并解析的ALAS蛋白結構,借助計算機輔助的蛋白理性設計,對氨基酸序列中所有可能與血紅素相互作用的組氨酸殘基進行保守性分析和突變氨基酸預測,并通過定點突變和酶活檢測篩選獲得了熱穩定性明顯提高,且抗血紅素反饋抑制的新型ALAS突變體,在工程菌株中應用后5-ALA產量比對照菌株提高了22%。針對GluTR 受血紅素反饋調控的問題,前期研究發現N 末端結構域對沙門菌(Salmonella arizona)來源的GluTR 穩定性具有重要的作用,而在第2位蘇氨酸殘基后引入兩個帶正電的賴氨酸殘基可以明顯提高蛋白的穩定性,并表現出抗血紅素反饋調控的作用[71-72]。山東大學祁慶生團隊[56]首次在大腸桿菌中利用上述突變體重構了C5途徑,重組菌株5-ALA 產量是表達內源GluTR菌株的4倍。Zhang等[73]進一步研究了插入不同數量的陽離子氨基酸殘基(賴氨酸和精氨酸)對GluTR 蛋白穩定性和活性的影響,發現插入兩個精氨酸殘基的突變酶效果最好,表達上述突變酶的菌株5-ALA產量比對照菌株提高了76.8%。
3.2 5-ALA下游代謝調控
5-ALA 脫水酶(ALAD)是ALA 下游代謝的第1個關鍵酶,控制著下游的整體代謝通量,因此其編碼基因hemB成為下游代謝控制的主要靶點。前期的基因工程技術中5-ALA 的下游代謝控制主要通過添加ALAD 的抑制劑,成本高且增加工藝控制復雜度。進入代謝工程發展階段以后,通過調控hemB基因的表達或改變其酶活性降低5-ALA的下游代謝,逐漸成為主流技術手段。最直接的策略是完全阻斷5-ALA 的下游代謝,導致5-ALA積累。作者團隊[74-75]利用無痕敲除技術獲得了大腸桿菌hemB敲除菌株,但也帶來了菌株生長變弱的問題,研究人員對上述菌株進行紫外誘變,獲得了可以利用外源血紅素正常生長的突變菌株,引入異源ALAS后,建立了一條血紅素依賴型的5-ALA 的生物合成路線。另一個策略是弱化ALAD的表達或降低酶活性,減少5-ALA 的下游代謝。作者團隊[44]通過隨機突變和生長篩選獲得酶活下降的ALAD 突變體,將其回補hemB敲除后菌株生長基本恢復正常,5-ALA 產量也得到了明顯提升。隨著基因工程技術的不斷發展,研究人員進一步通過在ALAD 的C 末端添加蛋白降解標簽[65]、替換更弱的起始密碼子[46]或核糖體結合位點(RBS)[67]等方式,下調了ALAD 的表達量,提高了5-ALA產量。
此外,血紅素合成模塊的整體調控也被深入研究,以探尋提高5-ALA 產量的新靶點。Yu 等[76]利用轉錄組測序技術,研究發現5-ALA 的過量合成會上調TCA 循環、磷酸戊糖途徑以及血紅素合成途徑相關基因的表達,并啟動內源血紅素響應和調控機制,以降低中間代謝物以及血紅素的過量積累,這預示著下游代謝對5-ALA 的合成存在更復雜的調控作用。Zhang 等[58]在大腸桿菌中系統研究了血紅素合成途徑相關基因的表達對5-ALA 合成的影響,發現尿卟啉原Ⅲ合成酶(hemD基因編碼)過表達可以上調5-ALA 及血紅素合成途徑多個基因的表達,而糞卟啉原Ⅲ氧化酶(hemF基因編碼)過表達產生的原卟啉原Ⅸ則反饋抑制ALAD 的酶活,hemD和hemF共表達后5-ALA 產量從1.82 g/L 提高到了3.25 g/L。在此基礎上,研究人員通過優化外源鐵離子的添加量,組合調控了5-ALA 的合成及下游代謝,5-ALA 產量進一步提高到了4.05 g/L[59]。
3.3 基于C5途徑的代謝工程改造
鑒于大腸桿菌和谷氨酸棒桿菌通過內源的C5途徑合成5-ALA,因此基于C5途徑的代謝工程改造首先被關注。2011 年,山東大學祁慶生團隊[56]首次在大腸桿菌中對C5途徑進行改造和優化,通過共表達沙門菌(Salmonella arizona)來源的GluTR和內源GSAM,強化谷氨酸到5-ALA合成的代謝流,實現了以葡萄糖為碳源的5-ALA 生物合成,進一步研究發現過表達RhtA 可以促進5-ALA外排,5-ALA 產量達到了4.13 g/L。2015 年,利用谷氨酸棒桿菌為宿主通過強化C5途徑合成5-ALA的技術也被成功開發,通過組合表達不同來源的GluTR和GSAM,構建獲得的工程菌株最高產量達到了2.2 g/L[65-66]。
由于谷氨酸是C5途徑合成ALA 的直接前體,因此有研究者借鑒或者直接利用谷氨酸高產菌株和工藝控制,嘗試通過提高谷氨酸的積累量促進5-ALA 的合成。Zhang 等[67]通過敲除谷氨酸高產菌株S914 中的谷氨酸外排蛋白NCgl1221、精氨酸外排蛋白LysE 和脯氨酸外排蛋白PutP,減少了胞內谷氨酸的消耗,有效提高5-ALA 的產量。Ko等[77]將α-酮戊二酸脫氫酶抑制蛋白 OdhI 的第14 位和15 位蘇氨酸突變為丙氨酸,通過阻止其磷酸化以保持對α-酮戊二酸脫氫酶的抑制作用,過表達后使碳流更多地從TCA 循環進入谷氨酸合成途徑,提高了5-ALA 產量和轉化率。此外,上述兩項研究也證明在培養基中添加青霉素G、吐溫40 或乙胺丁醇等提高谷氨酸合成的策略同樣可以提高5-ALA的產量。
提高中心代謝進入谷氨酸合成途徑的代謝通量也是嘗試的策略之一。Li 等[57]發現在大腸桿菌中過表達一種鐵代謝調控相關的sRNA——ryhB,可以下調sdhCDAB(琥珀酸脫氫酶編碼基因)、hemB和hemH(亞鐵螯合酶編碼基因)的轉錄水平,同時上調gltX(谷氨酰tRNA合成酶編碼基因)的轉錄,提高了5-ALA 的產量,并降低血紅素的積累。Noh 等[60]在過表達 GluTR 和 GSAM 的大腸桿菌中敲除α-酮戊二酸脫氫酶編碼基因sucA,提高了碳流進入谷氨酸合成途徑的通量,進一步通過異檸檬酸裂解酶(aceA基因編碼)表達的精細調控強化乙醛酸循環,平衡了菌體生長和產物合成的代謝流,降低了乙酸的積累,5-ALA 產量達到了3.4 g/L,葡萄糖轉化率達到了0.28 g/g。
在上述策略的基礎上,江南大學康振團隊[64]以大腸桿菌為宿主對C5途徑進行系統代謝工程改造,組合GluTR 和GSAM 的精細表達調控策略、強化內源PLP 合成途徑的輔因子工程策略、基于生長時期調控的5-ALA 下游代謝弱化策略以及基于recA和endA缺失菌株的質粒穩定性改造策略,獲得的工程菌株在3 L 發酵罐中5-ALA 產量達到了5.25 g/L。Zhang 等[68]以谷氨酸棒桿菌為宿主,通過C5途徑構建和優化、ATP、NADPH、PLP 等輔因子合成途徑強化、TCA 循環弱化以及表達RhtA,將利用谷氨酸棒桿菌C5途徑合成5-ALA 產量提高到了3.16 g/L。Zhao 等[63]在大腸桿菌中引入擬南芥(Arabidopsis thaliana)來源的GluTR 及其激活蛋白GBP,搭建了外源C5合成途徑;通過優化宿主菌株,確定了補充6 個稀有密碼子tRNA的Transetta (DE3)菌株作為宿主5-ALA 產量最高,在培養基中添加前體谷氨酸后5-ALA 產量提高到了7.64 g/L。
3.4 基于C4途徑的代謝工程改造
雖然C4途徑合成5-ALA 的步驟簡單,然而由于涉及兩種底物的共同參與,因此基于C4途徑的代謝工程改造需要平衡多條代謝途徑,以確保琥珀酰CoA 和甘氨酸的有效供給。甘氨酸在生物體內存在多條生物合成途徑,具備通過代謝改造實現甘氨酸內源供給的可能性。2017 年,江南大學康振團隊[46]和Zou等[54]分別在大腸桿菌和谷氨酸棒桿菌中嘗試了通過強化常規的絲氨酸生物合成途徑以及絲氨酸到甘氨酸的轉化,希望達到部分或完全替代甘氨酸外源添加的目的。然而,上述改造獲得的菌株在不添加甘氨酸的條件下5-ALA整體產量較低(<3 g/L),也說明了利用內源甘氨酸合成和代謝調控的復雜性。因此,目前基于C4途徑合成5-ALA 的技術主要還是以外源添加甘氨酸為主。
琥珀酰輔酶A 是TCA 循環的中間代謝物,處于TCA 循環和5-ALA 合成的分支節點,強化琥珀酰輔酶A的供給可以通過ALAS將更多的代謝流引入5-ALA 合成途徑,并實現葡萄糖對琥珀酸的底物替代,因此大量研究關注如何提高琥珀酰輔酶A的合成通量。Kang等[40]在一株好氧條件下高產琥珀酸的代謝工程菌株中引入外源ALAS,實現了5-ALA 的合成。作者團隊[41]通過在大腸桿菌中敲除sucCD(琥珀酰輔酶A 合成酶編碼基因)或sdhAB,阻斷TCA 循環并增加琥珀酰-CoA 的供應,在不添加琥珀酸的條件下將5-ALA 的產量提高到了6.38 g/L;進一步研究發現在大腸桿菌中強化輔酶A 生物合成或弱化乙醛酸循環途徑,同樣可以提高琥珀酰輔酶A 的供給能力,有利于5-ALA 的生物合成[43,48]。Miscevic 等[51]對 ALAD 弱化菌株的TCA 循環進行代謝改造,在好氧條件下敲除sdhA,厭氧條件下敲除sdhA和iclR(乙醛酸循環抑制蛋白),增加前體琥珀酰輔酶A 的積累以及進入5-ALA 合成途徑的代謝通量,以甘油為底物在微氧和好氧條件下5-ALA 的產量分別達到了5.95 g/L 和6.93 g/L。山東大學祁慶生團隊[53]在谷氨酸棒桿菌中通過敲除sucCD強化了琥珀酰輔酶A胞內供給,補料分批發酵5-ALA產量達到了7.6 g/L;進一步過表達RhtA 強化5-ALA 外排,并利用“生長-產酸”兩階段發酵工藝將5-ALA 的產量提高到了14.7 g/L。
增加碳流從EMP 途徑進入TCA 循環的代謝通量,同時弱化乙酸等支路代謝途徑,對于提高以TCA 循環代謝物及其衍生物的產量至關重要[78-79]。作者團隊[42]首先關注了四碳回補途徑在5-ALA 合成中的應用,發現過表達ppc或pyc可以大幅提高5-ALA 的產量。天津大學王智文團隊[52]在谷氨酸棒桿菌中引入C4合成途徑,通過敲除乳酸和乙酸合成途徑,強化四碳回補途徑,提高了5-ALA 的合成能力;進一步敲除與細胞壁合成相關的青霉素結合蛋白,同時過表達5-ALA 外排蛋白RhtA,通過增加細胞壁的通透性,降低了產物在胞內的消耗,5 L 發酵罐中補料分批發酵5-ALA 的產量達到了7.53 g/L。作者團隊[80]對谷氨酸棒桿菌利用C4途徑合成5-ALA 的發酵工藝進行了全面優化,在5 L發酵罐中通過補料分批發酵將5-ALA 的產量提高到了10.1 g/L;進一步對在谷氨酸棒桿菌中引入的外源ALAS以及內源磷酸烯醇式丙酮酸羧化酶(ppc基因編碼)的表達進行精細調控,實現了外源途徑與底盤代謝的“精準匹配”以及前體供給樞紐節點代謝流的“精準分配”,優化后5-ALA 產量比出發菌株提高了45%,5 L 發酵罐中以葡萄糖為碳源5-ALA 產量達到了16.3 g/L;最后,研究人員進一步測試了木薯渣水解液、糖蜜等廉價粗原料的應用效果,發現木薯渣水解液的使用對5-ALA合成有明顯的促進作用,產量提高到了18.5 g/L,為目前已報道的5-ALA生物合成的最高產量[55]。
3.5 5-ALA與其他化合物的聯產
通過代謝途徑搭建,利用單個細胞同時合成兩種化合物,是一種有效降低生產成本的生物合成策略[81]。Li 等[45]在大腸桿菌中引入釀酒酵母(Saccharomyces cerevisiae)來源的ALAS,通過密碼子優化、表達強化、最適宿主篩選以及自誘導系統和質粒穩定系統改造,提高了5-ALA 合成能力;在此基礎上,研究者過表達聚羥基丁酸酯(poly-3-hydroxybutyrate,PHB)合成途徑的基因,實現了胞外5-ALA(1.6 g/L)和胞內PHB(43%)的聯產。Zhang 等[61]利用類似策略在大腸桿菌中組合C5途徑和聚羥基脂肪酸合成途徑,同樣實現了5-ALA(3.2 g/L)與PHB(38.2%)的協同生產。在上述體系中,PHB 途徑的引入可以降低5-ALA 合成的主要副產物乙酸的積累,并提高菌株的環境適應能力,而5-ALA 積累引起的高血紅素濃度可以強化呼吸鏈,提高能量合成和中心碳代謝的流量,促進PHB 的合成。5-ALA 與PHB 等胞內代謝物的協同生產可以進一步提高碳源利用率,降低產品綜合生產成本。
相對于基因工程技術中主要依賴于ALAS過表達的技術策略,基于系統代謝工程的多策略組合具有明顯的技術優勢,5-ALA 生物合成的障礙也逐步被發現和解除。經過大量的研究和菌種改造,5-ALA 的產量指標不僅提升到了近20 g/L 的水平[55],發酵工藝和底物也大幅簡化,避免了琥珀酸和抑制劑的添加,部分高水平技術體系已經具備了產業化生產的條件,為5-ALA 在農業等領域的大規模應用推廣奠定了重要的工作基礎。
4 合成生物元件和技術在5-ALA 生物合成中的應用
近年來,合成生物技術與代謝工程的深度融合為生物合成提供了強大的工具支持。2017 年以來,大量新元件和新技術在5-ALA 生物合成中成功應用,為5-ALA 生物合成技術的發展增加了新的動力。
4.1 新途徑設計
目前基于C4途徑的5-ALA 生物合成的技術水平具有明顯優勢,如果能夠避免甘氨酸的外源添加將進一步降低生產成本,然而內源供給甘氨酸的前期嘗試尚未能有效解決該問題[46,54]。人工途徑設計可以突破自然進化的限制,規避內源途徑的代謝調控,是合成生物學的重要研究領域之一,并已經在多種重要化合物的合成中成功應用[82]。Ren 等[47]根據化學結構的分解和重排,設計了從乙醛酸到甘氨酸的新型合成途徑,由于不涉及碳原子的損失,新途徑相對于內源甘氨酸合成途徑具有更高的原子經濟性(100 vs 67);研究者通過評價不同來源丙氨酸:乙醛酸氨基轉移酶的效果,確定了最適酶源,將上述途徑引入表達異源ALAS的大腸桿菌,同時強化aceA基因的表達,搭建了以葡萄糖為唯一碳源的新型前體供給途徑,5-ALA產量比出發菌株提高了38%,達到521 mg/L。雖然現有研究中人工途徑的合成能力還相對有限,但未來更多新酶設計并組合多水平調控元件的應用將會逐步展開,以更好地匹配5-ALA 的合成速度。
4.2 基因表達調控技術在5-ALA合成中的應用
關鍵基因表達的精細調控優化需要強度適宜的啟動子或RBS 等調控元件,或者借助CRISPRi(clustered regularly interspaced short palindromic repeats interference)等新型調控工具實現。挖掘或設計改造元件庫、開發調控工具也是合成生物技術重要的研究內容[83]。目前這些策略已經在5-ALA的生產菌株改造中廣泛使用。
調控元件方面,Noh 等[60]利用不同強度啟動子,在sucA敲除菌株中精細調控了aceA的表達,獲得了乙醛酸循環的最適強度,提高了菌體的生長及 5-ALA 的產量。江南大學康振團隊[46,64]利用RBS 工程策略,分別對ALAS 以及C5途徑基因的RBS 進行隨機突變和篩選,獲得了最優表達元件,進一步按照“高-中-低”的方式對不同基因的RBS元件進行隨機組合,獲得了最適于5-ALA 合成的組合。Chen 等[55]利用不同強度的 RBS 元件對ALAS 和磷酸烯醇式丙酮酸羧化酶的表達進行了精細調控,獲得了產物合成與中心代謝最優平衡菌株。
調控工具方面, 基于 CRISPRi 和 sRNA(small RNA)的基因表達調控技術的開發為基因表達調控提供了一種快速高效的操作工具,尤其是對生長必需基因的表達調控[84-85]。在5-ALA 的生物合成中,Su 等[86]首先利用CRISPRi 技術,通過靶基因內部及調控區不同結合位點的gRNA的設計,梯度弱化了大腸桿菌hemB基因的表達,轉錄水平下調為對照菌株的27%~82%,5-ALA 產量最高提高了5倍;該團隊進一步將血紅素響應和調控元件與CRISPRi 工具組合,通過ALAD 表達的動態調控平衡了 5-ALA 合成和菌體生長[87]。Miscevic 等[51]利用四環素誘導型啟動子控制的CRISPRi 系統,采用上述類似的策略,通過不同gRNA 設計調控了hemB的弱化程度,發現40%~67%的轉錄水平最利于5-ALA 合成,產量比對照菌株提高了4~5 倍。基于調控工具的基因表達調控不涉及基因組操作,可以更便捷地進行多水平的調控,并且更容易與其他調控元件組合,實現對目標基因更精細的表達調控。未來基于CRISPR-dCpf1 的多基因表達調控工具[88]也可以更方便地對多個基因靶點同時調控,以快速優化胞內復雜的代謝網絡。
4.3 動態調控技術在5-ALA生物合成中的應用
動態調控可以根據菌體生長及代謝的需求對胞內代謝流量進行精確的重新分配[89]。基于代謝物響應、群體感應、環境因素響應的動態調控策略已經日趨成熟,并用于平衡菌體生長和5-ALA的合成(圖2)。
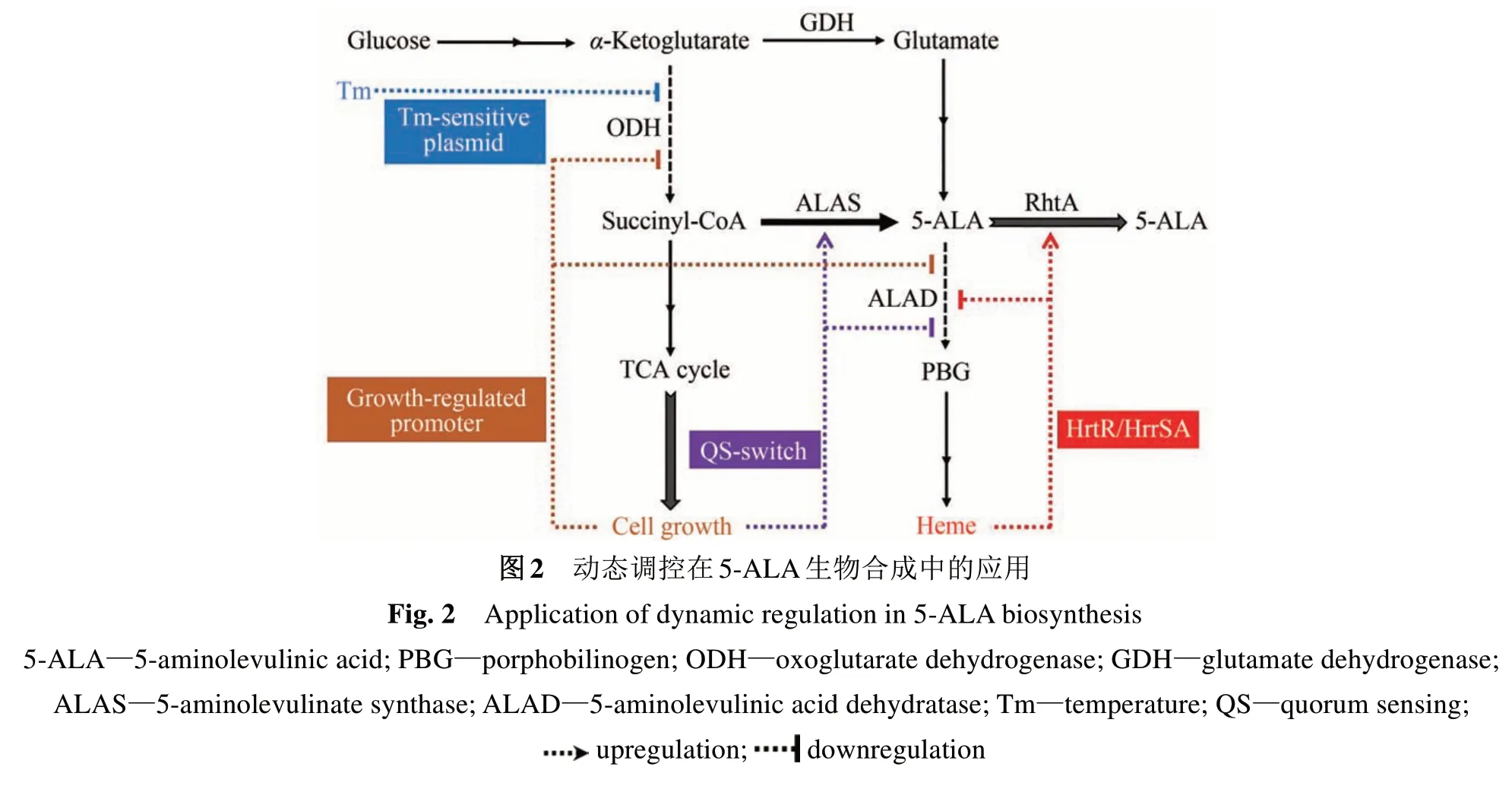
代謝物響應元件通常包括響應特定代謝物的轉錄調控因子-啟動子和核糖開關。目前,上述兩種元件在ALA 生物合成中均已經被開發和使用。Zhou 等[49]在巴氏梭菌(Clostridium pasteurianum)中鑒定了一種甘氨酸激活型核糖開關,并通過配體結合區功能分析和改造篩選,將其改造成為一種高效的甘氨酸抑制型核糖開關;利用上述元件在整合異源甘氨酸和C4途徑的大腸桿菌中調控ALAD的表達,構建了響應前體甘氨酸的動態調控回路,實現了5-ALA 產量11% 的提升。Zhang等[87]基于乳酸乳球菌(Lactococcus lactis)來源的血紅素響應轉錄調控因子HrtR 及其操縱區序列hrtO,開發了特異性響應胞內血紅素的生物傳感器;通過HrtR 與血紅素親和力的半理性設計和改造,獲得了不同響應范圍和靈敏度的元件;利用上述元件在C5途徑強化的大腸桿菌中通過CRISPRi 工具調控了ALAD 的表達(圖2),實現了胞內血紅素的穩態控制,5-ALA 產量最高達到了5.35 g/L,是組成型調控策略的2.2倍。
群體感應系統(quorum sensing,QS)主要通過感應細胞密度變化來調控基因的表達。近年來,基于QS 系統的合成生物學基因調控回路的構建和應用研究已經成為動態調控領域的新熱點[90]。在5-ALA的生物合成方面,Gu等[50]利用同時具有激活和抑制雙重調控功能的Eas-QS 系統,通過控制小分子感應物的合成速度并組合不同誘導啟動子,構建了一系列在不同生長時期啟動的雙功能動態調控開關,可以在不同時間和間隔同步調控不同基因的上調和下調;研究人員將上述調控開關用于ALAS 和ALAD 的動態表達調控(圖2),確定了最優元件組合,實現了前期菌體快速生長(上調ALAD,下調ALAS),而后期快速積累產物(上調ALAS,下調ALAD),ALA 產量比靜態調控的組合提高了12倍。
此外,生長時期調控型啟動子作為一種動態調控元件也已經用于5-ALA 合成途徑的優化。江南大學康振團隊[64]在大腸桿菌中利用一種穩定期下調的自誘導啟動子PfliC,替換了hemB基因的原始啟動子,實現了ALAD 在菌體生長階段的高表達以及進入穩定期后的快速下調(圖2),降低了發酵中后期5-ALA 下游途徑的代謝通量,促進了5-ALA 在發酵中后期的快速積累。Zhang 等[68]分別利用溫度敏感質粒和生長時期調控型啟動子PCP_2836調控了α-酮戊二酸脫氫酶的表達,通過溫度的變化或生長時期的自誘導作用,動態調控了TCA 循環進入谷氨酸合成的通量;同時借助谷氨酸棒桿菌內源血紅素響應和調控系統HrrSA,在高血紅素濃度條件下自動上調RhtA 的表達(圖2),實現了5-ALA 外排速度的動態調控,獲得了目前最優的基于C5途徑的谷氨酸棒桿菌5-ALA 高產菌株。
動態調控作為合成生物學的一項重要使能技術,比靜態調控和基于外源誘導劑的誘導型元件具有顯著的技術優勢和細胞經濟性。5-ALA 及其前體均處于菌體生長代謝的關鍵節點,因此高產菌株需要嚴格平衡菌體的生長和產物合成,未來動態調控在多靶點多水平的綜合應用將為5-ALA生物合成技術的發展提供強大的技術支持。
4.4 抗逆元件挖掘和應用
穩定高效的生物合成體系除了需要平衡高產菌株胞內代謝以外,還需要關注發酵過程中產物或有毒中間代謝物積累對菌體生理活性的影響。5-ALA 化學性質不穩定,中性或堿性pH 條件下容易兩分子縮合,產生環狀化學物和活性氧分子[91-93]。同時,發酵過程中5-ALA 下游代謝產生的卟啉類物質具有較強的光敏活性,過量積累也可能會對菌體造成嚴重的氧化損傷。作者團隊[36]通過大腸桿菌對高濃度5-ALA 耐受的機制研究,明確了活性氧是高濃度5-ALA 細胞毒性的主要物質;研究發現胞內抗氧化系統在高濃度5-ALA 脅迫條件下明顯上調,是菌體耐受高濃度5-ALA 的主要防御系統;通過功能基因元件篩選和驗證,確定了強化菌株的抗氧化系統可以有效提高工程菌5-ALA 的產量,其中組合表達過氧化氫酶KatE和超氧化物歧化酶SodB 的菌株5-ALA 產量提高了117%,為5-ALA 高效生物技術的開發提供了新策略和新元件。
4.5 非理性進化和快速檢測技術的開發
基于合成生物學元件的非理性進化和篩選技術可以在機制尚不清晰的情況下,快速提高產物產量,對新菌株的解析也有助于發現高產新機制。目前非理性策略在5-ALA 生物合成中的研究和應用還相對較少。
Cui 等[62]利用化學誘導的染色體進化技術(chemically induced chromosomal evolution,CIChE),將GluTR 和GSAM 編碼基因在大腸桿菌基因組上隨機多拷貝整合,獲得了不依賴于質粒的目標基因多拷貝表達菌株,結合recA敲除和菌株適應性進化,獲得的菌株ALA 產量達到了4.55 g/L。Tan等[94]利用CRISPRi 技術弱化大腸桿菌碳酸酐酶編碼基因can,構建了一種響應1%~5%濃度CO2的生物傳感器,并以此為基礎開發了一種針對CO2代謝相關酶的進化和檢測系統(direct enzymatic performance evaluation & determination system,DEPEND),利用上述系統可以快速識別具有更高ALAS 活性的菌株,為ALAS 的非理性進化篩選提供了重要的檢測技術。此外,該研究團隊還嘗試開發基于熒光蛋白的發酵過程5-ALA 快速定量檢測技術,研究人員利用相同啟動子在兩個質粒上分別表達ALAS 與綠色熒光蛋白GFP,通過檢測GFP 的熒光值確定體系中 5-ALA 的產量水平[95]。這也是首次利用活細胞生物傳感器原位在線檢測5-ALA 生物合成的嘗試,盡管該工具在使用過程中還受到pH 等因素的干擾,檢測時限也相對較短,但該研究為未來相關工具的開發和非理性進化篩選策略的實施提供了重要的參考。
近年來,合成生物技術的快速發展為5-ALA生物合成技術的開發提供了大量的新策略和新工具,盡管目前多數技術尚處于概念驗證及測試階段,但合成生物技術以其強大的顛覆性和創新性,未來必將有力地推動5-ALA 生物合成水平的快速提升。
5 總結與展望
5-ALA 是一種極具開發價值的生物基化學品,在動植物營養與健康等多方面具有重要的應用價值,未來市場潛力巨大,產業發展前景廣闊。然而,由于目前5-ALA 的工業化生產主要依賴于化學合成技術,成本高污染重,導致現有生產規模有限,產品價格昂貴,嚴重限制了其在各領域中的推廣應用。經過近50 年的發展,5-ALA 生物合成技術從最初利用自然篩選獲得的天然菌株,逐步過渡到了集成多種改造策略和合成生物學元件的高效人工細胞工廠,產量水平也從不足1 g/L 提高到了近20 g/L。部分高效菌種和成熟工藝已經或即將進入工業化生產,國內百公斤級規模的生產線也已經初步建立,大大降低了產品的生產成本和工藝的復雜性,為其在農業和畜牧業等領域的應用推廣奠定了重要基礎。然而,目前5-ALA 生物合成技術的產量水平與谷氨酸、琥珀酸等相關代謝物的生產水平相比還有較大的差距,未來5-ALA生物合成技術的發展仍將面臨較大的挑戰。
首先,5-ALA 合成水平的提升仍然需要持續解析諸多限制因素和復雜的調控機制,其中特別需要關注的是生物體內血紅素的穩態平衡和嚴緊調控,涉及關鍵酶的反饋調控、細胞基礎代謝的平衡以及底盤菌株的應激響應等多個方面,這也是限制5-ALA 合成的核心要素。未來綜合運用多種代謝工程策略、系統生物學分析手段和合成生物學工具,從理性設計和非理性進化篩選等不同維度突破5-ALA 合成和代謝的限制,才有可能實現5-ALA生產水平的跨越式提升。
其次,目前高水平的菌種和工藝都是基于C4途徑開發,且都依賴于甘氨酸的胞外添加,限制了產品成本的下降空間,甘氨酸高效胞內供給途徑的設計和創建是C4途徑未來研究的重點和難點;同時,盡管目前基于C5途徑技術水平仍然較低,但與C4途徑相比,C5途徑具有明顯的底物供給優勢,如何突破谷氨酸到5-ALA 的催化限制是C5途徑后續關注的重點。
此外,近年來CRISPR 等基因編輯技術的快速發展為基因組規模靶點的快速篩選和細胞工廠的快速構建提供了新型高效的技術手段,利用上述技術構建基因組規模菌株庫,結合菌株表型篩選技術的開發,也可以快速突破現有知識的認知[96-98],發現新的有利于5-ALA 生物合成的潛在靶點,助力菌種水平的進一步提升。
最后,盡管目前大腸桿菌和谷氨酸棒桿菌是用于5-ALA 合成的主流底盤菌株,具有不同生理特性的其他模式微生物或極端微生物,如釀酒酵母、鹽單胞菌(Halomonasspp.)等也已經陸續用于 5-ALA 生物合成的研究[45,99-101]。同時,隨著體外合成生物技術的快速發展[102],利用不依賴于細胞的體外多酶復合體系催化合成5-ALA 的研究也逐步開展[103-104]。
隨著系統生物學分析技術以及合成生物學使能技術的不斷發展,相信未來會有更多的新策略用于5-ALA 高產菌株的開發創建,低成本的綠色生物制造路線最終將助推5-ALA 在不同領域的大范圍推廣應用。

