大腸桿菌生產飼用氨基酸的研究進展
郭亮 ,高聰 ,柳亞迪 ,陳修來 ,劉立明
(1江南大學食品科學與技術國家重點實驗室,江蘇 無錫 214122;2江南大學國際食品安全聯合實驗室,江蘇 無錫214122)
隨著畜牧業的快速發展,人們對畜牧飼料蛋白的需求日益劇增。非洲豬瘟、瘋牛病目前沒有疫苗,倒逼養殖企業加強生物防控,減少甚至不用動物性蛋白,避免攜帶病毒[1]。眾所周知,蛋白質的營養實際上是由氨基酸提供,通過添加必要的氨基酸可以降低動物膳食中的粗蛋白水平,同時滿足動物營養需求[2-4]。在動物飼料中添加適宜含量的氨基酸,不僅可以最大限度地滿足動物的蛋白需求,調控動物的生長和飼料轉化率,而且大大降低粗蛋白用量,提高飼料利用率,節約飼養成本[5-8]。因此,研究人員發展了利用飼用氨基酸作為氨基酸添加劑,替代天然蛋白成分,生產配合飼料的方法。飼用氨基酸主要是指植物性飼料缺乏的必需氨基酸(如賴氨酸、甲硫氨酸、色氨酸、蘇氨酸)和一些小品種氨基酸(如纈氨酸和精氨酸)[9-12]。目前飼用氨基酸的生產方法主要有3 種:動植物提取、化學煉制和生物煉制[13-14]。由于動植物提取的原料受限、生產工藝復雜、生產成本高、環境污染大等缺點,在工業上未得到廣泛應用[15-16]。化學煉制具有原料不可再生、反應步驟多、伴有副反應發生、反應條件苛刻、安全性低差等問題,在實際生產中被逐漸淘汰[17]。依靠微生物為基礎的生物煉制,不僅利用可再生生物質資源為原料,而且具有成本低廉、產品純度高、反應條件溫和、環境污染小等優勢,為解決動植物提取和化學煉制中的問題提供了一種有效解決方案,因而被廣泛應用于飼用氨基酸生產[18-27]。
由于大腸桿菌遺傳背景清晰、生長迅速與培養簡單,成為了研究最為廣泛和深入的模式微生物[15,28]。利用合成生物學技術,改造大腸桿菌細胞構建的細胞工廠,利用生物質為原料可綠色高效合成飼用氨基酸[20,29-34]。本文重點關注了賴氨酸、甲硫氨酸、色氨酸等飼用氨基酸的生物合成途徑,介紹了大腸桿菌合成飼用氨基酸的生產瓶頸,綜述了大腸桿菌細胞工廠合成飼用氨基酸的研究進展,并展望了未來飼用氨基酸菌株改造的重點方向。
1 天冬氨酸族氨基酸大腸桿菌細胞工廠
1.1 天冬氨酸族氨基酸的生物合成途徑
由于天冬氨酸是賴氨酸、蘇氨酸和甲硫氨酸共同前體,因此,將賴氨酸、蘇氨酸和甲硫氨酸統稱為天冬氨酸族氨基酸。賴氨酸具有增強動物食欲、增強抗病能力和促進外傷治愈的作用。賴氨酸是植物性飼料中最缺乏的一種氨基酸,分別是豬和禽類飼料的第一與第二限制性氨基酸;蘇氨酸是繼賴氨酸和甲硫氨酸之后家禽飼料中的第三限制性氨基酸;甲硫氨酸是家禽的第一限制性氨基酸,豬的第二限制性氨基酸[5-8]。
葡萄糖經糖酵解途徑形成的丙酮酸,經羧化反應生成草酰乙酸,草酰乙酸在天冬氨酸氨基轉移酶(AAT)的作用下形成天冬氨酸[35]。如圖1所示,天冬氨酸經天冬氨酸激酶(AK Ⅰ、AK Ⅱ或AK Ⅲ)和天冬氨酸半醛脫氫酶(ASD)催化生成天冬氨酸半醛。天冬氨酸半醛,一方面經過二氫吡啶二羧酸合酶(DS)、二氫吡啶二羧酸還原酶(DR)、四氫二吡啶琥珀酰酶(THS)、N-琥珀酰二氨基庚二酸氨基轉移酶(SDAT Ⅰ、SDAT Ⅱ)、N-琥珀酰二氨基庚二酸脫琥珀酰酶(SDD)、二氨基庚二酸差向異構酶(DE)與二氨基庚二酸脫羧酶(DDC)催化合成賴氨酸,另一方面天冬氨酸半醛經高絲氨酸脫氫酶(HD Ⅰ、HD Ⅱ)脫羧形成高絲氨酸[3]。高絲氨酸經高絲氨酸激酶(HK)和蘇氨酸合酶(TS)催化形成蘇氨酸[36-37],經O-琥珀酰高絲氨酸轉琥珀酰酶(HST)、琥珀酰高絲氨酸裂解酶(SHL)、胱硫醚β-合成酶(CL)、半胱氨酸甲基轉移酶(HMT Ⅰ、HMT Ⅱ)催化形成甲硫氨酸[38-40]。
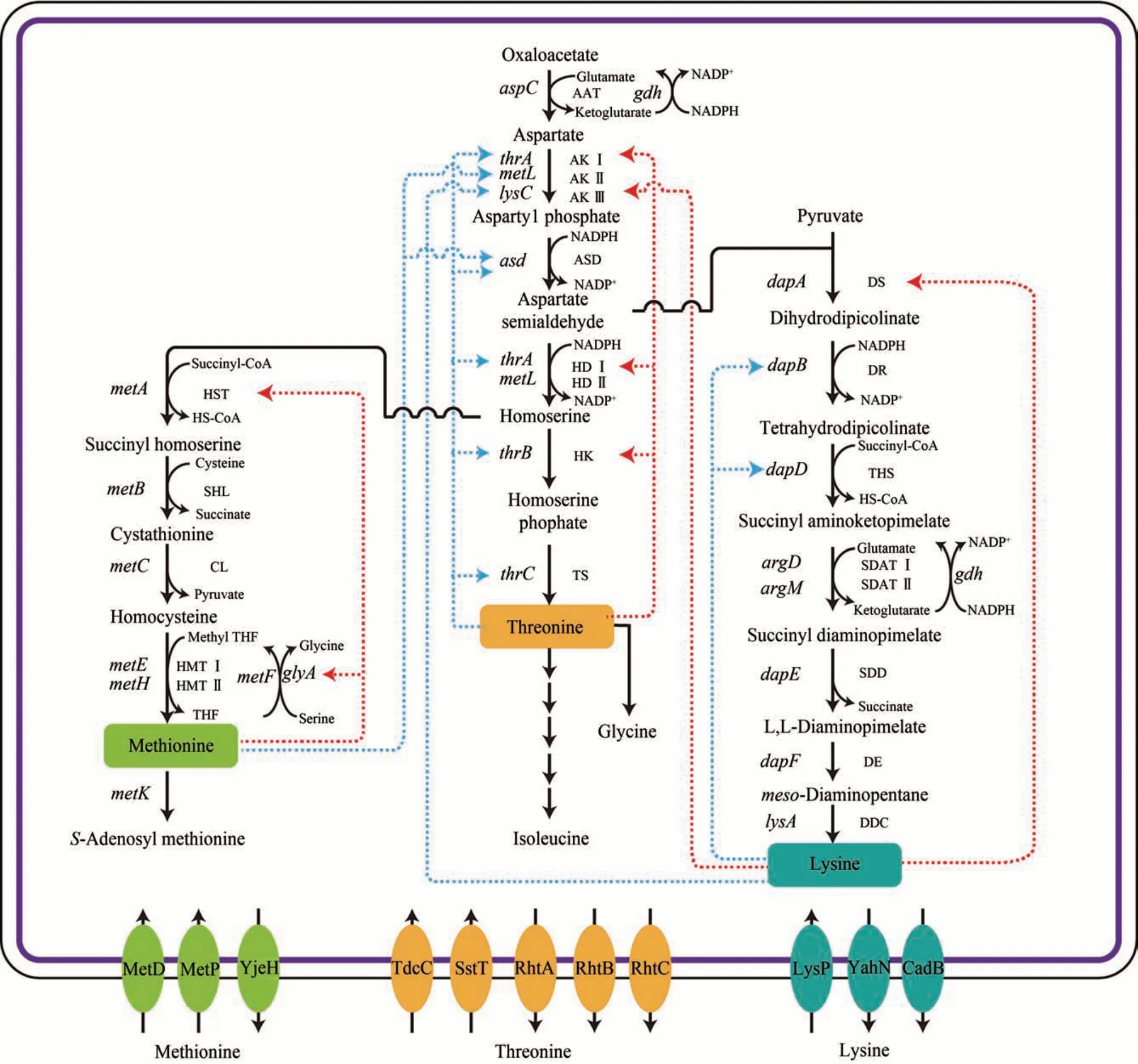
圖1 大腸桿菌天冬氨酸族氨基酸的合成路徑及其反饋調節示意圖Fig.1 Metabolic pathways of aspartate family amino acids and feedback regulations involved in E.coli
大腸桿菌細胞工廠合成天冬氨酸族氨基酸主要存在以下問題:①天冬氨酸族氨基酸生物合成途徑的關鍵酶受到反饋抑制和反饋阻遏,例如天冬氨酸激酶同工酶AK Ⅰ(thrA)、AK Ⅱ(metL)和AK Ⅲ(lysC)分別受蘇氨酸、甲硫氨酸和賴氨酸反饋調節[35,41];②從天冬氨酸合成 1 mol 蘇氨酸、1 mol 賴氨酸和1 mol 甲硫氨酸,分別需要3 mol、4 mol和3 mol的NADPH,在合成過程中可能導致還原力不平衡[35,42];③大腸桿菌內源的賴氨酸、蘇氨酸和甲硫氨酸的合成路徑之間,競爭代謝流,減弱了合成目標化學品的代謝流[3];④大腸桿菌存在本源賴氨酸和蘇氨酸的分解途徑,可能會分解賴氨酸和蘇氨酸[35];⑤在大腸桿菌細胞內合成的氨基酸如何有效分泌到胞外[35,43-46]。
1.2 賴氨酸大腸桿菌細胞工廠的構建與優化
研究人員在E.coliΔmetΔthr(CCTCC M2013239)菌株中,過表達磷酸烯醇式丙酮酸羧化酶(Ppc)、吡啶核苷酸轉氫酶(PntB)、天冬氨酸酶(AspA),構建了合成賴氨酸的底盤微生物E. coliNT1003,在最優發酵條件下賴氨酸產量為134.9 g/L,葡萄糖得率為45.4%[47]。近年來,圍繞大腸桿菌細胞工廠生產賴氨酸的研究工作集中在增加前體供應[48]、解除賴氨酸對關鍵酶的反饋抑制[49]和適應性進化等策略[50]。草酰乙酸是合成賴氨酸等天冬氨基酸族氨基酸的重要前體物質,減少支路代謝消耗草酰乙酸的羧化反應與增強合成草酰乙酸的羧化反應,可以增加前體草酰乙酸的供應[48,51]。例如,過表達大腸桿菌本源的磷酸烯醇式丙酮酸羧化酶(Ppc),增強合成草酰乙酸的羧化反應,使賴氨酸的產量增加22.22%[48]。在大腸桿菌中引入谷氨酸棒桿菌來源的磷酸烯醇式丙酮酸羧化酶(Ppc),同時敲除丙酮酸激酶(PykA 和PykF),實現了天冬氨酸的積累,在此基礎上,進一步敲除天冬氨酸氨裂解酶(AspA)和蘋果酸脫氫酶(Mdh),使賴氨酸前體天冬氨酸的積累量增加到6.95 mmol/L[51]。解除賴氨酸對關鍵酶的反饋抑制可以強化賴氨酸合成路徑效率。例如,通過比對谷氨酸棒桿菌和大腸桿菌二氫吡啶二羧酸合酶(DS)的序列和結構,將谷氨酸棒桿菌DS 抑制劑結合位點周圍的殘基,引入到大腸桿菌DS 中,減弱了賴氨酸對DS的反饋抑制,使賴氨酸得率增加45%[49];通過將天冬氨酸激酶(AK Ⅲ,由lysC編碼)第344 位的氨基酸殘基由蘇氨酸(T)替換為甲硫氨酸(M),減弱了賴氨酸對天冬氨酸激酶的反饋抑制,通過將二氫吡啶二羧酸合酶(DS,由dapA編碼)第56位的氨基酸殘基由組氨酸(H)替換為賴氨酸(K),減弱了賴氨酸對DS 的反饋抑制,將突變體lysCT334M和dapAH56K引入到工程菌E. coliLATR11(E. coliMG1655 衍生菌株)中,使賴氨酸的產量增加了63%[48]。適應性進化是指微生物種群在一定選擇壓力條件下不斷進化,從而獲得理想表型的方法[52]。為了進一步提高大腸桿菌細胞工廠賴氨酸的生產性能,Wang 等[50]利用突變的 DNA 聚合酶校對元件(DnaQ),搭建了一個基因組復制工程輔助連續進化系統(GREACE),使隨機突變率提高了317 倍。并利用GREACE 技術,篩選到突變體E.coliRS3,使賴氨酸產量提高了14.8%,增加到155 g/L。利用代謝組學和基因組學技術,對突變菌株E.coliRS3進行分析,發現突變菌株主要通過瓜丁胺酶(SpeBA302V)、 ATP 合酶亞基(AtpBS165N)和前蛋白轉位酶(SecYM145V)的突變,改善細胞在應激條件下的完整性和強化賴氨酸合成的代謝通量。本研究團隊[53]在前期誘變育種獲得賴氨酸生產菌株E.coliCCTCC M2019435的基礎上,基于酶約束模型ec_iML1515,預測出20 個合成賴氨酸的關鍵靶點(靶點分布在前體物質積累、產物合成路徑強化和能量供給)。并通過實驗對靶點進行篩選,發現過表達二氫硫辛酰胺脫氫酶、黃素還原酶、乙酰輔酶A合成酶、二氨基二甲酸脫羧酶、天冬氨酸激酶,使賴氨酸產量分別提高了63.8%、108.7%、55.6%、50.0%和123.6%。在此基礎上,利用動態FBA 的模擬,將發酵周期縮短了47.7%,使賴氨酸產量增加至193.6 g/L(表1)。
1.3 蘇氨酸大腸桿菌細胞工廠的構建與優化
研究人員在篩選得到E.coliTWF001(CCTCC M2017730)菌株中,通過敲除轉錄因子IclR,在基因組上用trc啟動子強化異檸檬酸裂解酶(AceB)、蘋果酸合酶(AceA)和天冬氨酸轉氨酶(AspC)的表達,獲得合成蘇氨酸的底盤微生物E. coliTWF006,使蘇氨酸的產量增加到12.1 g/L[41]。為了進一步提高蘇氨酸的產量,發展了強化蘇氨酸合成路徑[41]、阻斷冗余代謝支路[54,71]和輔因子工程[55]等策略。例如,在E.coliTWF006中過表達高絲氨酸激酶(ThrB)、蘇氨酸合酶(ThrC)、天冬氨酸半醛脫氫酶(ASD)和抗反饋調節的天冬氨酸激酶(ThrA),強化蘇氨酸合成路徑,使蘇氨酸產量增加了31%,達到15.85 g/L[41]。張雪等[54]將天冬氨酸激酶(ThrA)第345位的色氨酸殘基突變為苯丙氨酸殘基,解除了蘇氨酸對天冬氨酸激酶的反饋抑制,使蘇氨酸的產量增加了2.56 倍。在蘇氨酸合成路徑中,阻斷冗余代謝支路包括敲除lysA(二氨基庚二酸脫羧酶編碼基因),阻斷賴氨酸的合成;敲除metA(O-高絲氨酸琥珀酰轉移酶編碼基因),阻斷甲硫氨酸的合成;敲除tdh(蘇氨酸脫氫酶編碼基因),阻斷蘇氨酸向甘氨酸轉化;將ilvA(蘇氨酸脫水酶編碼基因)的第290 位堿基由C 替換為T,降低蘇氨酸脫水酶催化活性減少蘇氨酸向異亮氨酸的轉化[71]。輔因子工程策略可以改善蘇氨酸合成過程中NADPH 的供給,維持高效的代謝合成路徑。例如,Li 等[55]在E.coliTHRD(TCCC 11825)發酵過程中,發現甜菜堿通過促進6-磷酸葡萄糖脫氫酶編碼基因(zwf)的轉錄,增加了6-磷酸葡萄糖脫氫酶的活性,強化輔因子NADPH 的供給,使蘇氨酸產量增加13.3%,達到117.1 g/L。此外,研究人員還提出了平衡代謝流分配策略[36]和兩階段調控策略[56],改善蘇氨酸生產。Fang等[36]在工程菌E. coliTWF001 中,利用溫度敏感性調控元件和阻遏蛋白,建立了溫控調節開關,調控丙酮酸羧化酶(PYC)的表達,實現碳流在丙酮酸和草酰乙酸之間的轉換。在發酵前期,將溫度控制在37 ℃,關閉PYC 表達,使碳流充分進入TCA 循環用于生長;在發酵后期,將溫度提高到42 ℃,開啟PYC 表達,讓丙酮酸經PYC 羧化合成草酰乙酸合成蘇氨酸,使蘇氨酸對葡萄糖的得率達到 124.03%。Liu 等[56]將工程菌E.coliTHRD 的發酵過程分為細胞生長階段和產物合成階段,并利用基因開關實現工程菌兩階段轉換。在細胞生長階段,過表達丙酮酸羧化酶、磷酸烯醇式丙酮酸羧激酶與檸檬酸合成酶,增加糖酵解途徑到TCA 途徑的碳通量,從而增加葡萄糖利用和改善細胞生長。在產物合成階段,通過基因開關將碳流導向蘇氨酸合成路徑,同時表達谷氨酸脫氫酶、甲酸脫氫酶和吡啶核苷酸轉氫酶,構建谷氨酸和NADPH 再生成系統,為蘇氨酸合成提供底物和輔因子,最終使蘇氨酸產量增加了2.02倍(表1)。

表1 大腸桿菌細胞工廠生產飼用氨基酸進展比較Tab.1 Comparison of feed amino acid production by E.coli cell factories
1.4 甲硫氨酸大腸桿菌細胞工廠的構建與優化
Huang 等[38]以 W3110 為出發菌株,通過敲除負轉錄因子(MetJ),過表達O-琥珀酰高絲氨酸轉琥珀酰酶(MetA)和甲硫氨酸轉運蛋白(YjeH),構建了合成413.16 mg/L 甲硫氨酸的底盤微生物W3110 ΔmetJ/pTrcA*H。在甲硫氨酸生物合成途徑中,甲硫氨酸的C4骨架、硫和甲基分別由O-琥珀酰高絲氨酸、半胱氨酸與甲基四氫葉酸提供。因此,強化甲硫氨酸前體供應,可以提高甲硫氨酸大腸桿菌細胞工廠的生產性能,例如可以通過上調O-琥珀酰高絲氨酸轉琥珀酰酶、解除甲硫氨酸的反饋調節、阻斷賴氨酸與蘇氨酸的支路代謝,增強 C4骨架O-琥珀酰高絲氨酸的供應[38,57];通過硫源優化,可以強化硫供體半胱氨酸的供應[38];通過敲除purU或者外源添加甘氨酸,可以增加甲基供體甲基四氫葉酸的供應[57]。Tang等[57]在工程菌E. coliW3110 IJAHFEBC(W3110 ΔmetI ΔmetJ ΔlysA Trc-metH Trc-metF Trc-cysE Trc-serB Trc-serC)中,過表達O-琥珀酰高絲氨酸轉琥珀酰酶,增加O-琥珀酰高絲氨酸的供應,使甲硫氨酸的產量從2.8 g/L 增加到3.22 g/L。同時,在發酵過程中添加甲基供體甘氨酸,使甲硫氨酸的產量增加到3.96 g/L。 Huang 等[38]在 工 程 菌E. coliW3110 ΔmetJ/pTrcA*H 中,敲除轉錄因子metI阻斷甲硫氨酸內轉運系統MetD,使甲硫氨酸的產量增加43.65%。同時,敲除二氨基庚二酸脫羧酶編碼基因(lysA)阻斷賴氨酸合成路徑,使甲硫氨酸的產量增加8.5倍。在此基礎上,通過外源添加Na2S2O3增加硫的供應,使甲硫氨酸的產量增加11.45%,再通過發酵工藝優化使甲硫氨酸的產量進一步增加到 9.75 g/L。Li 等[58]以 W3110 為出發菌株,通過敲除二氨基庚二酸脫羧酶編碼基因(lysA)、高絲氨酸激酶編碼基因(thrB)、蘇氨酸合酶編碼基因(thrC),阻斷甲硫氨酸的競爭代謝路徑。然后,敲除負轉錄調控因子編碼基因(metJ),下調甲硫氨酸抑制因子編碼基因(metK)的表達,并利用pN25 啟動子強化琥珀酰高絲氨酸裂解酶(MetB)的表達,強化甲硫氨酸合成路徑,獲得工程菌E. coliMe05,在此基礎上,過表達甲硫氨酸合酶(MetE 和MetH)和5,10-亞甲基四氫葉酸還原酶(MetF),獲得合成甲硫氨酸的工程菌E.coliMe05(pETMAFbr-B-Y/pKKmetH),使甲硫氨酸的產量增加到5.62 g/L。隨著研究的深入,發現僅僅依靠單因素疊加調控,無法實現甲硫氨酸代謝通量的最大化,基于模塊組合的多層次調控策略可能更具合理性,例如 Huang 等[39]首先,采用 CRISPRi 技術,對合成甲硫氨酸底盤微生物的中心代謝路徑和氨基酸合成路徑中80 個靶點基因進行調控,獲得控制甲硫氨酸合成的關鍵靶點。然后,根據甲硫氨酸生物合成的復雜性和多層次性,提出了基于分支途徑功能的模塊化策略,將甲硫氨酸生物合成路徑分為碳模塊、硫模塊和一碳模塊。并利用篩選到的關鍵靶點對這些模塊進行調控,逐步提升甲硫氨酸的產量,最終使甲硫氨酸的產量增加到16.86 g/L(表1)。
2 色氨酸大腸桿菌細胞工廠
2.1 色氨酸的生物合成途徑
作為一種必需氨基酸,L-色氨酸在人類與動物的生長發育過程中起著重要作用,被廣泛應用于食品、醫藥與飼料添加劑等領域。色氨酸具有特殊的結構,其代謝產物不僅參與體內多種生理、營養、代謝過程,也參與體內蛋白質合成的調節[5-8]。在大腸桿菌細胞中,色氨酸的合成路徑由中心代謝途徑、莽草酸途徑和色氨酸分支途徑組成[72-74]。中心代謝途徑是指葡萄糖經糖酵解途徑(EMP)和戊糖磷酸途徑(HMP),形成的磷酸烯醇式丙酮酸(PEP)與赤蘚糖-4-磷酸(E4P),在3-脫氧-D-阿拉伯庚酮糖-7-磷酸(DAHP)合酶(AroG)的催化下縮合形成DAHP 的過程。莽草酸途徑是指DAHP 經過3-脫氫奎寧酸合酶(AroB)、3-脫氫奎寧酸脫水酶(AroD)、莽草酸脫氫還原酶(AroE)、莽草酸激酶(AroK)、5-烯醇式丙酮酰胺莽草酸合酶(AroA)、分支酸合酶(AroC)催化形成分支酸的過程。色氨酸分支途徑是指分支酸經鄰氨基苯甲酸合酶(TrpE)、鄰氨基苯甲酸焦磷酸轉移酶(TrpD)、鄰氨基苯甲酸異構酶(TrpC)、色氨酸合酶(TrpB)、吲哚甘油3-磷酸(TrpA)作用形成色氨酸的過程[73,75-76](圖2)。
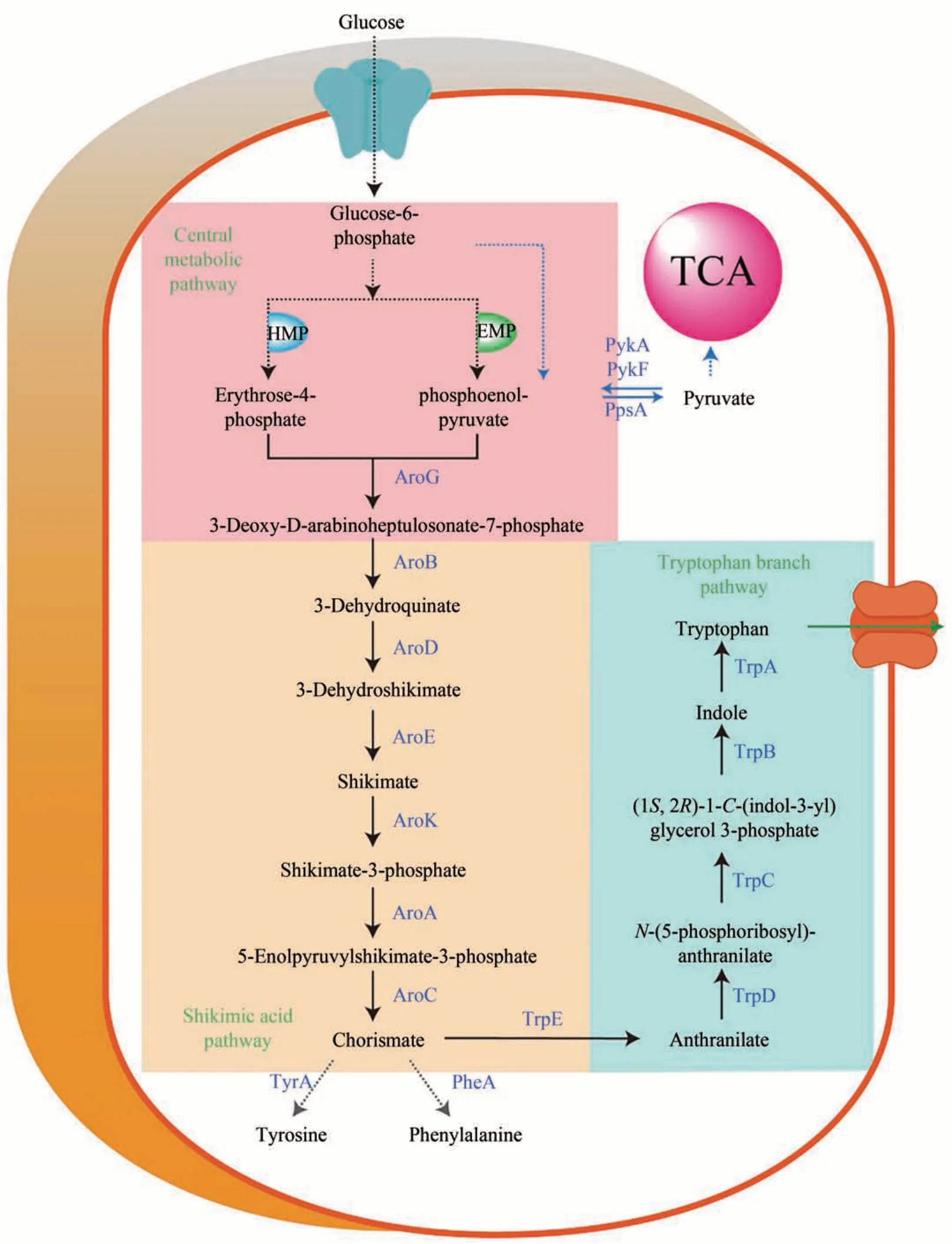
圖2 大腸桿菌色氨酸合成代謝路徑Fig.2 Schematic of the tryptophan biosynthetic pathway in E.coli
大腸桿菌細胞工廠合成色氨酸主要存在以下瓶頸:①色氨酸的生物合成途徑中關鍵酶AroG、TrpE 存在反饋阻遏,例如AroG 受苯丙氨酸和酪氨酸協同反饋抑制,色氨酸增強這種抑制,當3種氨基酸共同存在時最大抑制作用接近90%;TrpE 不僅受色氨酸反饋抑制,而且還受色氨酸的反饋阻遏[62,73]。②色氨酸對色氨酸合成路徑關鍵酶(色氨酸操縱子trpEDCBA)與轉運蛋白(mtr)存在反饋阻遏[77-79]。③芳香族氨基酸合成支路與色氨酸合成途徑的競爭代謝流,減弱了色氨酸合成的代謝流[73]。④在大腸桿菌色氨酸的代謝調控中,采用降解色氨酸的方式調控胞內色氨酸的濃度,色氨酸酶(TnaA)將色氨酸降解為吲哚、氨和丙酮酸[80]。
2.2 色氨酸大腸桿菌細胞工廠的構建與優化
大腸桿菌細胞中存在天然的色氨酸生物合成途徑,通過強化本源代謝路徑,可以實現大腸桿菌色氨酸的合成。Aiba 等[59]在色氨酸操縱子阻遏蛋白(TrpR)和色氨酸酶(TnaA)雙缺菌株中,強化色氨酸操縱子基因的表達,并通過化學誘變,構建了可以生產30 g/L 色氨酸的大腸桿菌細胞工廠;在此基礎上,研究人員通過加入表面活性劑,降低發酵液中色氨酸的溶解度,加速色氨酸結晶,使色氨酸產量增加到54.5 g/L。近年來,圍繞大腸桿菌細胞工廠生產色氨酸的研究工作主要集中在阻斷支路代謝和色氨酸分解代謝、解除色氨酸反饋調節與增加前體供應。敲除或者弱化芳香族氨基酸合成支路關鍵酶PheA(預苯酸脫水酶)和TyrA(預苯酸脫氫酶),可以阻斷色氨酸合成途徑的競爭支路,增加色氨酸合成的代謝流[73];敲除色氨酸酶(TnaA)可以減弱色氨酸的分解[80],例如敲除tnaA的,使工程菌E.coliFB-02/pSV03的色氨酸產量增加了1.7倍,達到7.8 g/L。在此基礎上,敲除pheA和tyrA,使色氨酸的產量增加了0.7 倍達到13.3 g/L[60]。解除色氨酸反饋調節主要包括解除色氨酸對色氨酸合成路徑關鍵酶的反饋阻遏與解除中間代謝物對關鍵酶的反饋抑制。通過敲除trpR(編碼阻遏蛋白TrpR基因),解除了阻遏蛋白TrpR,對色氨酸合成路徑關鍵酶(色氨酸操縱子trpEDCBA)與轉運蛋白(mtr)的反饋阻遏[77-79]。例如,在工程菌E. coliAE1 (pSC101 trp·I15)中敲除trpR,獲得工程菌E. coliRam(pSC101 trp·I15),使色氨酸產量增加了5.4 倍[61]。篩選抗反饋調節的突變體,是解除中間代謝物對色氨酸合成關鍵酶反饋抑制的有效手段。例如將AroG(DAHP 合酶)第150 位的氨基酸殘基由脯氨酸突變為亮氨酸(P150L),或者把第146位的天冬氨酸突變為天冬酰胺(D146N),可以完全解除苯丙氨酸對AroG的反饋抑制[81];將TrpE(鄰氨基苯甲酸合酶)第40 位的絲氨酸突變為苯丙氨酸(S40F),可以完全解除色氨酸對TrpE 的反饋抑制[78]。在苯丙氨酸合成菌株中,將AroG 的第146 位氨基酸殘基由天冬氨酸突變為天冬酰胺(D146N),使苯丙氨酸的產量增加了51.4%[82]。色氨酸有兩個關鍵前體:PEP 和E4P,它們是色氨酸合成路徑中關鍵中間代謝物DAHP 的限制性底物,直接決定色氨酸合成能力[83]。目前增加胞內PEP 含量的常用策略包括:①阻斷PEP 競爭支路代謝,例如敲除PykF 與PykA(丙酮酸激酶),與敲除Ppc(磷酸烯醇式丙酮酸羧化酶)[84];②阻斷磷酸烯醇式丙酮酸-糖磷酸轉移酶系統(PTS),減少葡萄糖轉運過程中PEP 的消耗[85-86];③敲除碳儲存調控因子(CsrA),增強糖酵解途徑碳通量[87];④增強PEP循環再利用,例如過表達PpsA(磷酸烯醇式丙酮酸合酶)[88]。目前增加胞內E4P 含量的主要策略:①過表達TktA(轉酮酶)[89];②敲除Pgi(磷酸葡萄糖異構酶)[90]。例如,Zhang等[62]首先通過表達色氨酸操縱子(trpEDCBA)、抗反饋調節的DAHP合酶(AroGfbr)和敲除色氨酸阻遏蛋白(TrpR),構建了合成色氨酸的底盤微生物,并通過敲除pykF和ptsH,增加胞內PEP 含量,使色氨酸產量增加到11 g/L。為了恢復細胞生長,通過組合優化葡萄糖激酶(GalP)和半乳糖滲透酶(Glk)的表達,使色氨酸的產量增加到37 g/L,在此基礎上,通過抑制乙酰磷酸轉移酶表達減弱乙酸的積累,使色氨酸的產量進一步增加到39.7 g/L,對葡萄糖的轉化率增加到16.7%[62]。Chen 等[63]在前期構建合成色氨酸底盤微生物E.coliTRTH 的基礎上,利用不同強度的啟動子和不同拷貝數的質粒組合優化乙酰輔酶A 合酶,重構了TCA 循環,增加了前體PEP 的供應,減弱了乙酸的積累,獲得工程菌E.coliT16,使色氨酸的產量增加到54.6 g/L(表1)。
3 纈氨酸大腸桿菌細胞工廠
3.1 纈氨酸的生物合成途徑
纈氨酸不僅可以促進哺乳動物的乳汁分泌,而且還可以提高動物的免疫力,增加動物細胞外傷治愈的作用[5-8]。葡萄糖經糖酵解途徑合成纈氨酸重要前體丙酮酸,2 分子丙酮酸在乙酰羥酸合酶(IlvBN、IlvGM 和IlvIH)作用下縮合成2-乙酰羥酸。然后,在乙酰羥酸還原異構酶(IlvC)的催化下,將2-乙酰羥酸催化生成雙羥基異戊酸。最后,雙羥基異戊酸經過二羥酸脫水酶(IlvD)脫水形成2-酮異戊酸,2-酮異戊酸在轉氨酶B(IlvE)作用下形成纈氨酸[64](圖3)。
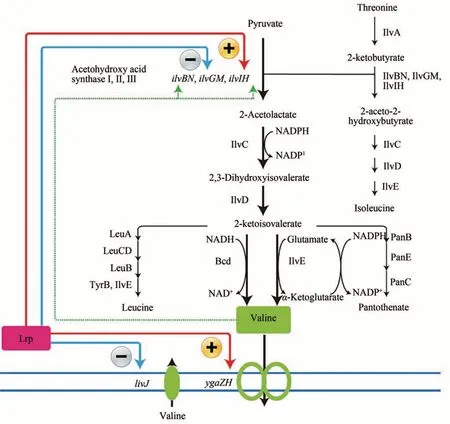
圖3 大腸桿菌纈氨酸合成代謝路徑Fig.3 Schematic of valine biosynthetic pathway in E.coli
大腸桿菌細胞工廠合成纈氨酸主要存在以下問題:①乙酰羥酸合酶受纈氨酸反饋抑制,而且亮氨酸、異亮氨酸和纈氨酸對轉氨酶B存在協同反饋抑制[65];②強化纈氨酸轉運,降低胞內纈氨酸的積累,減緩纈氨酸積累造成的反饋抑制[64,91];③由于乙酰羥酸還原異構酶催化活性需要輔因子NADPH 提供還原力,因此纈氨酸合成需要提供充足的輔因子[66];④纈氨酸關鍵前體丙酮酸也可合成丙氨酸、乙酰輔酶A、草酰乙酸等,這些代謝物的合成,競爭了纈氨酸的前體物質[64]。
3.2 纈氨酸大腸桿菌細胞工廠的構建與優化
通過改造大腸桿菌本源代謝路徑,可以實現纈氨酸的合成。例如,Park 等[64]通過定點突變獲得抗反饋調節的乙酰羥酸合酶Ⅲ,并在基因組上用tac 啟動子強化纈氨酸操縱子(ilvGMEDA)的表達,同時敲除蘇氨酸脫水酶(IlvA)、2-異丙基蘋果酸合酶(LeuA)和3-甲基-2-氧代丁酸羥甲基轉移酶(PanB),再強化乙酰羥酸合酶(IlvBN)表達,獲得工程菌E. coliVal 可以生產1.31 g/L 的纈氨酸。為了進一步提高纈氨酸的產量,開發了強化代謝合成路徑效率、輔因子工程和轉運子工程策略。強化代謝合成路徑效率包括強化前體供應和解除路徑酶的反饋抑制。例如Park 等[64]利用網絡模型模擬基因敲除對纈氨酸生產的影響,發現敲除丙酮酸脫氫酶(AceF)、磷酸丙糖異構酶(TpiA)、磷酸果糖激酶(PfkA/B)和蘋果酸脫氫酶(Mdh),可以增加纈氨酸前體丙酮酸的積累,并通過實驗驗證發現敲除AceF、PfkA 和Mdh,使纈氨酸產量增加1.27 倍。研究人員發現將乙酰羥酸合酶小亞基(IlvN)的第20~22 位氨基酸殘基分別由甘氨酸(G)、纈氨酸(V)、甲硫氨酸(M)替換為天冬氨酸(D)、天冬氨酸(D)和苯丙氨酸(F),解除了纈氨酸對乙酰羥酸合酶的反饋抑制,使纈氨酸的產量增加了22%[65]。輔因子工程策略包括修飾輔因子特異性與輔因子再生。例如,在纈氨酸生產過程中,使用枯草芽孢桿菌來源NADH 依賴性的亮氨酸脫氫酶(BsLeuDH),替換大腸桿菌本源NADPH 依賴性的氨基轉移酶(EcilvE), 使 纈 氨 酸 產 量 增 加 了 2.2 倍[66]。Hao 等[67]通過借鑒改變谷氨酸棒桿菌乙酰羥酸還原異構酶輔因子偏好性的方法,將大腸桿菌乙酰羥酸還原異構酶(EcilvC)的第67 位氨基酸殘基由亮氨酸(L)替換為谷氨酸(E)、第68 位氨基酸殘基由精氨酸(R)替換為苯丙氨酸(F)、第75位氨基酸殘基由賴氨酸(K)替換為谷氨酸,使EcilvC 從NADPH 依賴性改變成為NADH 依賴性。在此基礎上,利用BsLeuDH 替換EcilvE,使纈氨酸產量增加了5.6 倍。為了強化纈氨酸合成過程中輔因子的供給,強化吡啶核苷酸轉氫酶的表達,將NADH/NAD+的比例從11.0 增加到11.9,使纈氨酸產量增加了5.3%;而敲除乳酸脫氫酶、丙酮酸甲酸裂解酶和乙醇脫氫酶減少輔因子的消耗,將NADH/NAD+的比例從11.0 增加到13.5,使纈氨酸的產量增加了23.5%[67]。研究表明,增強纈氨酸的轉運,是降低胞內纈氨酸積累水平、緩解纈氨酸積累引起反饋抑制的有效策略[64]。例如,在E.coliVHY13 中,過表達谷氨酸棒桿菌來源的纈氨酸轉運蛋白(BrnFE),使纈氨酸產量增加了72%[67]。在工程菌E.coliVal 中,過表達大腸桿菌本源的纈氨酸轉運蛋白(YgaZH),使纈氨酸產量增加了47.1%[64](表1)。
4 精氨基酸大腸桿菌細胞工廠
4.1 精氨酸的生物合成途徑
精氨酸在生命活動過程中有著十分重要的作用,參與哺乳動物細胞內的氨解毒、激素的分泌(包括生長激素、催乳素、胰島素、胰高血糖素等)以及免疫系統等多種生化反應,主要是促進動物生長發育、提高幼仔的存活率、改善肉質、提高飼料利用率等[5-8]。糖酵解途徑形成的丙酮酸,以乙酰輔酶A 的形式進入檸檬酸循環,檸檬酸循環中的α-酮戊二酸在谷氨酸合酶或者谷氨酸脫氫酶的催化下形成精氨酸的前體谷氨酸。如圖4所示,根據乙酰化的作用方式,可以將微生物精氨酸合成路徑分為線性途徑、經濟循環途徑和新合成途徑3 種[92]。其中,大腸桿菌本源的精氨酸生物合成途徑是線性途徑[92]。在線性合成路徑中,谷氨酸在N-乙酰谷氨酸合酶(ArgA)的作用下合成乙酰谷氨酸,再經過乙酰谷氨酸激酶(ArgB)、N-乙酰谷氨酸半醛脫氫酶(ArgC)、乙酰鳥氨酸轉氨酶(ArgD)、乙酰鳥氨酸酶(ArgE)、鳥氨酸轉氨甲酰酶(ArgF)、精胺琥珀酸合酶(ArgG)和精氨琥珀酸酶(ArgH)作用下,形成精氨酸[69,93][圖4(a)]。在經濟循環途徑中由于不存在乙酰谷氨酸合酶,乙酰鳥氨酸在乙酰鳥氨酸轉移酶(ArgJ)的催化下形成鳥氨酸,同時將乙酰基轉移到谷氨酸上生成乙酰谷氨酸,即乙酰鳥氨酸轉移酶同時發揮乙酰谷氨酸合酶和乙酰鳥氨酸酶的作用,從而使乙酰基團在精氨酸合成途徑中循環利用[92][圖 4(b)]。此外,在野油菜黃單胞菌(Xanthomonas campestris)中,發現一條合成精氨酸的新途徑,在該合成途徑中,乙酰鳥氨酸被乙酰鳥氨酸氨甲酰轉移酶(ArgF′)催化生成乙酰瓜氨酸,然后乙酰瓜氨酸被催化脫乙酰生成瓜氨酸,再由瓜氨酸合成精氨酸[94][圖4(c)]。
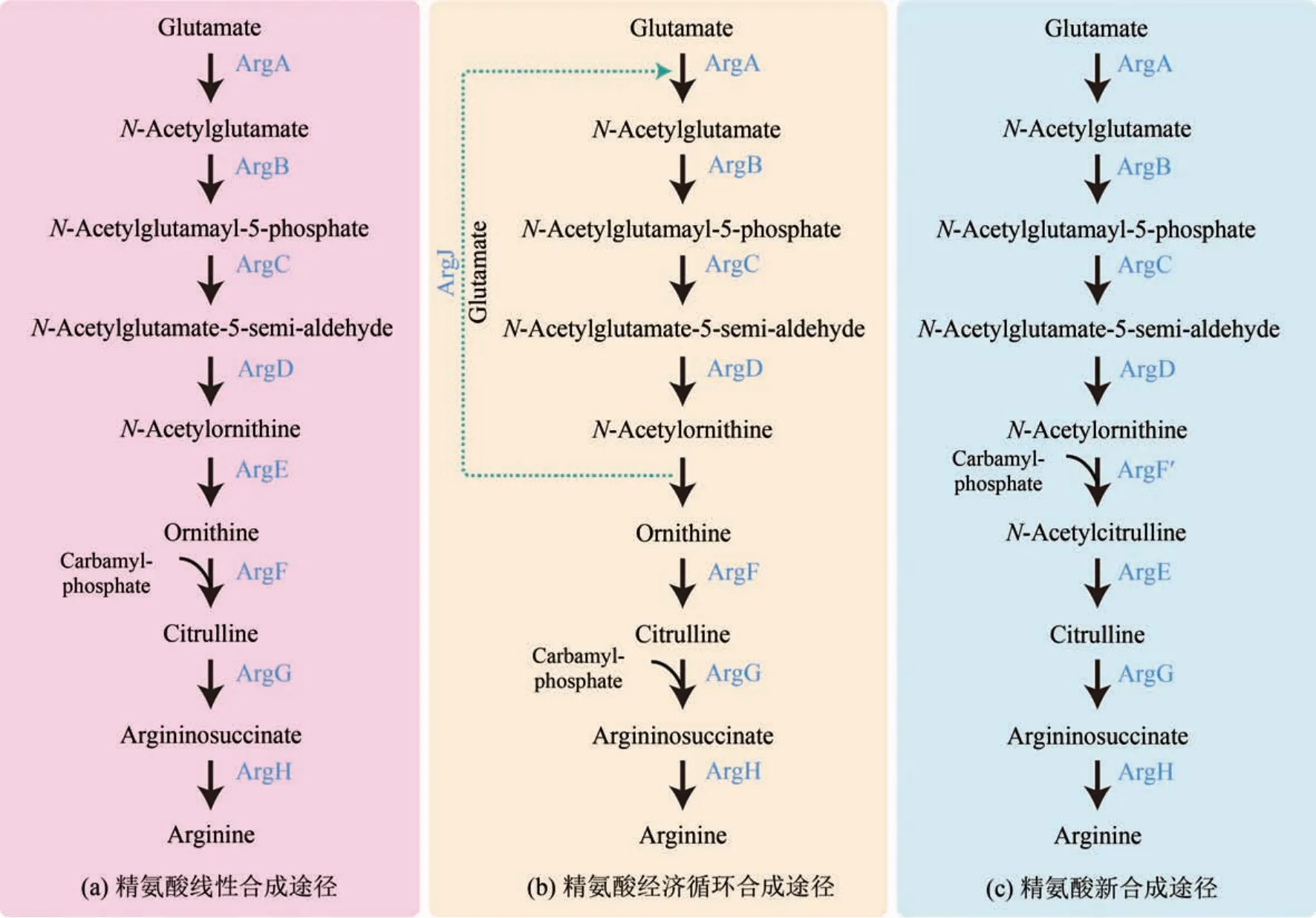
圖4 微生物體內精氨酸合成代謝路徑Fig.4 Schematic of arginine biosynthetic pathway in microorganisms
大腸桿菌細胞工廠合成精氨酸主要存在以下瓶頸:①精氨酸合成路徑關鍵酶N-乙酰谷氨酸合酶,以及其合成路徑酶(ArgB、ArgC、ArgD、ArgE、ArgF、ArgG 和ArgH)均受到精氨酸的反饋抑制[95];②精氨酸與ArgR(精氨酸合成途徑阻遏蛋白)相互作用,反饋阻遏精氨酸合成路徑[96];③谷氨酸不僅是合成精氨酸的前體物質,同時也用于合成脯氨酸、鳥氨酸、瓜氨酸,減弱了合成精氨酸的代謝流[92];④由于大腸桿菌中存在精氨酸分解代謝途徑(例如精氨酸酶途徑、精氨酸脫亞氨基酶途徑、精氨酸琥珀酰轉移酶途徑等),胞內合成的精氨酸如不及時轉運到胞外,會增加精氨酸分解代謝的風險[92,97]。
4.2 精氨酸大腸桿菌細胞工廠的構建與優化
Rajagopal等[98]在抗反饋調節N-乙酰谷氨酸合酶突變株E.coliEE11、E.coliEE17 和E.coliEE51 中 ,過表達氨基甲酸酯磷酸合酶和精氨酸酶,使精氨酸產率提高了 3~15 倍。Xu 等[68]在E.coliJM109 中,過量表達鈍齒棒桿菌(Corynebacterium crenatumSYPA5-5)來源的 argCJBDFRGH 基因簇(argR 已失活),可以積累40 mg/L 的精氨酸。為了進一步強化精氨酸大腸桿菌細胞工廠的生產性能,發展了阻斷競爭代謝路徑、強化精氨酸轉運、解除精氨酸對關鍵酶的反饋抑制等策略。例如Ginesy等[69]以E.coliC600+為出發菌株,首先敲除SpeC(鳥氨酸脫羧酶)、SpeF(鳥氨酸脫羧酶)和AdiA(精氨酸脫羧酶),阻斷競爭代謝路徑;敲除ArgR(精氨酸合成途徑阻遏蛋白)和過表達抗反饋調節的ArgA215,解除精氨酸的反饋抑制,使精氨酸產量增加到3.03 g/L。在此基礎上,研究人員通過敲除本源ArgA 和增加ArgA215 的拷貝數,使精氨酸產量進一步增加到4.11 g/L。然后,通過表達ArgO(精氨酸轉運蛋白),強化精氨酸的轉運,獲得工程菌E.coliSJB009,使精氨酸產量增加到11.64 g/L。Ginesy 等[99]對發酵條件進一步優化,在最優發酵條件下,使工程菌E. coliSJB009 精氨酸得率增加到0.16 g/g。此外,Sander等[70]在E.coliMG1655中過表達精氨酸轉運蛋白(ArgO)和抗反饋調節的ArgAH15A,同時敲除ArgR,獲得工程菌E. coliKO,可以生產1.03 g/L 的精氨酸。但是,研究人員發現敲除ArgR 會影響工程菌生長,降低發酵生產性能。利用代謝組學和蛋白質組學技術分析,發現敲除ArgR 導致鳥氨酸氨基甲酰基轉移酶活性增加17 倍,干擾了精氨酸-嘧啶的分支點,限制了嘧啶核苷酸的生物合成,導致ArgR 缺失菌株生長不良。利用CRISPRi 技術在基因組上下調ArgR,使工程菌的細胞生長速率增加2倍[70](表1)。
5 展 望
在飼料中添加飼用氨基酸,可以適當降低原料中的蛋白質水平,降低飼料生產成本,降低氮排放,減少環境污染。然而,由于天然大腸桿菌細胞工廠合成飼用氨基酸的生產性能較低,不具備工業生產的經濟可行性。因此,需要借助合成生物學與代謝工程技術,重新設計與優化大腸桿菌細胞工廠,提高飼用氨基酸細胞工廠的生產性能。目前,研究人員利用合成生物學技術,改造大腸桿菌細胞工廠,實現了色氨酸、蘇氨酸和纈氨酸工業化生產,改造谷氨酸棒桿菌細胞工廠實現了精氨酸、賴氨酸工業化生產。然而,由于甲硫氨酸代謝合成網絡的復雜性,導致微生物細胞工廠還難以實現甲硫氨酸的工業化生產。
隨著市場對飼用氨基酸需求的不斷增加,氨基酸生產市場的同質性競爭日趨激烈,提高工程菌株魯棒性,降低飼用氨基酸生產成本,與提升飼用氨基酸生產技術水平是未來的發展方向。提高大腸桿菌細胞工廠的魯棒性,不僅可以增強大腸桿菌細胞工廠對有害環境的耐受能力,而且還可以提升飼用氨基酸發酵性能,簡化發酵過程控制和產品分離提純工藝,降低生產成本,例如通過與合成生物學相結合的誘變育種策略,提高了工程菌對噬菌體的魯棒性。目前,主要以“糧食作物生物質”為原料生產飼用氨基酸,存在“與人爭糧、與糧爭地”等問題。利用合成生物學與代謝工程技術,構建了以甘油、木質纖維素水解液和細菌細胞裂解液等非糧生物質為原料的飼用氨基酸生產菌株,不僅可以降低飼用氨基酸發酵生產成本,而且還可以實現“不與人爭糧、不與糧爭地”的目標,例如,研究人員利用合成生物學技術與代謝工程技術,對大腸桿菌細胞工廠進行改造,實現了以木質纖維素水解液為底物生產賴氨酸,以細菌細胞裂解液作為氮源生產色氨酸,以甘油為底物生產色氨酸。
然而,由于大腸桿菌細胞精密的調控機制、復雜的代謝調控網絡以及外界脅迫環境,限制了飼用氨基酸大腸桿菌細胞工廠性能的進一步提升。此外,基于基因敲除和過表達的靜態調控策略,通過剪接代謝路徑,構建的合成目標化學品代謝通路,常常導致宿主菌代謝流擾動與失衡,增加細胞代謝負荷,降低了大腸桿菌細胞工廠的生產性能,限制了飼用氨基酸生產技術水平提升。因此,開發大腸桿菌全細胞代謝網絡模型,計算和設計飼用氨基酸的最優合成路徑;發展新型生物傳感器,建立響應外界環境與胞內代謝物的基因回路,精確調節飼用氨基酸合成路徑的物質流和能量流;研究外界脅迫環境對大腸桿菌細胞的影響,特異性增強大腸桿菌細胞對外界脅迫環境的耐受性,是未來的發展方向。

