合成生物技術(shù)驅(qū)動天然的真核油脂細胞工廠開發(fā)
汪慶卓,宋萍,黃和
(南京師范大學(xué)食品與制藥工程學(xué)院,江蘇 南京 210046)
據(jù)國家統(tǒng)計局數(shù)據(jù),2019年我國原油和石油對外依存度雙破70%,大豆進口量更是突破8000 萬噸。為避免因國際環(huán)境變化(如疫情、戰(zhàn)爭或其他事件爆發(fā))導(dǎo)致外部資源進口遭到封鎖,我國必須建設(shè)、補充和完善能源、糧油供給的新方式。生物質(zhì)是眾多可再生資源(如太陽能、風(fēng)能、水能、地?zé)崮艿龋┲形ㄒ灰活愐蕴紴榛A(chǔ)的實物性資源,因此以豐富、廉價的生物質(zhì)原料(如木質(zhì)纖維素)替代化石原料生產(chǎn)燃料、大宗化學(xué)品、食用油脂和功能性油脂等在保障國家能源安全、糧食安全方面意義重大[1]。
相比于植物和動物來源油脂,微生物來源的油脂因具有生產(chǎn)周期短,場地靈活、占地少,不受氣候變化影響,易于大規(guī)模生產(chǎn),原料來源豐富、成本低廉,易于菌種改良與基因改造,定向生產(chǎn)特定產(chǎn)物等優(yōu)勢倍受重視[2]。然而,如何獲取生產(chǎn)效率高且魯棒性強的微生物油脂細胞工廠,面臨著使能工具有限、油脂產(chǎn)量不高、油脂組分難以控制等問題[3]。幸運的是,合成生物學(xué)的迅猛發(fā)展有力促進了油脂細胞工廠的開發(fā)。產(chǎn)油微生物研究在遺傳操作工具創(chuàng)制、代謝途徑改造以及高附加值產(chǎn)品開發(fā)等方面不斷獲得突破。本文中,筆者聚焦關(guān)鍵技術(shù)瓶頸,闡述了合成生物技術(shù)驅(qū)動天然的真核油脂細胞工廠開發(fā)的研究進展,力圖為后續(xù)研究提供借鑒。
1 微生物合成油脂的途徑和底盤菌株
細菌、酵母、霉菌、微藻等多種微生物能利用木質(zhì)纖維素類、糖類、淀粉類、甘油甚至一碳化合物等合成脂肪酸[4-6]。如圖1 所示,微生物攝取各種生物質(zhì)后,在產(chǎn)油酵母線粒體及胞質(zhì)內(nèi)經(jīng)各種途徑合成的乙酰CoA,進一步羧化生成丙二酸單酰CoA;然后乙酰CoA 和丙二酸單酰CoA 經(jīng)脂肪酸合成酶合成丙二酸單酰ACP,接著再與丙二酸單酰CoA 反應(yīng)生成新的脂酰ACP。每與丙二酸單酰CoA 反應(yīng)一次,脂酰ACP 的碳鏈延長2 個碳原子;各種脂酰ACP 經(jīng)硫酯酶催化合成不同鏈長的脂肪酸。當脂肪酸有過量積累時,被快速轉(zhuǎn)化為脂酰CoA,然后經(jīng)過β-氧化途徑分解成乙酰CoA[2,7-8]。在產(chǎn)油微生物中,脂肪酸通常會以甘油三酯(triacylglycerol, TAG)的形式儲存在胞內(nèi),形成脂滴。
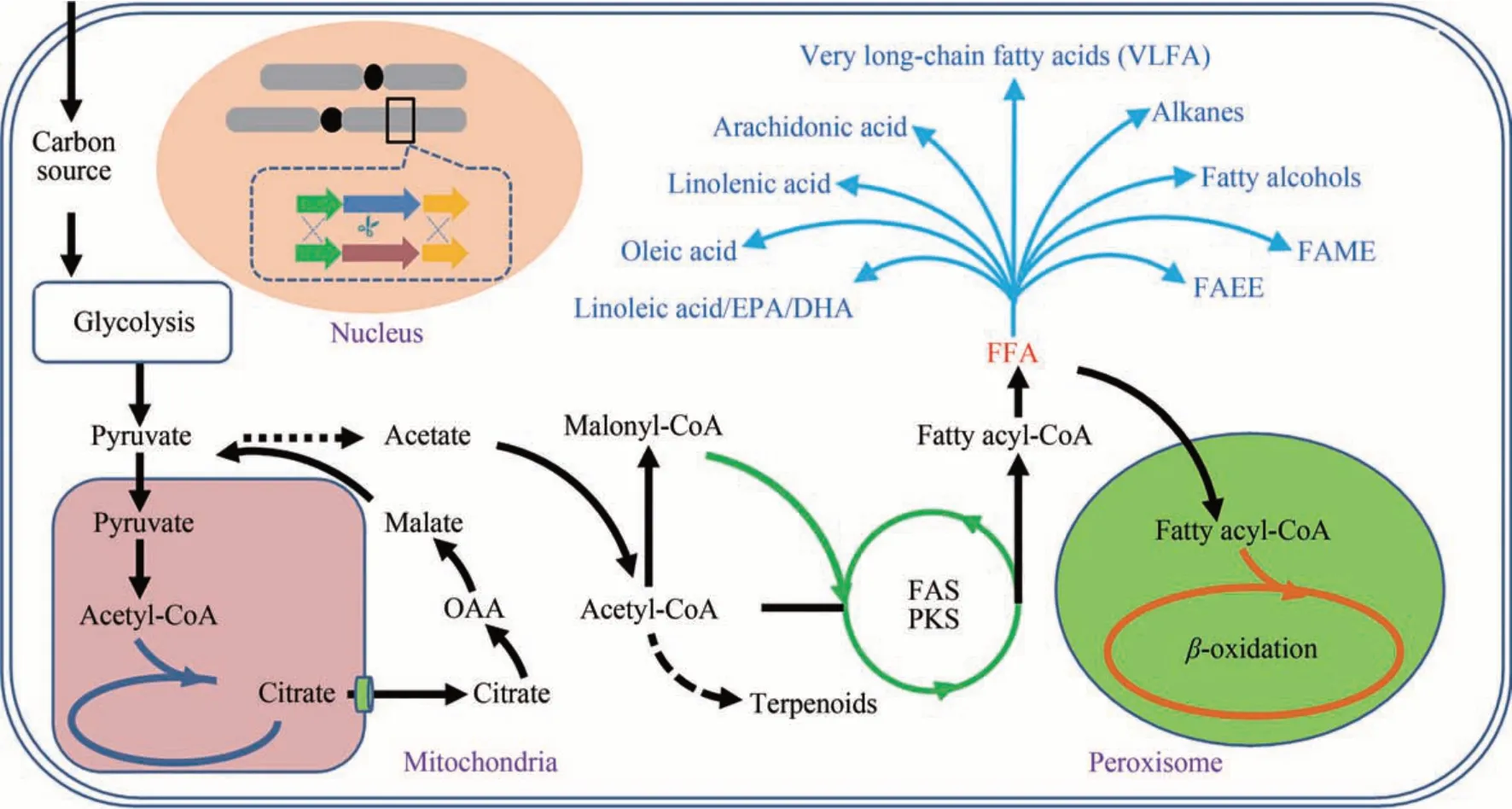
圖1 微生物合成脂肪酸及其衍生物的途徑Fig.1 Pathways of microbial synthesis of fatty acids and derivatives
在胞內(nèi),脂肪酸也可以被轉(zhuǎn)化為各種高附加值產(chǎn)品。當有內(nèi)源的或者異源引入的去飽和酶系存在時,會生成各種類型的不飽和脂肪酸,包括ω-6系列的γ-亞麻酸(γ-linoleic acid)和花生四烯酸(arachidonic acid,ARA),以及ω-3系列的α-亞油酸(linoleic acid)、二十碳五烯酸(eicosapentaenoic acid, EPA)、二十二碳六烯酸(docosahexenoic acid,DHA)等[9-11]。雙鍵的位置和數(shù)目不同使得不同脂肪酸具有不同的生理功能,多種脂肪酸在醫(yī)學(xué)和功能性食品領(lǐng)域備受青睞。脂肪酸還可以被內(nèi)源的或者異源引入的酰基轉(zhuǎn)移酶(ACP transferase)催化酯化,與甲醇或者乙醇合成脂肪酸甲酯(fatty acid methyl ester,F(xiàn)AME)或者脂肪酸乙酯(fatty acid ethyl esters,F(xiàn)AEE),從而實現(xiàn)生物柴油的體內(nèi)合成[6]。另外,有報道稱在大腸桿菌或者釀酒酵母中引入脂酰輔酶A 還原酶(fatty acyl-coenzyme a reductase)或脂酰ACP 還原酶(fatty acyl-ACP reductase)基因和醛脫羰基酶(aldehyde decarbonylase)基因時,細胞能合成脂肪醇、脂肪烷烴、烯烴類化合物[12-13],而它們正是汽油、柴油、航空煤油的主要成分。
表1列舉了主流的幾種微生物生產(chǎn)油脂的研究進展。可以看出,目前比較主流的幾種油脂合成微生物細胞工廠包括大腸桿菌(Escherichia coli)、釀酒酵母(Saccharomyces cerevisiae)、解脂耶氏酵母(Yarrowia lipolytica)、 圓 紅 冬 孢 酵 母 (Rhodosporidium toruloides)、斯達氏油脂酵母(Lipomyces starkeyi)和裂殖壺菌(Schizochytriumsp.)等。
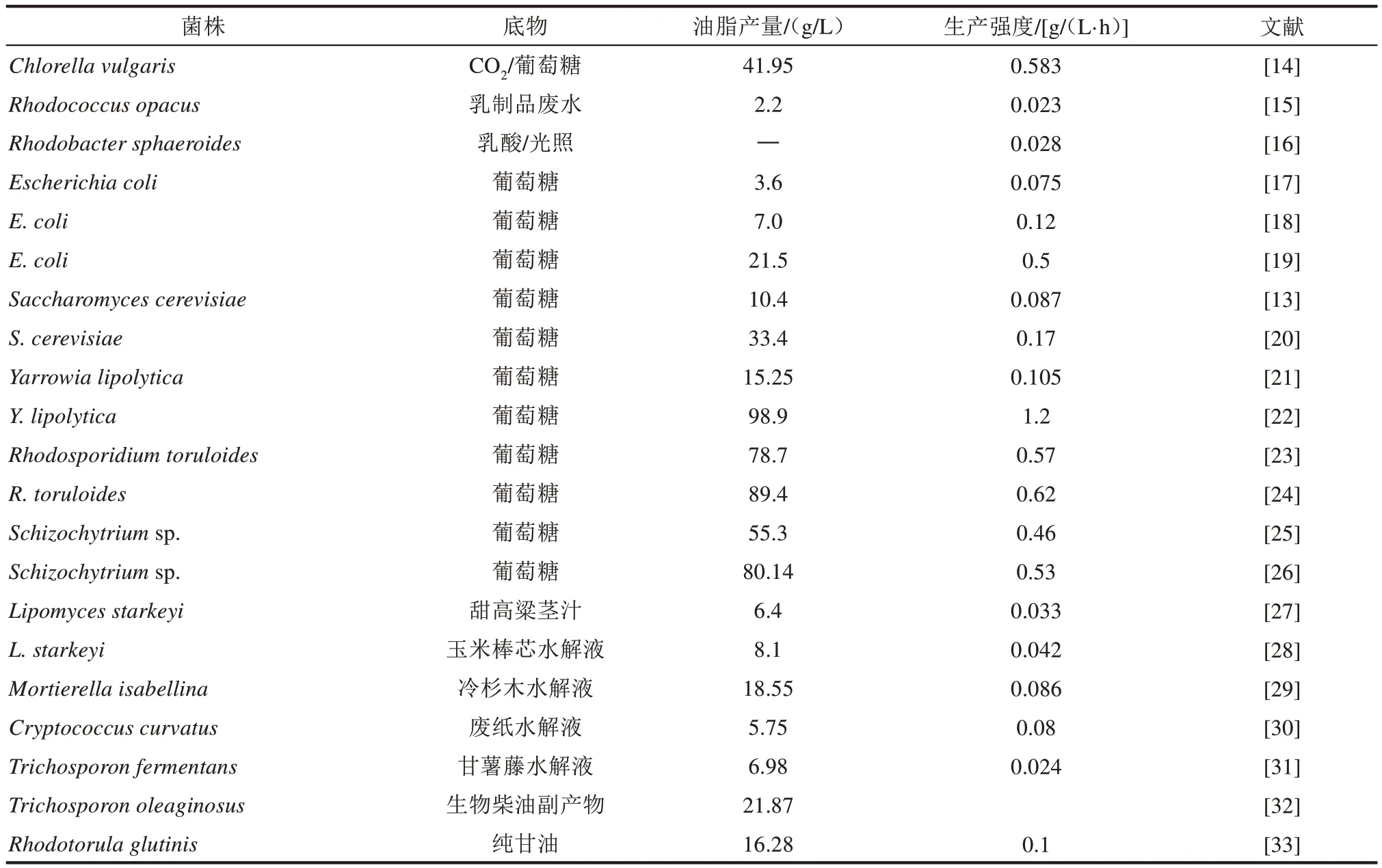
表1 近幾年主流的微生物油脂細胞工廠的研究進展Tab.1 Research progress of microbial lipid cell factories in recent years
大腸桿菌和釀酒酵母在自然條件下并不會生成油脂,但是因為其基因操作和改造比較容易,因此也常被用于生產(chǎn)油脂。大腸桿菌在生產(chǎn)脂肪酸及其衍生物等領(lǐng)域(例如脂肪酸、激素和烷烴) 均取得了重要進展[17-19]。但是,大腸桿菌對木質(zhì)纖維素水解液中的抑制物的耐受性不足,這可能會限制其碳源范圍。釀酒酵母通過合成生物學(xué)改造,在脂肪酸和烷烴等產(chǎn)物的生產(chǎn)方面也獲得了較好結(jié)果[20],但油脂產(chǎn)量整體偏低(目前最高33.4 g/L),副產(chǎn)物乙醇殘留較多,且木糖利用效率較低(即使經(jīng)過戊糖代謝改造),這可能會降低油脂轉(zhuǎn)化率。
不同于大腸桿菌、釀酒酵母等非天然產(chǎn)油菌株,產(chǎn)油酵母(oleaginous yeast)如解脂耶氏酵母、圓紅冬孢酵母和斯達氏油脂酵母,以及海洋真菌裂殖壺菌、破囊壺菌等能夠天然地積累過量油脂,特別適用于油脂及其衍生物的合成[21-22]。2017 年Qiao 等利用合成生物學(xué)手段對解脂耶氏酵母進行了系統(tǒng)改造,獲得的最優(yōu)菌株生產(chǎn)強度達1.2 g(/L·h),油脂得率0.27 g/g 葡萄糖,油脂產(chǎn)量創(chuàng)紀錄地達到98.7 g/L[22];圓紅冬孢酵母和斯達氏油脂酵母在優(yōu)化的培養(yǎng)條件下(加上營養(yǎng)限制或者環(huán)境脅迫),胞內(nèi)油脂含量可達細胞干重50%~70%[2,4-5,34];裂殖壺菌、破囊壺菌不僅生物量高(可達200 g/L),油脂含量高(可達70%),更難得的是其中高附加值的多不飽和脂肪酸(尤其是DHA)占比極高[25-26]。以上產(chǎn)油真菌還具有顯著的工業(yè)微生物的特征,如能廣泛利用各種碳源(包括己糖和戊糖)和氮源,可高密度培養(yǎng),抗逆性強(可直接發(fā)酵木質(zhì)纖維素水解液)等[4-5]。
總的來說,真核生物較原核生物(主要是大腸桿菌)在油脂產(chǎn)量和生產(chǎn)強度上有明顯優(yōu)勢。在真核生物中,天然產(chǎn)油真菌的產(chǎn)油水平遠高于非天然的模式菌株如釀酒酵母。尤為重要的是,經(jīng)過遺傳改造后,天然產(chǎn)油真菌的油脂產(chǎn)量可有大幅提升[11,22],這充分說明了這些天然產(chǎn)油菌株的油脂開發(fā)潛力。
2 合成生物學(xué)為油脂細胞工廠開發(fā)提供了豐富的使能工具
高效的遺傳操作技術(shù)是油脂細胞工廠開發(fā)的前提條件,然而天然產(chǎn)油真菌往往不是模式菌株,這意味著其遺傳操作技術(shù)發(fā)展難度更大,很難從根本的遺傳層面改善其油脂合成水平。隨著合成生物學(xué)的發(fā)展,近10年來高通量測序成本急劇降低,越來越多的產(chǎn)油微生物的基因組被陸續(xù)測序,其染色體結(jié)構(gòu)、基因編碼、蛋白功能、代謝途徑等信息日漸清晰,深化了學(xué)界對產(chǎn)油真菌的認知。另外,轉(zhuǎn)錄組學(xué)的研究在一定程度上促進了合成生物學(xué)元件(如啟動子、終止子等)的挖掘和表征。同時,遺傳轉(zhuǎn)化技術(shù)的進步使得更多的產(chǎn)油菌株能被改造;最重要的是,CRISPR/Cas 系統(tǒng)介導(dǎo)的基因編輯技術(shù)已在部分產(chǎn)油真菌中被成功開發(fā),徹底改寫了產(chǎn)油真菌的遺傳操作技術(shù)發(fā)展格局(圖2)。

圖2 合成生物學(xué)驅(qū)動產(chǎn)油真菌使能工具開發(fā)Fig.2 Synthetic biology drives the development of enabling tools for lipid producing fungi
2.1 產(chǎn)油真菌合成生物學(xué)元件的挖掘與表征
合成生物學(xué)元件,包括啟動子、終止子、篩選標記、復(fù)制子等,是對目標菌株進行遺傳操作的載體或工具。解脂耶氏酵母是遺傳操作研究比較成熟的產(chǎn)油真菌之一,目前已積累了很多可用的基因表達元件,包括嚴謹性不同的誘導(dǎo)型啟動子如PLEU2、PG3P、PICL1、PPOT1、PPOX1、PPOX2和 PPOX5[35-36],強度不同的組成型啟動子如 PTEF、PEXP1、PGPAT、PGPD、PYAT1、PFBA和PGPM1[37-38],以及終止子如 Txpr2t、Tlip2t、Tmig1t、Tpex20t和 Tpox3t等[9,39]。有趣的是,釀酒酵母基因組中的終止子如Tcyc1t和Tpho5t也可以在解脂耶氏酵母中發(fā)揮功能[36,39]。在篩選標記方面,營養(yǎng)缺陷型標記如URA3/ura3d4(尿嘧啶)、LEU2(亮氨酸)、TRP1(色氨酸)和HisG(組氨酸)等在解脂耶氏酵母中應(yīng)用較多[40-41],而抗生素抗性標記使用較少,僅有博來霉素(bleomycin/phleomycin)抗性基因phleoR和潮霉素(hygromycin B)抗性基因hph可用于少數(shù)株系[42]。至于復(fù)制子,它一般來自于菌株的內(nèi)生性游離質(zhì)粒或者染色體上的自主復(fù)制序列。由于解脂耶氏酵母中無游離質(zhì)粒,目前研究多以解脂耶氏酵母基因組上的自主復(fù)制序列(autonomously replicating sequences, ARS) ARS18、ARS68 或者著絲粒(CEN)序列CEN1-227&ORI1 001 作為游離質(zhì)粒的復(fù)制元件,但拷貝數(shù)極低,難以實現(xiàn)目的基因的高拷貝、超表達功能[43-44]。幸運的是,在解脂耶氏酵母染色體上存在串聯(lián)重復(fù)核糖體DNA(tandemly repeated ribosomal DNA,rDNA)位點,部分菌株染色體上還存在分散的重復(fù)Ylt1反轉(zhuǎn)錄轉(zhuǎn)座子位點以及約束Ylt1 的zeta 因子位點(一個長末端重復(fù)序列),可作為整合靶點實現(xiàn)多拷貝重組[44-45]。
相比于解脂耶氏酵母,其他產(chǎn)油真菌的元件挖掘及表征的研究相對滯后。在圓紅冬孢酵母中,已有較多的誘導(dǎo)型啟動子(如PLDP1、PDAO1、PPHO89、PADH2和 PGAL1等[46-47])、 組 成型 啟 動 子 (如 PPGI、PPGK、PFBA、PTPI、PGPD、PACC1、和 PACL1等[48-49])、終止子(如Thsp、Tgpd等[50])等被相繼鑒定和表征。常用的抗性篩選標記如HYG(潮霉素抗性)、BLE(博來霉素抗性)、NEO(新霉素抗性)、G418(遺傳霉素抗性),營養(yǎng)缺陷型標記如URA3、LEU2等,以及熒光素酶(luciferase)、綠色熒光蛋白(GFP)等報告基因也可在圓紅冬孢酵母中正常使用[51]。然而,目前尚未在圓紅冬孢酵母中發(fā)現(xiàn)任何內(nèi)生性游離質(zhì)粒,也沒有發(fā)現(xiàn)任何染色體上的自主復(fù)制序列或著絲粒序列可作為圓紅冬孢酵母中游離質(zhì)粒的復(fù)制子[52],因此圓紅冬孢酵母的轉(zhuǎn)化載體基本上都是自殺型或者整合型的,對后續(xù)轉(zhuǎn)化效率有較高要求。
類似于圓紅冬孢酵母,其他研究較多的產(chǎn)油真菌如斯達氏油脂酵母、裂殖壺菌、破囊壺菌等的合成生物學(xué)元件開發(fā)在啟動子、終止子及篩選標記等方面也有很大進展,但主要遭遇缺少獨立復(fù)制元件的問題[8,53-57]。另外,在基因編輯工具中常用的核定位信號(nuclear localization sequence,NLS)以及Ⅲ型RNA 聚合酶可識別的啟動子(可啟動sgRNA 這樣的小RNA),也有待進一步鑒定和擴充[2,58-59]。
2.2 產(chǎn)油真菌遺傳轉(zhuǎn)化方法的開發(fā)與優(yōu)化
將攜帶有各種合成生物學(xué)功能元件以及外源基因的穿梭載體成功導(dǎo)入是產(chǎn)油真菌遺傳操作系統(tǒng)開發(fā)的起點,意味著該菌能被遺傳改造,可在基因?qū)用婊虼x途徑水平進行理性設(shè)計。另外,遺傳轉(zhuǎn)化也直接關(guān)系到遺傳改造(尤其是基因編輯)的成敗,因為大部分遺傳操作工具的效果嚴重依賴于轉(zhuǎn)化效率,轉(zhuǎn)化子數(shù)目越多,獲得正突變株的可能性越大[2]。一般來說,轉(zhuǎn)化效率與載體類型、轉(zhuǎn)化方法、菌株特性等因素高度相關(guān)。
如前所述,解脂耶氏酵母的遺傳操作技術(shù)相對成熟,早在1985 年就有成功轉(zhuǎn)化的報道[60]。目前主要有化學(xué)轉(zhuǎn)化法、電轉(zhuǎn)化和YLOS試劑盒轉(zhuǎn)化等方法。解脂耶氏酵母的化學(xué)轉(zhuǎn)化法借鑒于釀酒酵母的醋酸鋰轉(zhuǎn)化方法,轉(zhuǎn)化效率一般可達104CFU/μg DNA[60-61]。特別地,質(zhì)粒線性化后轉(zhuǎn)化效率會明顯提升。電穿孔轉(zhuǎn)化方法的轉(zhuǎn)化效率與醋酸鋰轉(zhuǎn)化基本接近。有意思的是,在電轉(zhuǎn)前使用醋酸鋰等或硫代化合物如DTT 等處理感受態(tài),可使轉(zhuǎn)化效率進一步提升[62]。YLOS 轉(zhuǎn)化試劑盒由YEASTERN 生物技術(shù)公司研制,優(yōu)化了感受態(tài)細胞制備及轉(zhuǎn)化流程,轉(zhuǎn)化效率也較傳統(tǒng)的化學(xué)轉(zhuǎn)化和電轉(zhuǎn)化有所提升,但價格昂貴,僅在常規(guī)轉(zhuǎn)化效率較低時會用到。
圓紅冬孢酵母的外源基因轉(zhuǎn)化方法與解脂耶氏酵母幾乎同年被開發(fā)出來,由聚乙二醇(PEG)介導(dǎo)進行原生質(zhì)體轉(zhuǎn)化,轉(zhuǎn)化效率約103CFU/μg DNA[63],外源基因主要以隨機插入方式被整合至基因組上。由于原生質(zhì)體轉(zhuǎn)化步驟煩瑣且高度依賴于操作技能,近年來圓紅冬孢酵母轉(zhuǎn)化主要采用同樣是隨機插入但操作比較簡單的根癌農(nóng)桿菌介導(dǎo)的轉(zhuǎn)化法(Agrobacterium tumefaciensmediated transformation,ATMT)[64]。然而,ATMT轉(zhuǎn)化有一定的宿主依賴性,而且轉(zhuǎn)化效率相對較低(約40~1000 CFU/μg DNA)。近幾年陸續(xù)報道了更簡單的電穿孔和其他化學(xué)轉(zhuǎn)化方法,但轉(zhuǎn)化效率有時甚至低于ATMT,有待進一步優(yōu)化[20,65]。
相比于解脂耶氏酵母和圓紅冬孢酵母,其他產(chǎn)油真菌的遺傳操作系統(tǒng)開發(fā)較晚。裂殖壺菌的遺傳轉(zhuǎn)化體系最早見諸專利[66],后來陸續(xù)有經(jīng)同行評議的電轉(zhuǎn)化及農(nóng)桿菌介導(dǎo)轉(zhuǎn)化的報道[67-68]。雖經(jīng)多年發(fā)展,實際操作中裂殖壺菌的轉(zhuǎn)化效率有很高的株系依賴性,同種質(zhì)粒在不同株系之間的轉(zhuǎn)化效率差別很大[56,58,67,69],另一個重要的產(chǎn)油真菌斯達氏油脂酵母,直到2014 年其醋酸鋰轉(zhuǎn)化方法才被開發(fā)出來[70]。值得慶幸的是,近幾年,斯達氏油脂酵母的遺傳轉(zhuǎn)化研究進展迅速,目前PEG 介導(dǎo)的原生質(zhì)體轉(zhuǎn)化以及ATMT 轉(zhuǎn)化方法也可用于該菌,盡管轉(zhuǎn)化效率還不太高[53-54,71]。
綜上,在產(chǎn)油真菌中,轉(zhuǎn)化效率的低下嚴重限制了遺傳操作工具在產(chǎn)油真菌中的開發(fā)與使用[20]。因此,新的轉(zhuǎn)化方法探索及轉(zhuǎn)化條件優(yōu)化等工作應(yīng)是產(chǎn)油真菌遺傳轉(zhuǎn)化研究后續(xù)的關(guān)注重點。
2.3 產(chǎn)油真菌基因編輯方法的開發(fā)與優(yōu)化
高效、可靠的遺傳操作工具是產(chǎn)油真菌代謝工程改造的利器。遺傳操作工具借助載體轉(zhuǎn)化進入胞內(nèi),因此其功能的發(fā)揮嚴重依賴于載體類型(自主復(fù)制型或自殺型、整合型等)以及載體轉(zhuǎn)化效率。除此之外,遺傳操作工具功能的發(fā)揮也與宿主的DNA 修復(fù)能力(尤其是同源重組效率)密切相關(guān)。
一般來說,位于自主復(fù)制型載體上的遺傳操作工具的功能發(fā)揮幾乎不受限于轉(zhuǎn)化效率,因為即使轉(zhuǎn)化后僅獲得一個攜帶質(zhì)粒的轉(zhuǎn)化子,也能通過該轉(zhuǎn)化子的傳代、擴增來豐富轉(zhuǎn)化子的多樣性,以完成后續(xù)遺傳操作和正轉(zhuǎn)化子篩選工作。這在一定程度上解釋了為何在眾多的天然產(chǎn)油真菌中,解脂耶氏酵母的遺傳操作工具最為完備[34,72-73],根本原因在于解脂耶氏酵母中有復(fù)制型質(zhì)粒可用[43-44]。目前在解脂耶氏酵母中已可成功實現(xiàn)基于同源重組的靶標基因的無痕刪除或整合(等位基因替換)[74],重組酶介導(dǎo)的位點特異性重組[75-76],多片段體內(nèi)/體外組裝[77-78],基于 zeta 因子或者 rDNA 序列的目的基因多拷貝整合[45,79],基于 CRISPR/Cas 系統(tǒng)的基因編輯[74,80-83],以及由CRISPR/Cas 系統(tǒng)輔助的堿基編輯[84]等多種操作。然而,一個潛在的問題是,解脂耶氏酵母傾向于啟動非同源末端連接(non-homologous end joining,NHEJ)而不是同源重組(homologous recombination,HR)來進行 DNA 修復(fù)[85],這導(dǎo)致在解脂耶氏酵母中進行精確的基因編輯時需設(shè)置長達1 kb 左右的上下游序列(同源臂),以方便同源重組[80]。在敲除與NHEJ 修復(fù)方式密切關(guān)聯(lián)的KU70基因后,解脂耶氏酵母的NHEJ 修復(fù)能力降低,相應(yīng)地,同源重組能力被刺激增強[80,86-87]。較高的同源重組能力不僅有助于宿主借助同源臂修復(fù)由Cas9、nCas9 以及重組酶造成的DNA 斷裂,而且可以大幅提升體內(nèi)多片段組裝的成功率,同時減少非特異性的修復(fù)或者非靶向插入。
除解脂耶氏酵母外,大部分產(chǎn)油真菌中無可用的復(fù)制型質(zhì)粒,外源基因只能被裝載在自殺質(zhì)粒或者整合型質(zhì)粒[如配合根癌農(nóng)桿菌介導(dǎo)轉(zhuǎn)化(ATMT)使用的Ti 質(zhì)粒]上,也就是說質(zhì)粒進入細胞后,質(zhì)粒上的非整合元件僅能在一個細胞分裂周期內(nèi)起作用,故而遺傳操作工具的作用(同源重組或隨機插入等重組行為)效率嚴重依賴于轉(zhuǎn)化效率。畢竟在重組概率一定的情況下,轉(zhuǎn)化子越多,獲得正轉(zhuǎn)化子的可能性就越大。以圓紅冬孢酵母為例,目前可在該酵母中使用的幾種CRISPR/Cas 系統(tǒng)均放置在自殺質(zhì)粒或者整合型的Ti 質(zhì)粒上以醋酸鋰化學(xué)轉(zhuǎn)化或ATMT 方式轉(zhuǎn)化進入胞內(nèi)[58-59,88]。CRISPR/Cas 系統(tǒng)中的 Cas9 表達盒多被整合在宿主基因組上,但引導(dǎo)Cas9 切割的sgRNA 均以瞬時表達獲得,Cas9 切割及同源臂修復(fù)需要在細胞分裂前完成。上述連續(xù)多步驟的DNA/蛋白質(zhì)互作過程必須在一個細胞周期內(nèi)完成,難度較大,故而圓紅冬孢酵母基因編輯的陽性轉(zhuǎn)化子的數(shù)目較少,而且整合型的Cas9 可能會引起潛在的脫靶問題[88]。對于部分可重復(fù)利用而又被整合在染色體上的基因元件(如抗性標記、營養(yǎng)缺陷型標記、報告基因等),需以特殊方法進行回收。由Cre/loxP、FLP/FRT、I-SceI 等重組酶系統(tǒng)介導(dǎo)的位點特異性重組已經(jīng)被引入圓紅冬孢酵母用于目的片段的回收[89-91]。影響基因編輯效率的另一個因素是圓紅冬孢酵母的DNA 修復(fù)系統(tǒng)。和解脂耶氏酵母類似,它也傾向于使用NHEJ而不是HR修復(fù)DNA,因此有必要在底盤菌株水平抑制NHEJ 或刺激 HR。Koh 等[92]發(fā)現(xiàn)KU70基因缺失后,圓紅冬孢酵母的CAR2基因的同源重組敲除株的比例可由10.5%提升至75.8%,顯示了較好的底盤可塑性。
在其他產(chǎn)油真菌中,遺傳操作工具的開發(fā)和應(yīng)用盡管受制于復(fù)制元件缺乏、轉(zhuǎn)化效率低下、同源重組能力較弱等因素,但也在不斷發(fā)展,目前已能夠?qū)崿F(xiàn)基本的異源基因過表達,靶標基因敲除等操作[20]。表2 總結(jié)了目前可在各種產(chǎn)油真菌中使用的遺傳操作工具及其效果。在CRISPR/Cas 系統(tǒng)出現(xiàn)之前,等位基因替換一直是產(chǎn)油真菌精細基因編輯的首選,但是現(xiàn)在正逐步被CRISPR/nCas9 或者CRISPR/Cpf1 以及它們輔助的堿基編輯技術(shù)替代。目前來看,CRISPR-Cas 系統(tǒng)是一種顛覆性技術(shù),有力加速了產(chǎn)油真菌的遺傳操作技術(shù)發(fā)展,但部分產(chǎn)油真菌缺乏可用的復(fù)制型質(zhì)粒、轉(zhuǎn)化效率低、同源重組能力弱等仍是限制基因編輯效率的瓶頸。
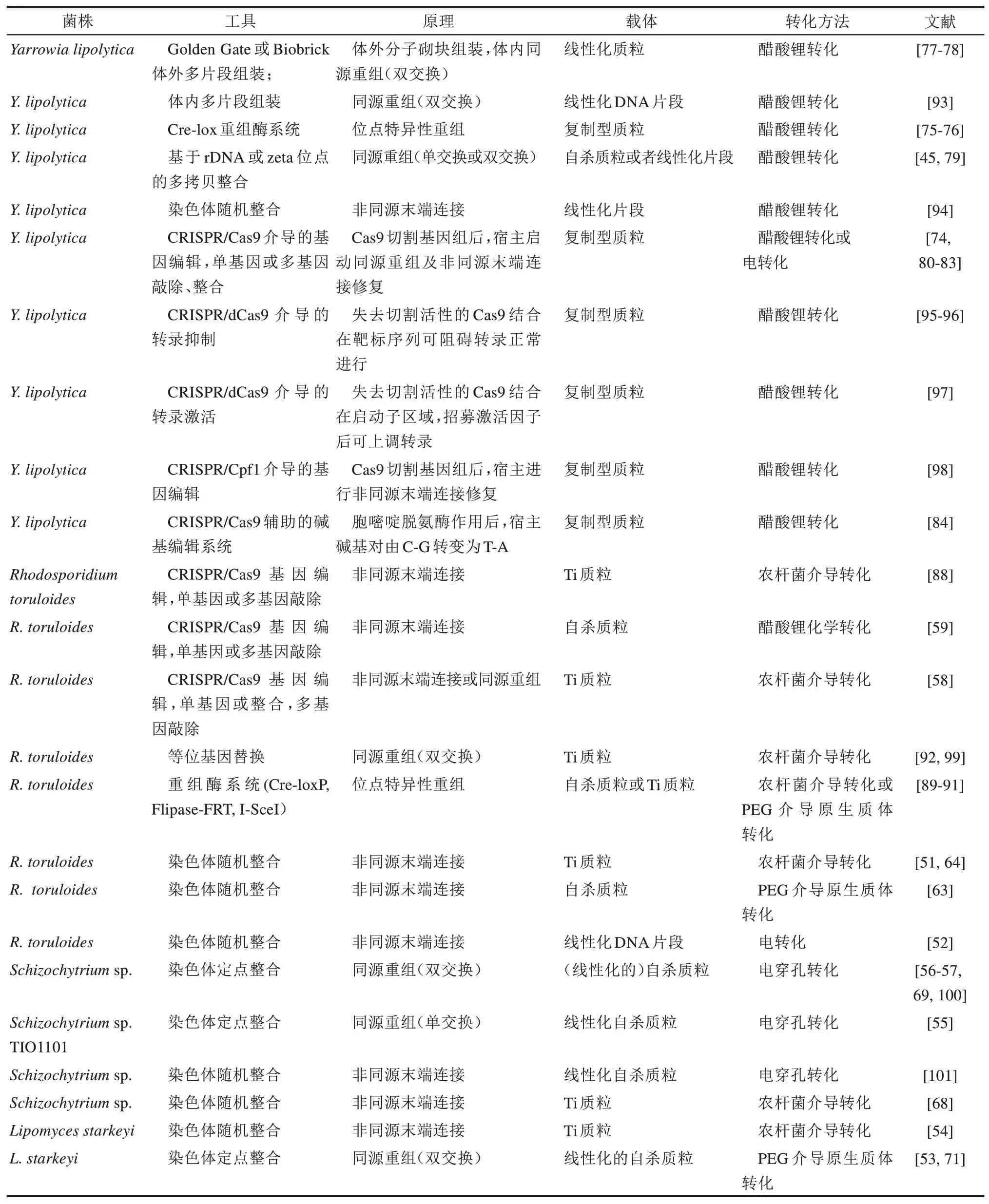
表2 典型產(chǎn)油真菌遺傳操作工具研究進展Tab.2 Research progress on genetic tools of typical lipid producing fungi
3 產(chǎn)油真菌代謝工程研究進展
組學(xué)數(shù)據(jù)加深了科學(xué)家對產(chǎn)油真菌的遺傳背景、生理、代謝方面的理性認識;質(zhì)粒轉(zhuǎn)化和遺傳操作技術(shù),以及啟動子、終止子、篩選標記和報告系統(tǒng),為代謝工程改造提供了工具。利用代謝工程改造解脂耶氏酵母、圓紅冬孢酵母、裂殖壺菌、斯達氏油脂酵母等在脂肪酸及其衍生產(chǎn)品開發(fā)[102]、類胡蘿卜素的產(chǎn)量提升、胞內(nèi)產(chǎn)物外排/分泌、底物譜拓展以及菌株抗逆研究等方面已經(jīng)取得了一些進展,顯示了進一步分子遺傳改造的巨大潛力。如前所述,解脂耶氏酵母的遺傳操作工具發(fā)展最為成熟,因此其代謝工程改造研究也最為系統(tǒng)和完善[103-104]。本節(jié)以解脂耶氏酵母為例,詳細介紹產(chǎn)油真菌代謝工程的策略及研究進展。
解脂耶氏酵母(Yarrowia lipolytica)屬半子囊菌類,嚴格好氧,是食品安全級菌株[7,105]。作為應(yīng)用最廣泛、研究最多的非常規(guī)酵母之一,解脂耶氏酵母具有理化特征和遺傳背景較清晰、分子操作相對成熟、代謝調(diào)控可控等優(yōu)勢[106],已被廣泛地認作是脂質(zhì)合成微生物的模式菌株。由于其抗逆性強、耐酸堿環(huán)境、底物譜廣、胞內(nèi)乙酰輔酶A和三羧酸循環(huán)代謝通量高等特殊的理化性質(zhì)和代謝特征,被廣泛地認為具有卓越的生物技術(shù)工業(yè)應(yīng)用價值,因此已被開發(fā)作為諸多精細化學(xué)品和天然產(chǎn)物的潛在微生物細胞工廠。目前產(chǎn)品包括二十二碳六烯 酸[9]、 赤 蘚 糖 醇[107]、 檸 檬 酸[108]、 2-苯 乙醇[109-110]、番茄紅素[111]、蝦青素[112]、法呢烯[113]、芳樟醇[114]、花生四烯酸[115-116]、紫色桿菌素[109]和超長鏈蠟酯[117]等。特別地,解脂耶氏酵母的脂質(zhì)積累量能達到細胞干重的38%[118-120]。
在解脂耶氏酵母油脂合成途徑中,三酰基甘油酯(TAGs)首先被合成,隨后通過一系列化學(xué)修飾包括氧化、碳鏈延伸、復(fù)分解或碳氫活化生成脂質(zhì)終產(chǎn)物[121]。近年來隨著合成生物學(xué)及代謝工程技術(shù)的發(fā)展,解脂耶氏酵母也被賦予了合成非常規(guī)脂肪酸及脂肪酸衍生物的能力,如多不飽和脂肪酸和γ-癸內(nèi)酯等[122]。具體來說,在外界環(huán)境中氮源含量較低的情況下,解脂耶氏酵母細胞會激活、協(xié)調(diào)不同的代謝途徑以葡萄糖或其他碳源(如有機酸、醇等)為底物合成三酰基甘油酯[122]。其代謝機理是氮限制導(dǎo)致解脂耶氏酵母胞內(nèi)AMP濃度迅速下降,低水平的AMP抑制了異檸檬酸脫氫酶(IDH)的活性,進而下調(diào)三羧酸循環(huán)(TCA)的代謝通量,導(dǎo)致檸檬酸在線粒體中積累;過量積累的檸檬酸會在線粒體膜轉(zhuǎn)換蛋白作用下轉(zhuǎn)運至細胞質(zhì),之后通過ATP 檸檬酸裂解酶(ACL)將檸檬酸裂解為胞質(zhì)乙酰輔酶A 和草酰乙酸,胞質(zhì)乙酰輔酶A 是脂質(zhì)的合成直接前體。式(1)為解脂耶氏酵母中脂肪酸(酰基輔酶A)
合成的總化學(xué)計量關(guān)系式(其中n和m分別表示鏈長和不飽和度)[122]:
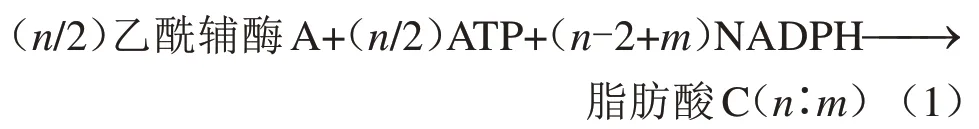
進一步,3 分子酰基輔酶A 與1 分子甘油-3-磷酸(G3P)在內(nèi)質(zhì)網(wǎng)和脂質(zhì)體表面通過Kennedy 途徑縮合形成三酰基甘油酯,并儲存于脂質(zhì)體(lipid body)中,具體反應(yīng)如下:首先,在甘油-3-磷酸酰基轉(zhuǎn)移酶(SCT1)的作用下消耗1分子酰基輔酶A 酰化甘油-3-磷酸形成溶血磷脂酸(LPA);進一步,消耗1 分子酰基輔酶A,血磷脂酸被血磷脂酸酰基轉(zhuǎn)移酶(SLC1)酰化生成酸鈦酸(PA);酸鈦酸被酸鈦酸磷酸酶(PAP)去磷酸化釋放二酰基甘油(DAG);最后,以1 分子酰基輔酶A 為最終酰基供體通過DAG 酰基轉(zhuǎn)移酶(DGA1 或DGA2)合成三酰基甘油,或以甘油磷脂為酰基供體通過磷脂DAG酰基轉(zhuǎn)移酶(LRO1)合成[122-123]。
基于清晰的脂質(zhì)代謝網(wǎng)絡(luò)(圖3),通過工程手段理性地進行合成途徑設(shè)計、前體強化供給、途徑表達優(yōu)化、降解途徑抑制及調(diào)控網(wǎng)絡(luò)編輯重構(gòu)等技術(shù)能有效地改善、提高解脂耶氏酵母合成脂質(zhì)產(chǎn)物的能力[124]。其中,最成功、典型的案例是美國杜邦公司通過引入多個拷貝的異源延長酶和去飽和酶基因,同時對解脂耶氏酵母自身的脂質(zhì)合成途徑進行重構(gòu),包括過表達C16/18延伸酶、Δ12 去飽和酶、降低過氧化物體β-氧化活性等,最終工程菌株能生產(chǎn)占總細胞干重的25%的二十碳五烯酸(EPA),成功實現(xiàn)了EPA 微生物發(fā)酵法商業(yè)生產(chǎn)[9]。此外,麻省理工學(xué)院Stephanopoulos 團隊重構(gòu)解脂耶氏酵母胞內(nèi)NADPH 的合成網(wǎng)絡(luò),有效地促進了油脂的合成,最終油脂達到98.9 g/L,產(chǎn)量再創(chuàng)紀錄[22]。下面結(jié)合近年來微生物合成油脂進展(表3),通過代謝工程角度主要從脂質(zhì)合成途徑優(yōu)化、輔因子工程、降解途徑抑制和分泌等方面進行介紹如何設(shè)計、構(gòu)建解脂耶氏酵母脂質(zhì)細胞工廠。

表3 代謝工程改造Yarrowia lipolytica合成油脂及衍生品的研究進展Tab.3 Research progress in metabolic engineering of Yarrowia lipolytica synthesizing lipids and derivatives

續(xù)表

圖3 產(chǎn)油真菌胞內(nèi)脂質(zhì)合成代謝網(wǎng)絡(luò)Fig.3 Lipid biosynthesis network of oil producing fungi
3.1 前體合成途徑優(yōu)化
解脂耶氏酵母胞質(zhì)中乙酰輔酶A 是由ATP 檸檬酸裂解酶(ACL)裂解檸檬酸產(chǎn)生,其作為乙酰基供體,是脂肪酸酰基鏈延伸的基本單位。然而,過表達或異源表達的ATP 檸檬酸裂解酶均未顯著提高解脂耶氏酵母的脂肪酸產(chǎn)量[136-137],可能是由于解脂耶氏酵母的胞質(zhì)乙酰輔酶A 合成與氮饑餓存在代謝偶聯(lián)。為此,Xu 等[20]設(shè)計了5 種胞質(zhì)乙酰輔酶A的合成方式以解除胞質(zhì)乙酰輔酶A的合成與氮饑餓的代謝偶聯(lián),包括丙酮酸-乙酸途徑、丙酮酸-乙醛途徑、丙酮酸甲酸裂解酶、乙酰輔酶A穿梭回路和非氧化磷酸戊糖途徑,結(jié)果表明構(gòu)建乙酰輔酶A 穿梭回路和非氧化磷酸戊糖途徑能顯著地增加了油脂的產(chǎn)量。此外,引入釀酒酵母來源的乙酰輔酶A 合成酶(ACS2)也能有效促進脂油脂的合成[138]。特別是,乙酸攝取途徑可以作為乙酰輔酶A 合成供給的捷徑,以乙酸為碳源同時強化乙酸合酶能顯著提高胞質(zhì)乙酰輔酶A 的水平[139]。
乙酰輔酶A 羧化酶ACC 能催化乙酰輔酶A 生成丙二酰輔酶A,丙二酰輔酶A是肪酸酰基鏈延伸的骨架。Tai 等[140]過表達解脂耶氏酵母自身的乙酰輔酶A 羧化酶ACC,能促使脂肪酸的產(chǎn)量增加2 倍,表明強化乙酰輔酶A 羧化酶的表達也是促進脂質(zhì)合成的關(guān)鍵。
3.2 輔因子工程
脂質(zhì)是還原度較高的代謝產(chǎn)物,來源于乙酰輔酶A 的乙酰基(CH3—CO—)只能通過NADPH還原后,才能成為脂肪酸的酰基鏈[52]。研究表明,NADPH 供給是解脂耶氏酵母脂質(zhì)合成的重要限速步驟,且NADPH 的供給方式會影響底物/產(chǎn)物電子傳遞效率,進而改變脂質(zhì)產(chǎn)量和得率[22]。通常來說,在產(chǎn)油真菌中胞質(zhì)NADPH 的供應(yīng)有2 種方式,分別是磷酸戊糖途徑和蘋果酸酶[141]。Wasylenko 等采用13C 同位素標記法對脂肪酸高/低產(chǎn)解脂耶氏酵母工程菌株進行代謝流分析,確定胞質(zhì)NADPH 主要通過磷酸戊糖途徑供給[142]。與此同時,Dulermo 和Zhang 等分別對解脂耶氏酵母中蘋果酸酶編碼基因MAE1進行失活和過表達,皆未顯著影響油脂的合成[133,143],進一步佐證了解脂耶氏酵母胞質(zhì)NADPH 主要通過磷酸戊糖途徑供給的結(jié)論。強化表達解脂耶氏酵母磷酸戊糖途徑中葡萄糖-6-磷酸脫氫酶ZWF1,油脂產(chǎn)量能較出發(fā)菌株提高41%[129]。值得一提的是,Qiao 等通過設(shè)計、引入人工合成途徑重構(gòu)胞質(zhì)NADPH 供給,打破解脂耶氏酵母自身NADPH 代謝的桎梏,實現(xiàn)將糖酵解途徑產(chǎn)生的NADH 轉(zhuǎn)化為NADPH,最終油脂產(chǎn)量達98.9 g/L,此產(chǎn)量為目前報道最高[22]。
3.3 降解途徑抑制
當碳底物耗盡時,脂質(zhì)會通過再活化(remobilization)或β-氧化降解方式以維持細胞正常代謝[141]。解脂耶氏酵母的脂質(zhì)再活化是由脂肪酶TGL4 催化,該酶定位于脂質(zhì)體表面,敲除該基因能將脂肪酸產(chǎn)量提高2 倍[144]。解脂耶氏酵母的β-氧化發(fā)生在過氧化物酶體中,共包括四個反應(yīng),最終將酰基鏈縮短兩個碳,釋放一個乙酰輔酶A分子[122]。β-氧化途徑第一步反應(yīng)是由6 種酰基輔酶A 氧化酶(POX1-6)催化,其可識別不同鏈長的酰基輔酶A;第二步和第三步反應(yīng)是由雙功能過氧化物酶(MFE2)完成;最后一步反應(yīng)由3-酮酰輔A 硫醇化酶(POT1)實現(xiàn),抑制β-氧化是防止脂質(zhì)降解、促進脂質(zhì)進一步積累的主要工程靶點。比如,Dulermo等失活基因POX1-6和MFE1,同時優(yōu)化解脂耶氏酵母的脂肪酸合成途徑,最終脂質(zhì)積累量能達到細胞干重的65%~75%[119]。此外,敲除過氧化物酶體中PEX3、PEX10和PEX311基因(編碼過氧化物酶體基質(zhì)蛋白),能破壞過氧化物酶體的形成,抑制β-氧化,有效增加脂質(zhì)的產(chǎn)量[9,21,145]。
3.4 脂肪酸的分泌
盡管相比于野生菌株,工程解脂耶氏酵母菌株合成脂質(zhì)產(chǎn)物的能力取得了實質(zhì)性的進展[122],但到目前為止,只有高附加值脂質(zhì)產(chǎn)物EPA 實現(xiàn)了工業(yè)化生產(chǎn)[9],因此為了進一步推動微生物脂質(zhì)工業(yè),工程菌株合成脂質(zhì)的能力亟待進一步提高。脂質(zhì)分泌合成為構(gòu)建高效微生物油脂細胞工廠提供新的契機,將脂質(zhì)產(chǎn)物分泌至胞外,不僅能增加產(chǎn)量,也能避免中間代謝物積累對細胞造成毒性,同時還可以減少產(chǎn)物回收的成本。為此,Amaro等首先將參與脂肪酸再活化和降解相關(guān)的兩個基因(FAA1和MFE2)缺失,缺失后的細胞不再能將脂肪酸轉(zhuǎn)化為酰基輔酶A或進行β-氧化,并進一步消除脂質(zhì)體的形成以釋放游離脂肪酸。最終,工程菌株的胞外的游離脂肪酸濃度為10.4 g/L,相當于每克細胞合成1.2 g 的脂質(zhì),遠遠超過細胞的存儲極限[120]。
相比于解脂耶氏酵母,其他典型產(chǎn)油真菌如圓紅冬孢酵母、裂殖壺菌、破囊壺菌及斯達氏油脂酵母的代謝工程研究還處于起步階段[11,53,100-101,125],基本停留在油脂合成途徑關(guān)鍵基因的超表達階段,旁路途徑的弱化或敲除都還比較少見,暗示目前的代謝工程改造研究仍在初級階段,缺乏系統(tǒng)性和大局觀。因此,開發(fā)新型遺傳操作工具助推代謝工程研究是當務(wù)之急。代謝工程研究的另一個迫切需求是升級目標產(chǎn)物。目前的代謝工程改造主要以油脂高產(chǎn)為目的。事實上,很多油脂的衍生產(chǎn)品如不飽和脂肪酸、烷烴、脂肪醇等屬于高附加值產(chǎn)品,也值得大力開發(fā)。
4 產(chǎn)油真菌產(chǎn)品高值化研究進展
以不飽和脂肪酸、長鏈烷烴、脂肪醇、萜類為代表的高值化學(xué)品由于應(yīng)用領(lǐng)域廣、經(jīng)濟性高而具備良好的商業(yè)價值。代謝工程改造模式微生物如大腸桿菌、釀酒酵母用于高值化學(xué)品的合成已進行廣泛的研究和綜述。近年來,越來越多研究者嘗試利用解脂耶氏酵母、圓紅冬孢酵母、裂殖壺菌、破囊壺菌等產(chǎn)油真菌合成高值化合物。這些真核產(chǎn)油微生物在油脂產(chǎn)量和生產(chǎn)強度上有明顯優(yōu)勢,因此在上述高值化學(xué)品合成應(yīng)用中極具開發(fā)潛力[146]。
破囊壺菌和裂殖壺菌由于具有生物量高,抗逆性強,底物譜廣、天然產(chǎn)油量高以及油脂中高附加值不飽和脂肪酸占比極高的特征[25-26],適用于不飽和脂肪酸及相關(guān)高值衍生物的生產(chǎn)。破囊壺菌(Thraustochytrium)和裂殖壺菌屬于破囊壺菌科(Thraustochytriaceae),是一類單細胞海洋原生生物,常見于海水和紅樹林中,其中多種不飽和脂肪酸高產(chǎn)菌種已經(jīng)被鑒定[147-149]。由于早期研究中,裂殖壺菌和破囊壺菌的分類學(xué)和系統(tǒng)發(fā)育研究存在一定混亂和交叉,以下介紹中以裂殖壺菌為主,包括部分破囊壺菌內(nèi)容。
裂殖壺菌的脂肪酸組成很簡單,主要是以C14:0和 C16:0為代表的短鏈脂肪酸以及以 C22:5和 C22:6為主的長鏈多不飽和脂肪酸[150]。在作為DHA生產(chǎn)菌的菌株篩選過程中,研究人員還發(fā)現(xiàn)了其他具有商業(yè)價值的化合物如類胡蘿卜素或角鯊烯的積累。這些化學(xué)品已被廣泛應(yīng)用于食品,飼料和藥品領(lǐng)域,以產(chǎn)油真菌作為細胞工廠合成相關(guān)高附加值化合物將極具應(yīng)用價值。
4.1 DHA
20 世紀80 年代中期開始,人們開始認識到長鏈多不飽和ω-3 脂肪酸(如EPA、DHA)的重要性[151]。DHA 是一種對人類健康必不可少的不飽和脂肪酸,可以促進眼睛和神經(jīng)系統(tǒng)的發(fā)育,且有利于成年人心血管健康,其最初的主要來源是深海魚油。裂殖壺菌能夠以三酰基甘油的形式積聚高水平的脂質(zhì),其中DHA 含量可高達總脂質(zhì)的30%~70%,因此作為DHA 生產(chǎn)者極具競爭力[150]。從裂殖壺菌種提取的富含DHA油脂已被美國FDA 授予公認安全(Generally Recognized as Safe,GRAS)認證用于商業(yè)化生產(chǎn)。
20 世紀90 年代初期,研究人員成功鑒定并開始使用裂殖壺菌生產(chǎn)DHA[152]。幾年后,美國OmegaTech 公司將基于裂殖壺菌的富DHA 油進行商業(yè)化,該公司后來被Martek 收購,現(xiàn)在已成為DSM 的一部分[153]。
裂殖壺菌和破囊壺菌使用標準的脂肪酸合酶復(fù)合物來合成短鏈飽和脂肪酸,主要是C14:0和C16:0[154]。對于長鏈不飽和脂肪酸,在自然界中存在兩種生物合成途徑:延長去飽和酶途徑和聚酮合酶(PKS)途徑。延長去飽和途徑從短鏈飽和脂肪酸出發(fā),利用去飽和酶和延長酶來產(chǎn)生多不飽和脂肪酸。而PKS 途徑可催化不飽和脂肪酸的從頭合成,在該過程中,通過還原、脫水、還原、縮合的循環(huán)合成長鏈不飽和脂肪酸[155]。已有研究表明,裂殖壺菌及破囊壺菌通過PKS 途徑合成高水平的DHA[156]。相比于FAS途徑,通過PKS合成1分子DHA需消耗14分子還原力NADPH,相比延長去飽和途徑節(jié)約了40%,同時副產(chǎn)物更少。
裂殖壺菌和破囊壺菌的油脂積累具有階段性的特征,在未經(jīng)基因工程改造的裂殖壺菌和破囊壺菌中,通過控制氮源、溶解氧實現(xiàn)的多階段發(fā)酵過程結(jié)合合適的發(fā)酵罐設(shè)計和放大策略,可顯著提高油脂和 DHA 產(chǎn)量[25,157-158]。而通過合適的發(fā)酵罐選擇和發(fā)酵放大策略,裂殖壺菌可實現(xiàn)生物量超過150 g/L,油脂產(chǎn)量103.6 g/L,DHA 產(chǎn)量44.3 g/L,DHA 產(chǎn)率369.08 mg(/L·h)[25]。在此基礎(chǔ)上,已有研究通過代謝工程手段對裂殖壺菌進行改造以獲得更優(yōu)良的產(chǎn)油性能。如通過表達超氧化物歧化酶基因以減輕發(fā)酵過程中胞內(nèi)產(chǎn)生的活性氧,從而提升DHA產(chǎn)量[100]。
4.2 角鯊烯
角鯊烯是固醇生物合成的中間體,被廣泛用作藥物乳劑中的賦形劑,用于遞送疫苗、藥物和其他藥用前體。角鯊烯可以改善免疫系統(tǒng),因此可以用作癌癥治療中的保護劑,也可作為化妝品中的保濕劑和抗氧化劑[159]。從2014 年到2019 年,角鯊烯的全球銷量由4156.9 t增加至6547.2 t,復(fù)合年增長率為9.80%,預(yù)計到2025 年,角鯊烯全球銷售額將達到1.64億美元。
由于存在甲羥戊酸(mevalonate,MVA)途徑和充裕的乙酰輔酶A 供應(yīng),因此在裂殖壺菌和破囊壺菌中可通過MVA 途徑經(jīng)由法呢基二磷酸(farnesyl diphosphate, FPP) 合 成 角 鯊 烯 。 以Aurantiochytrium屬為代表的一些破囊壺菌,已被證明可積累超過30% DCW 的角鯊烯。其中菌株18 W-13a 和Yonez5-1 分別能夠生產(chǎn)占總脂質(zhì)69%和94%的角鯊烯[160-161],但產(chǎn)量較低(約1 g/L)。裂殖壺菌CCTCC M209059 可在生長和脂質(zhì)積累階段前期積累大量角鯊烯,達到總脂質(zhì)38%,滴度最高可達約3 g/L[162],而在脂質(zhì)積累后期角鯊烯濃度會逐漸降低。
由于缺乏生產(chǎn)動力學(xué)研究,破囊壺菌和裂殖壺菌的角鯊烯合成水平暫時相對較低,后續(xù)提升空間很大。而相對明確的、線性的生物合成途徑和也提示基因工程改造可能是提高產(chǎn)油真菌角鯊烯產(chǎn)量的有效策略。
4.3 類胡蘿卜素
類胡蘿卜素是一類天然色素的總稱,可分為葉黃素和胡蘿卜素。商業(yè)上最重要的類胡蘿卜素是葉黃素中的蝦青素、雞油菌素、葉黃素和玉米黃素,以及胡蘿卜素中的β-胡蘿卜素和番茄紅素。類胡蘿卜素的主要用途是在食品和飼料中用作著色劑,也由于具有抗氧化功能在營養(yǎng),藥品和化妝品領(lǐng)域的應(yīng)用不斷增加[163]。目前由于微生物合成法不具有成本優(yōu)勢,大多數(shù)類胡蘿卜素目前仍由化學(xué)合成或通過植物提取獲得。
類胡蘿卜素的合成與角鯊烯類似,均通過MVA途徑合成,并且以FPP為共同前體。已有研究表明破囊壺菌ONC-T18可同時合成β-胡蘿卜素和蝦青素、玉米黃質(zhì)等類胡蘿卜素,總含量約為30 μg/g DCW[164]。破囊壺菌 CHN-1 和Aurantiochytriumsp.KH105都被報道可以合成少量蝦青素[165-166]。迄今為止報道類胡蘿卜素天然產(chǎn)量最高的產(chǎn)油真菌是破囊壺菌AS4-A1,可合成高達0.3~0.45 g/L 蝦青素[167]。
解脂耶氏酵母由于同樣具備MVA 途徑及充裕的乙酰輔酶A 供給,已被用于代謝工程改造合成類胡蘿卜素如β-胡蘿卜素[168-169]、番茄紅素[170]或蝦青素[112]。也可借鑒相應(yīng)策略用于提升裂殖壺菌和破囊壺菌的類胡蘿卜素類化合物產(chǎn)量。
5 總結(jié)與展望
微生物油脂作為重要化工原料及潛在的營養(yǎng)補充物,在保障我國經(jīng)濟發(fā)展、糧食安全、能源安全等方面有重要作用。相比于細菌,天然產(chǎn)油真菌在油脂產(chǎn)量和生產(chǎn)強度上有巨大優(yōu)勢,有潛力被進一步改造為油脂細胞工廠。當前天然產(chǎn)油真菌改造的主要瓶頸在于缺乏遺傳操作工具。幸運的是,合成生物學(xué)的飛速發(fā)展有力推動了該領(lǐng)域的研究。天然產(chǎn)油真菌在合成生物學(xué)元件挖掘、外源基因轉(zhuǎn)化方法以及遺傳工具開發(fā)等方面已取得重要進展。而且,隨著基因組和轉(zhuǎn)錄組研究深入,越來越多的內(nèi)源基因元件如啟動子、終止子、篩選標記、復(fù)制子等會被鑒定和使用。另外,很多在模式菌株如釀酒酵母或者絲狀真菌中已經(jīng)成功應(yīng)用的轉(zhuǎn)化方法、遺傳工具、篩選標記或者報告系統(tǒng)也開始被引入產(chǎn)油真菌。 以上努力將促成產(chǎn)油真菌遺傳操作技術(shù)尤其是基因編輯技術(shù)的不斷改進和迭代更新,有力推動其代謝工程及產(chǎn)品升級研究。當前的代謝工程及產(chǎn)品高值化研究與合成生物學(xué)思想聯(lián)系緊密,跨物種募集元件,超時空調(diào)試途徑及網(wǎng)絡(luò)已成為可能,但元件、途徑、裝置之間及它們與宿主系統(tǒng)的適配仍是當前的主要難題,需要依賴可靠的模型或者算法指導(dǎo),需要依托精確高效的基因編輯工具和先進發(fā)酵控制系統(tǒng)。
可以預(yù)期,在合成生物學(xué)時代,未來的產(chǎn)油真菌的代謝工程將更多地與遺傳操作工具開發(fā)和產(chǎn)品高值化升級相聯(lián)系。以人工智能和大數(shù)據(jù)技術(shù)挖掘和表征新型合成生物學(xué)元件,借鑒和引進已經(jīng)在其他菌株中高效使用的遺傳轉(zhuǎn)化方法,開發(fā)更多的高效基因編輯工具將成為常態(tài);而代謝工程在基因組規(guī)模代謝網(wǎng)絡(luò)模型、流平衡分析算法以及更先進模型算法的指引下,在多尺度智能過程控制裝備的協(xié)助下,有力推動下一代產(chǎn)真核油脂細胞工廠的開發(fā)。

