肝細胞內質網(wǎng)應激對tsRNA表達譜的影響及其功能研究
李 涵 潘 勤
內質網(wǎng)是真核細胞內一類膜性細胞器,有脂質合成、蛋白質加工及鈣離子穩(wěn)態(tài)調節(jié)等重要功能。當細胞受到損傷刺激時,可發(fā)生以內質網(wǎng)腔內錯誤折疊或未折疊蛋白積聚、鈣離子平衡紊亂為特征的內質網(wǎng)應激(endoplasmic reticulum stress, ERS)[1]。適度的ERS有助于內質網(wǎng)穩(wěn)態(tài)的恢復,持續(xù)的ERS則可能誘導細胞凋亡。
近年來伴隨肥胖的全球流行和生活方式的逐漸西化,以肝細胞脂肪變性、氣球樣變、小葉內炎癥等為主要病理表現(xiàn)的非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)日益高發(fā),已經成為公共衛(wèi)生的重要負擔[2]。有研究表明,ERS既能夠誘導脂肪生成,又可參與胰島素抵抗和自噬來驅動肝臟脂肪變性,從而在NAFLD的發(fā)生、發(fā)展過程中發(fā)揮著重要作用[3]。然而,ERS介導NAFLD的病理生理機制尚未完全闡明。
據(jù)近年來相關文獻報道,應激可誘導一類tRNA衍生性小RNA(tRNA derived small RNA, tsRNA)的產生。tsRNA是由成熟tRNA或tRNA前體經酶切產生的非編碼RNA[4]。研究顯示,tsRNA在肥胖癥、酒精性脂肪性肝病等代謝性疾病的發(fā)病機制中發(fā)揮重要作用[5~7]。因此,本研究采用棕櫚酸鈉誘導肝細胞脂肪變,從而建立ERS模型,以此為基礎探討tsRNA在肝脂肪變中的表達情況及其潛在功能。
材料與方法
1.材料:小鼠肝細胞株AML12由中國科學院細胞庫提供; ITS液體培養(yǎng)基補充劑(100×,ITS liquid media supplement)、棕櫚酸(palmitic acid, PA)及油紅O粉末均購自美國Simga-Aldrich公司;胎牛血清(fetal bovine serum, FBS)、DMEM/F12培養(yǎng)基購自美國Gibco公司;RT-qPCR試劑盒購自日本TaKaRa公司;葡萄糖調節(jié)蛋白78(glucose regulated protein78,GRP7) 兔單克隆抗體、CCAAT增強子結合蛋白同源蛋白(C/EBP homologous protein C/EBP,CHOP)兔單克隆抗體購自美國CST公司;β-tubulin兔單克隆抗體及山羊抗兔二抗購自上海優(yōu)寧維公司;RT-qPCR引物購自生工生物工程(上海)股份有限公司。
2.細胞培養(yǎng)及ERS模型的建立:采用含ITS、40ng/ml地塞米松及10%FBS的DMEM/F12完全培養(yǎng)基,于37℃、5%CO2條件下培養(yǎng)AML12細胞。取對數(shù)生長期的AML12細胞,隨機分為對照組和高脂組,每組設3個重復。待細胞融合度達50%~60% 時,高脂組給予200μmol/L PA干預24h以建立ERS模型,對照組予不含PA的完全培養(yǎng)基培養(yǎng)24h。
3.RT-qPCR檢測mRNA的表達:收集各組AML12細胞,采用Trizol法提取細胞總RNA,測定濃度及純度后反轉錄為cDNA。然后以cDNA為模板,GAPDH為內參照進行qPCR反應,并采用2-ΔΔCt法計算GRP78、CHOP的相對表達量。GRP78的上游引物序列為:5′-GTGTGTGAGACCAGAACCGT-3′,下游引物序列為:5′-TAGGTGGTCCCCAAGTCGAT-3′;CHOP的上游引物序列為:5′-CCACCACACCTGAAAGCAGAA-3′,下游引物序列為:5′-AGGTGAAAGGCAGGGACTCA-3′。
4.Western blot法檢測蛋白的表達:收集各組AML12細胞,加入RIPA裂解液,冰上靜置30min,收集裂解液,離心后取上清,用BCA法測定蛋白濃度。采用10%SDS-PAGE膠行蛋白電泳分離,并轉移至PVDF膜。以5%脫脂牛奶室溫封閉2h后,分別加入抗GRP78(1∶1000)和CHOP(1∶1000)抗體4℃孵育過夜。TBST清洗后加入二抗,室溫孵育1h。采用化學發(fā)光液進行顯影。以β-tubulin作為內參,分析蛋白的相對表達量。
5.油紅O染色:將各組細胞以4%多聚甲醛固定30min,PBS漂洗兩次,隨后根據(jù)試劑盒說明書進行油紅O染色。
6.tsRNA測序:收集各組細胞,以Trizol法提取總RNA,測定其濃度及純度后采用以下步驟制備文庫:①3′接頭連接;②5′接頭連接;③cDNA合成;④PCR擴增;⑤回收0~150bp的PCR擴增片段。使用Agilent 2100 Bioanalyzer儀器檢測文庫質量,并根據(jù)供應商操作說明,在Illumina HiSeq 4000測序儀上進行50個循環(huán)測序。
7.差異tsRNA的鑒定:使用Q30進行質控分析,保留Q30>80%的測序結果。采用Cutadapt軟件(v1.9.3)去除接頭和低質量reads,得到長度≥16nt的trimmed reads。依據(jù)tsRNA數(shù)據(jù)庫(MINTbase v2.0)的注釋,統(tǒng)計每個tsRNA在每個樣品trimmed reads中的計數(shù),將其作為該tsRNA的原始表達量。然后使用edgeR軟件(v3.16.5)計算各tsRNA的變化倍數(shù)和P值。采用倍數(shù)變化>2.0和P<0.05為標準,篩選顯著差異表達的tsRNA。
8.生物信息學分析:使用基于TargetScan(http:∥www.targetscan.org)和miRanda(http:∥www.microrna.org)的miRNA靶基因預測工具,預測tsRNA在小鼠mRNA 3′非翻譯區(qū)的結合位點。在此基礎上進行基于Geneontology (http:∥www.geneontology.org/)的功能分析,以及基于KEGG(Kyoto Encyclopedia of Genes and Genomes )數(shù)據(jù)庫(http:∥www.kegg.jp/)的信號通路分析。

結 果
1.肝細胞ERS模型的構建:經200μmol/L 的PA干預24h后,采用RT-qPCR和Western blot法分別檢測內質網(wǎng)應激標志物GRP78、CHOP的表達變化。結果顯示,高脂組GRP78及CHOP的mRNA和蛋白表達水平較對照組顯著上調(P<0.01),詳見圖1。
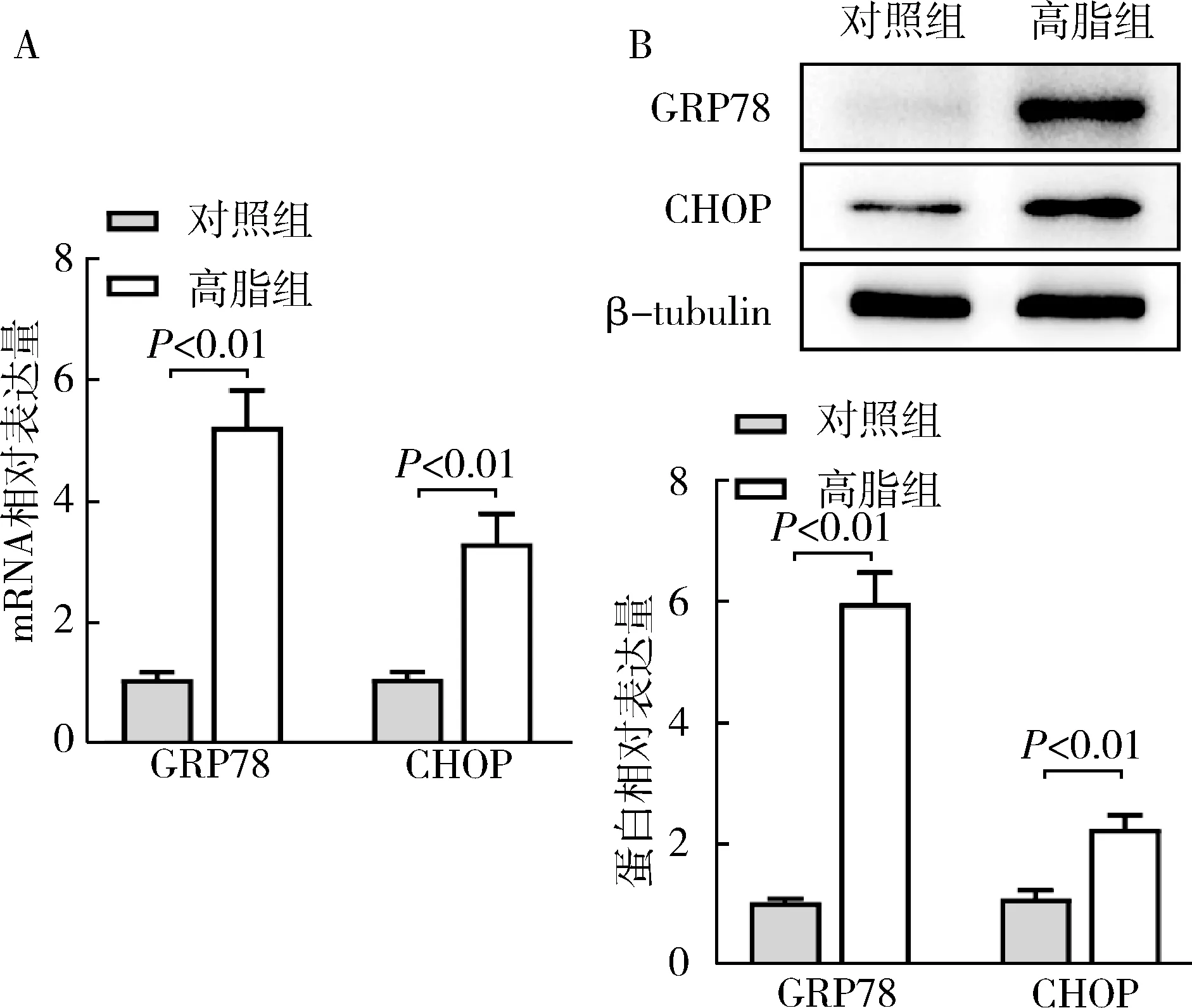
圖1 棕櫚酸誘導肝細胞ERS A.GRP78和CHOP mRNA表達水平; B.GRP78和CHOP蛋白表達水平
2.肝細胞ERS對脂肪變性的影響:經油紅O染色,對照組AML12細胞內未見明顯的脂滴沉積,而高脂組的細胞質內存在大量紅色脂滴,詳見圖2。

圖2 肝細胞油紅O染色(×100) A.對照組;B.高脂組
3.肝細胞ERS對tsRNA表達譜的影響及差異tsRNA的靶基因預測:對高脂組(n=3)和對照組(n=3)的細胞進行tsRNA測序,在兩組中共鑒定出193條tsRNA。以倍數(shù)變化>2及P<0.05為標準,進一步篩選得到10條顯著上調的tsRNA和28條顯著下調的tsRNA,詳見圖3。上調的前5位tsRNA包括:tsRNA-Ser-AGA、tsRNA-Met-CAT、tsRNA-Arg-TCG、tsRNA-Ile-AAT、tsRNA-Ser-GCT;下調的前5位tsRNA包括:tsRNA-Glu-CTC、tsRNA-pre-Val-TAC-1、tsRNA-pre- Val-TAC-2、tsRNA-Lys-CTT、tsRNA-pre-Val-TAC-3。使用基于TargetScan和miRanda的預測工具對tsRNA作用的靶基因進行預測,共得到4973個靶基因。
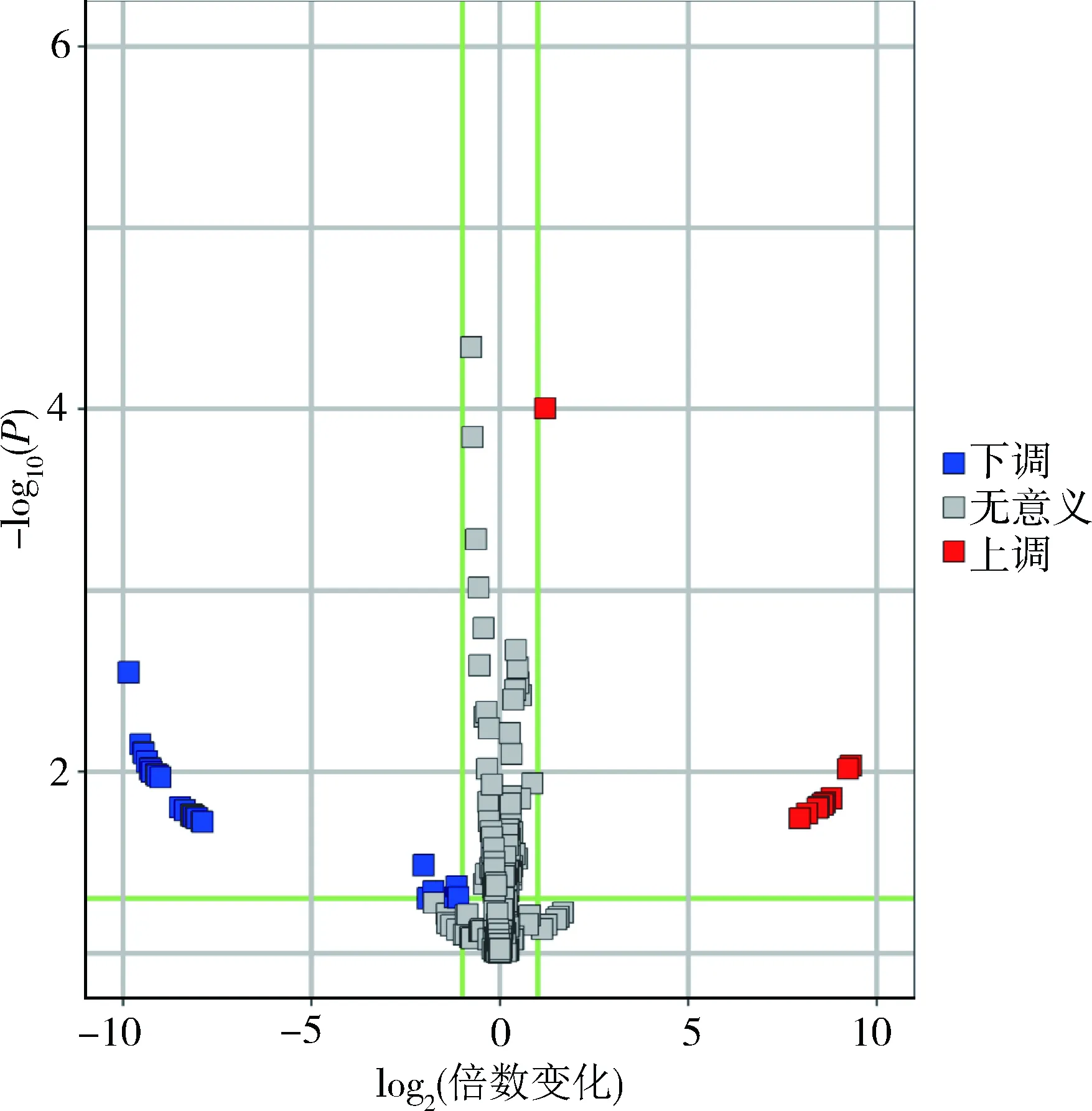
圖3 肝細胞ERS對tsRNA表達譜的影響
4.差異tsRNA靶基因的信號通路分析:針對差異tsRNA的預測靶基因進行KEGG分析。上調的差異tsRNA調控的靶基因在cAMP信號通路、壞血酸和藻酸鹽代謝、戊糖和葡萄糖醛酸酯的相互轉化、淀粉和蔗糖代謝等肝細胞代謝相關的信號通路中高度富集,詳見圖4。下調的差異tsRNA的靶基因則主要富集于Rap1信號通路、Ras信號通路、VEGF信號通路、甘油磷脂代謝等信號通路,詳見圖5。

圖4 上調的差異tsRNA靶基因的KEGG分析

圖5 下調的差異tsRNA靶基因的KEGG分析
5.差異tsRNA預測靶基因的功能分析:針對差異tsRNA的預測靶基因進行GO分析,并列出前10位的功能富集類別,詳見表1。可見上調的差異tsRNA所調控的靶基因主要干預類黃酮代謝、細胞葡萄糖醛酸化、葡萄糖醛酸代謝、糖醛酸代謝等生物學過程。而下調的差異tsRNA所調控的靶基因主要影響肝細胞的代謝功能,如細胞對固醇耗竭的反應、巖藻糖基化等。
討 論
tsRNA作為新興的非編碼RNA,其異常表達已在多種疾病中得到證實,并通過調節(jié)生物過程和基因表達發(fā)揮重要作用[8]。本研究通過測序,發(fā)現(xiàn)ERS能夠導致5.2%的肝細胞tsRNA顯著上調,而14.5% tsRNA顯著下調。在高度差異表達(倍數(shù)變化>3)的tsRNA中,上調和下調tsRNA的數(shù)量分別為 2條和11條,提示ERS主要抑制肝細胞tsRNA的表達。業(yè)已證實,tsRNA具有與miRNA相似的功能,可能與特定靶基因的mRNA結合并使其直接降解或抑制其轉錄后翻譯,提示tsRNA可通過類miRNA樣作用調控下游靶基因,進而發(fā)揮生物學功能[9]。

表1 肝細胞ERS相關差異tsRNA靶基因的GO功能分析
筆者聯(lián)合使用基于TargetScan和miRanda的預測工具來預測ERS相關差異tsRNA的靶基因。結果發(fā)現(xiàn),上調tsRNA的靶基因顯著富集于抗壞血酸和藻酸鹽代謝、淀粉和蔗糖代謝、戊糖和葡萄糖醛酸酯相互轉化等碳水化合物代謝途徑。目前研究表明,酒精性脂肪性肝病可導致淀粉和蔗糖代謝、戊糖和葡萄糖醛酸酯相互轉化等糖代謝通路發(fā)生顯著改變[10]。Zhong等[6]研究發(fā)現(xiàn),以Gly-tRF為代表的tsRNA參與了補體C3激活所致的肝脂肪變性。因此,筆者推測肝細胞在ERS條件下可通過上調tsRNA表達,抑制糖代謝相關基因的表達。
此外,下調tsRNA的靶基因顯著富集于Rap1及Ras信號通路,表明ERS誘導的tsRNA下調可能增強Rap1及Ras信號通路活性。Rap1是Ras超家族的一個小G蛋白,參與細胞黏附和運動、細胞增殖、血管生成和細胞骨架重塑等多種生理過程[11]。在Ras信號通路中,Ras參與細胞增殖、分化和細胞周期等細胞過程的調控[12]。兩者可能通過影響細胞骨架,參與上皮間質轉換(epithelial-to-mesenchymal transition,EMT)[13]。EMT則與細胞代謝重編程密切相關,可能導致糖酵解增強,脂肪生成增強和分解下降,從而系統(tǒng)影響肝細胞的代謝表型[14,15]。
在GO功能分析中,筆者發(fā)現(xiàn)上調的tsRNA靶基因主要涉及類黃酮代謝過程、葡萄糖醛酸代謝過程及糖醛酸代謝過程。多種類黃酮均具有對抗細胞氧化應激和調節(jié)脂質代謝的作用。Zheng等[16]研究發(fā)現(xiàn),黃芩苷可通過抑制ERS和TXNIP/NLRP3炎性體的激活,保護AML12細胞免于PA誘導的脂毒性損傷。結合筆者的研究結果,提示tsRNA表達上調可能通過抑制類黃酮代謝功能加劇ERS介導的細胞損傷。另外,糖醛酸途徑的中間產物——尿苷二磷酸葡糖醛酸是重要的解毒物質,并在肝內生物轉化過程參與多種結合反應。上調的tsRNA可能抑制葡萄糖醛酸代謝及糖醛酸代謝等肝臟生物轉化過程,影響肝臟解毒功能,從而導致肝細胞受損。
在下調tsRNA的靶基因功能分析中,筆者發(fā)現(xiàn)靶基因主要涉及巖藻糖基化過程。巖藻糖基化是肝病中最常見的聚糖改變之一,有研究證實IgG的巖藻糖基化水平與NAFLD呈正相關,并且?guī)r藻糖基化與細胞EMT過程密切相關[17,18]。這些研究結果提示,ERS介導的tsRNA下調可能通過促進細胞巖藻糖基化過程參與NAFLD的發(fā)生、發(fā)展。
綜上所述,脂肪酸刺激誘導的ERS可顯著改變肝細胞tsRNA表達譜。差異表達的tsRNA通過調控與碳水化合物代謝、EMT相關的信號通路,可能影響肝細胞的糖代謝、氧化應激和生物轉化等功能。這些發(fā)現(xiàn)提出了一種肝細胞ERS參與NAFLD的新型病理生理機制,有望為NAFLD的診斷和治療提供全新思路。但tsRNA的確切作用仍有待更深入的體內外研究加以闡釋。

