羥基磷灰石的合成及其應用的研究進展
王碩碩, 何 星
(上海理工大學 材料科學與工程學院,上海 200093)
羥基磷灰石(hydroxyapatite,HAP),化學式為Ca10(PO4)6(OH)2,是一種微溶于水的磷酸鈣鹽,屬于六方晶系。正常Ca 和P 原子比為1. 67,其晶胞參數為: a=b≠c,α=β=90°,γ=120°[1]。HAP 的結構可以描述為磷氧四面體基團的緊密結合體,圖1 為HAP 的晶體結構圖[2]。從圖1 中可以看到,P5+位于四面體的中心,并且其頂部被4 個O 原子占據。Ca2+則被磷氧四面體所包圍,在晶胞中占有2 個獨立的位置 Ca(I)和 Ca(II),從而形成 2 種直徑不同、互不相連的通道。第1 種通道的直徑為 0.25 nm,由4 個Ca2+構成,每個Ca2+與四面體中頂角上的9 個O 原子相連,其配位數為9。第2 種通道對HAP 的性質影響較大,它的直徑(0.30~0.45 nm)比第一種通道的要大,由剩下的6 個Ca2+構成,每個Ca2+的配位數是 7。由于HAP 結構中存在2 個不同的鈣位點,所以可以通過對鈣位點的特定修飾來調節HAP 的特性。
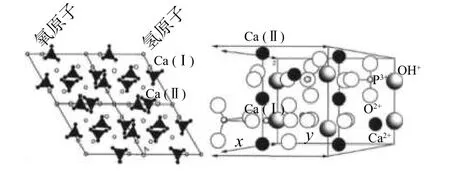
圖 1 羥基磷灰石的晶體結構[2]Fig. 1 Crystal structure of HAP[2]
圖2 為HAP 典型的X 射線衍射(X-ray diffraction, XRD)譜圖,譜圖中無雜峰出現,通過對各衍射峰檢索確定該產物為六方晶系HAP,與JC-PDS 卡片 (No:09-0432) 進行對照,峰形和出峰位置均十分吻合,為典型的HAP 的 XRD 譜[3]。另外,由于HAP 表面還具有豐富的弱堿性位(PO43?中的O2?和OH?)和弱酸性位(如:不飽和配位 Ca2+),因此可以通過向結構中引入H+和減少OH?來中和由于Ca2+的損失而引起的電荷不平衡。此外,OH?位點周圍的環境易于控制酸堿位點之間的比例,因此也非常利于取代。當Ca 和P 的原子比為1.50 時,HAP充當具有堿性位點的酸催化劑。當Ca 和P 原子比為1.67 時,HAP 充當堿性催化劑[4]。又由于HAP 具有強的離子交換性,其晶格結構中的Ca2+可以被其它陽離子取代。采用與Ca2+半徑(0.099 nm)相近的金屬離子取代HAP 中的Ca2+,來調節HAP 的酸堿位點和酸堿強度,從而能夠提高HAP 表面吸附位點的強度[5]。
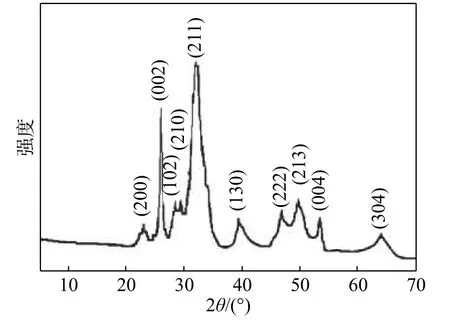
圖 2 HAP 納米球的XRD 譜圖[3]Fig. 2 XRD pattern of HAP nanospheres[3]
如上所述,HAP 具有獨特的化學組成和晶體結構,因此在生物醫用、環境功能材料以及化學催化領域具有非常重要的應用[6-7]。
1 主要制備方法
HAP 的性能很大程度上依賴于其顯微組織、成分和制備加工工藝等因素。在材料界,每種材料均有各自對應的生產工藝和合成方法。總的來說,材料合成方法主要包括氣相法、液相法和固相法3 類[8-9]。在HAP 的制備過程中,原材料是確定的,因此制備工藝過程與方法就顯得尤為重要。常見的制備方法主要有2 種,包括固相法和液相法。
1.1 固相法
固相法是以固態物質為原料,通過固相反應和燒結等過程來制備材料的方法[10]。合成羥基磷灰石的固相法主要有固相反應法和機械化學球磨法。
1.1.1 固相反應法
固相反應法是2 種或2 種以上的固體通過發生化學反應生成新固體產物的方法[11]。在用固相反應法合成HAP 時,目前常用的工藝是CaCO3或Ca3(PO4)2和Ca4P2O9在1 200 ℃高溫下通入水蒸氣,通過固相反應合成HAP[12]。Nims[13]、Rao 等[14]、Pramanik 等[15]采用固相反應法制備了HAP 粉末,且完成了生物學實驗并取得成功。
固相反應法的優點是通過該方法得到的HAP沒有晶格缺陷、結晶度高,并且這種方法成本低、制備工藝簡單,但其也有缺點,如所得粉體的顆粒大、耗能大、產物不純等[16]。
1.1.2 機械化學球磨法
機械化學球磨法是將含有鈣和磷的前驅物放在球磨機中混合研磨,使其發生化學反應生成HAP。Nakamura 等[17]以 H3PO4和 Ca(OH)2為前驅物,聚羧酸銨為分散劑制備了納米羥基磷灰石(nano hydroxyapatite, n-HAP),其粉體粒徑小于20 nm,并探討了分散劑的濃度對n-HAP 的Ca 和P 原子比以及pH 的影響。Mochales 等[18]采用機械化學球磨法制備了Ca 和P 原子比為1.5 的低鈣羥基磷灰石(calcium deficient hydroxyapatites, CDHAP)。在反應中,由于在球磨機中粉末會經歷劇烈的機械變形和局部的溫度升高,而這種變形和溫度升高會導致晶體缺陷的產生,并且加上粉末顆粒之間的聚結,可能會觸發CDHAP 的結構變化[19]。在對不同研磨時間下CDHAP 的XRD 譜圖進行分析時發現,隨著研磨時間的增加,HAP 的結晶度增加。當研磨時間超過20 h 達到24 h 時,譜圖中出現了β-TCP 相。β-TCP相的形成可能是已經結晶的磷灰石晶體被繼續研磨的結果,因為該相僅在高溫下獲得。

圖 3 HAP 樣品的TEM 圖[20]Fig. 3 TEM images of HAP samples[20]
1.2 液相法
液相法是將可溶性金屬鹽類和沉淀劑,通過蒸發、升華等操作使金屬離子沉淀或結晶,最后通過脫水或者加熱分解而得到所需粉體的方法。液相法主要包括4 種,有水熱合成法、化學沉淀法、溶膠-凝膠法和微乳液法。
1.2.1 水熱合成法
水熱合成法是指在高溫、高壓下,在水溶液或者水蒸汽中合成HAP 的方法。通常是以CaCO3和CaHPO4·2H2O 為原料,在高壓釜中經過水熱反應,制備出晶粒完整的HAP 固體。Zhang 等[20]采用傳統的水熱法,水熱溫度和時間設置為100 ℃/10 h,通過在體系中加入丙氨酸和谷氨酸來調節HAP 的顆粒大小,成功制備出尺寸均勻的HAP 納米棒(長約80 nm,寬約15 nm)。圖3 為樣品的透射電子顯微鏡(transmission electron microscope, TEM)圖。比較圖3中(a)、(b)和(c)可知,與未經氨基酸調節的HAP 樣品相比,經丙氨酸和谷氨酸調節后的HAP 表現出相似的棒狀結構。與谷氨酸調節的HAP 相比,丙氨酸調節的HAP 顆粒分散均勻,結晶度更高。實驗結果表明,在HAP 結晶過程中,氨基酸的加入可誘導HAP 納米粒子的合成并控制HAP 晶體的生長。且結晶度受氨基酸極性的影響,丙氨酸作為非極性氨基酸,對HAP 結晶度有較好的影響。韓紀梅等[21]用水熱法處理Na3PO4和Ca(NO3)2,制得針狀HAP晶體,并用TEM、XRD、傅里葉紅外光譜儀(fourier transform infrared spectroscopy, FTIR)和X 射線光電子能譜儀(X-ray photoelectron spectroscopy, XPS)等對樣品進行了分析表征。分析結果表明:用水熱合成法制備的n-HAP 與牙無機質成分和晶體結構非常相似;在制備n-HAP 的過程中,如果適當引入和F?,可以更好地模仿自然牙的組成,從而制備出高性能的n-HAP 與牙科樹脂復合材料。
1.2.2 化學沉淀法
化學沉淀法是一種常見的HAP 制備方法,制備成本低廉,反應過程容易控制[22]。常用的鈣鹽有 Ca(NO3)2·4H2O、 Ca(OH)2、 CaHPO4·2H2O、CaO、CaCl2和Ca(OC2H5)2等,常用的磷酸鹽有(NH4)2HPO4、 H3PO4、 NaH2PO4和 (CH3O)3PO 等。Kong 等[23]以Ca(NO3)2·4H2O 和H3PO4為 原 料,采用沉淀法制備了平均晶粒尺寸約為60 nm的HAP 粉末。該粉末純度很高,將HAP 粉末在600 ℃下加熱4 h,亦未觀察到晶粒粗化。Fulmer等[24]通過對事先合成的CaHPO4·2H2O 水解制備HAP,并研究了在Na2HPO4和水2 種溶劑中影響CaHPO4·2H2O 水解的因素。研究發現:在室溫下(25 ℃) CaHPO4·2H2O 在水中水解不充分,隨著溫度逐漸升高至60 ℃,水解程度越來越高;而在1 M 的Na2HPO4溶劑中,CaHPO4·2H2O 可以完全水解生成HAP,基本不受溫度的影響;在Na2HPO4溶液中水解形成的HAP 形貌也與在水中水解形成的HAP 不同,在水中水解形成的HAP 呈針狀至球狀,而在Na2HPO4溶液中形成的HAP 則呈現出小花狀的形貌。
1.2.3 溶膠-凝膠法
溶膠-凝膠法是將金屬的醇鹽或無機鹽混合后在水溶液中醇解或水解生成溶膠,然后經過脫水處理為凝膠,再經過干燥燒結得到所需粉體的方法。Bigi 等[25]以Ca(NO3)2·4H2O 和(NH4)2HPO4為 反應物,采用溶膠-凝膠法制備出HAP 粉體,并研究了Ca 和P 原子比對HAP 結構和形態的影響。實驗中制備了3 種不同Ca 和P 原子比的HAP 樣品,其中,Ca 和P 原子比分別為1.00,1.67 和2.55。實驗結果表明,HAP 的結晶度隨著Ca 和P 原子比的增加而增加,且樣品的微觀形貌也受Ca 和P 原子比影響較大。當Ca 和P 原子比為1.00 時,HAP 粉末由非常小的薄晶體組成,其長約20~40 nm,寬不到10 nm;當Ca 和P 原子比為1.67 時,其微觀形貌變成了圓形的小顆粒;當Ca 和P 原子比為2.55 時,粉末的形貌變成了更大的顆粒。徐曉虹等[26]采用溶膠-凝膠法合成了分散性較好的HAP,并對樣品進行了XRD 和TEM 表征。通過對TEM 圖分析發現,樣品顆粒分散均勻。對樣品進行了粒度分析,結果如圖4 所示。由圖4 可見,納米HAP 顆粒直徑在25~70 nm 之間,呈正態分布,顆粒直徑主要集中在40~50 nm,表明制備的納米HAP 粉體具有較好的分散性。
1.2.4 微乳液法
微乳液法是將油和水2 種溶劑在表面活性劑的作用下形成一個液滴直徑為微納米級的透明均勻乳液,并在乳液中經成核、聚結、團聚、熱處理后制備出n-HAP 的方法[27]。譚凱元等[28]利用微乳液法制備出多種微觀形貌的n-HAP。研究發現:表面活性劑十二烷基三甲基氯化銨(dodecyl trimethyl ammonium chloride,DTAC)的濃度會影響n-HAP 的微觀形貌,n-HAP 的粒徑會隨著DTAC 的增加而相應減小,且DTAC 能夠誘導n-HAP 成核結晶,在其結晶過程具有重要的作用。
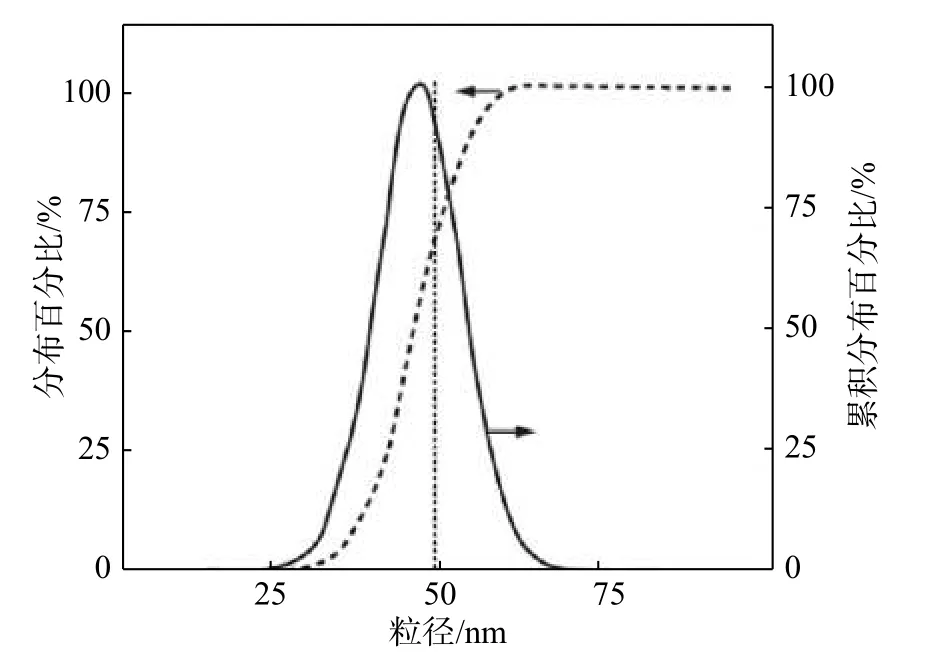
圖 4 納米n-HAP 樣品的粒度分布[26]Fig. 4 Particle size distribution of n-HAP sample[26]
2 主要應用
由于HAP 與人體骨骼和牙齒的化學成分和微晶結構非常相似,在修復硬組織時,可促進成骨細胞的生長,因此在生物醫學中有著廣泛的應用[29]。且HAP 能夠吸附多種重金屬離子,因此可作為一種良好的環境功能材料。此外,HAP 本身還可以作為催化劑被廣泛地應用于化學催化和工業催化領域。
2.1 生物醫用材料
2.1.1 HAP 義眼座
將HAP 應用于眼部整形手術中,可促進眼眶纖維血管長入,使其血管化。因為HAP 和機體組織具有一定相溶性,沒有纖維組織產生包裹與分隔,HAP 在眼部整形手術中的應用效果顯著,使HAP成為當前眼部整形手術的首選眶內植入材料[30-31]。
2.1.2 在口腔醫學中的應用
慢性牙周炎在臨床中又被稱為成人牙周炎。該病嚴重影響患者口腔健康。戴曉瑋等[32]對38 例慢性牙周炎患者進行分組研究,發現該病治療周期長、反復發作等特點對患者正常生活、工作影響較大。而HAP 由于具有良好的生物相容性以及骨誘導性,因此在口腔輔助治療工作中具有不可替代的重要作用。Min 等[33]嘗試將n-HAP 作為添加劑添加到運動飲料中,以此來抑制因大量攝入運動飲料而引起的牙齒腐蝕現象。在實驗中設置了3 組添加質量分數分別為0.05%,0.10%和0.25% n-HAP 的運動飲料。實驗結果表明,隨著n-HAP 濃度的增加,牙齒腐蝕的可能性得到了有效降低,含有0.25%n-HAP 的運動飲料可以預防牙齒腐蝕。
2.1.3 HAP 涂層
與生物惰性金屬材料相比,涂覆有HAP 的金屬材料在植入后可在短期內與人體的軟硬組織形成生物結合。尹燕等[34-35]在鎳鈦形狀記憶合金表面制備HAP 生物陶瓷涂層,并通過實驗研究了該復合材料的生物活性。研究結果表明,HAP 涂層能有效刺激軟骨細胞的形成,提高了鎳鈦形狀記憶合金的生物活性。此外,張學賢等[36]預先使用含氟電解液對Ti-6Al-4V 基體進行陽極氧化處理,然后通過水熱電化學法在其表面制備HAP 涂層。研究了陽極氧化電壓對HA 涂層物相、形貌以及涂層和基體結合強度的影響。結果表明:水熱電化學沉積得到的HA 涂層呈現出分層生長,陽極氧化預處理的基體和涂層間的結合強度明顯提高,并在陽極氧化電壓為25 V 時達最大,為20.0 MPa。
2.1.4 HAP 做藥物載體
在生物醫學領域,納米粒子可用作靶向組織或細胞的藥物載體。Zhang 等[37]采用水熱合成法合成介孔鍶羥基磷灰石(SrHAP)納米棒,并考察了它對布洛芬(Ibuprofen,IBU)的載藥性能。其載藥流程如下:在室溫下將0.2 g SrHAP 樣品添加到IBU 濃度為60 mg/mL 的30 mL 己烷溶液中,并在密封的小瓶中攪拌浸泡24 h,以防止己烷蒸發。然后將負載IBU 的SrHAP 樣品通過離心分離,然后在60 ℃的真空中干燥24 h。接著在37 ℃下,將0.2 g IBU 樣品在緩慢攪拌下浸入模擬體液(simulated body fluid,SBF)的釋放介質中進行體外遞送。研究結果顯示:SrHAP 對IBU 的載藥率可達32.9%左右,且負載IBU 的SrHAP 納米棒遞送系統3 h 后的藥物釋放量可達50.5%,12 h 后可達93.9%;最初3 h IBU的釋放較快,可能是由IBU 的分子弱吸附在介孔SrHAP 納米棒的外表面上引起的;剩下的IBU 釋放較緩慢,可能是由于IBU 分子與SrHAP 表面之間的強相互作用。該項研究結果表明,通過水熱法合成的SrHAP 對IBU 有很好的載藥和緩釋作用,可以作為潛在的納米載藥體系應用于疾病治療。
此外,在作為骨科常見疾病治療用的藥物載體時,HAP 具有以下優勢[38-39]:(1)生物性能對周圍組織友好,無毒副作用;(2)獨特的多孔結構以及較大的比表面積,這些優越的物理性能能夠協助其黏附和傳遞多肽和疫苗等生物大分子;(3)物理性質穩定,能夠作為穩定載體使用;(4)HAP 本身有抗腫瘤作用,在腫瘤治療方面有廣闊的應用前景。
2.2 環境功能材料
吸附是一種固體或液體表面對氣體或溶質的吸著現象。HAP 由于具有獨特的結構和性能,因此可作為吸附劑吸附工業廢水中的重金屬離子[40]。Jiménez 等[41]研究了HAP 在水溶液中吸附F?的行為,并研究了吸附溶液pH,吸附劑接觸時間,F?濃度和吸附劑量對HAP 吸附行為的影響。研究結果表明,HAP 對F?的吸附在16 h 后達到平衡,并且對F?的最佳吸附環境的pH 范圍為5.0~7.3。實驗運用擬二級模型描述了動力學吸附過程,運用Freundlich 模型描述了吸附等溫過程。這些結果表明該吸附行為是發生在異質材料上的化學吸附,使用堿性溶液可使F?部分解吸。金科[42]首次用HAP 吸附蠔油中的Pb2+,然后進行過濾和吸附實驗。實驗結果表明吸附率達到了98%以上,且蠔油中主要理化指標的含量并未發生太大變化,這表明HAP 在做吸附劑時,并不影響蠔油的品質,且無毒副作用。以上結果表明HAP 可作為環境友好型功能材料被廣泛使用。
2.3 催化劑及催化劑載體
HAP 由于其自身特殊的性質,如表面酸堿可調性以及強離子交換性等,可作為催化劑或催化劑載體,具體應用于氧化反應、還原反應等。
Sugiyama 等[43-44]研究了HAP 作為催化劑在催化甲烷氧化反應時的性能表現,研究發現HAP能有效地作為催化劑催化該反應。其反應機制是CCl4的氯與HAP 反應抑制了CO 被進一步氧化成CO2。
唐海蓮等[45]通過在TiO2和HAP 之間的界面區域中定位Au 納米顆粒,合成了超穩定的負載Au 納米顆粒的HAP 基催化劑。這種獨特的配置使得Au 納米顆粒由于金屬—載體間的強相互作用而部分包封,并且暴露的部分為表面提供了活性位點。這種催化劑不僅表現出優異的性能,在模擬測試中也表現出優異的耐用性,表明負載了Au 納米顆粒的HAP 基催化劑具有巨大的實際應用潛力。
Zouhair 等[46]通過在HAP 上負載不同含量的Pd 合成了Pd/HAP 催化劑,研究了該催化劑對CO的氧化作用。實驗結果表明,與Pd 負載量為1%和2%的Pd/HAP 催化劑相比,Pd 負載量為0.5%的催化劑在CO 反應過程中表現出更高的還原性和氧遷移率,催化CO 氧化反應效果明顯,這是由于Pd 負載量為0.5%的Pd/HAP 催化劑其表面的Pd 顆粒粒徑較小,因而表現出更強的CO 吸附效果,此外,Pd/HAP 催化劑的性能也證明了HAP 作為催化劑載體,具有廣大的應用前景。
3 結 論
HAP 的制備與應用對我國生物醫學,重金屬離子吸附和化學催化等相關領域意義重大,也是我國發展工業催化重要的組成部分。本文從HAP 的晶體結構和實驗室常見制備工藝對HAP 進行綜述,結合HAP 的主要性質,介紹HAP 在生物醫學領域,環境功能以及催化領域的具體應用。作為應用較為廣泛的生物醫用材料之一,通過改進HAP 合成技術及制備方法從而改善其力學性能,有待進一步探索。HAP作催化劑載體與貴金屬結合形成具有強相互作用的HAP 基催化劑,目前也得到了廣泛的研究,結合HAP 基催化劑對CO 氧化反應的綜合分析,逐步降低貴金屬的負載量,從而降低未來實際應用中的成本。HAP 在應用中已表現出優異的性能,其卓越的生物相容性、良好的骨傳導作用及優異的離子交換能力,必將隨著時代的進步在生物醫學,環境功能以及化學和工業催化領域發揮更大的作用。

