生殖道支原體基因芯片在宮頸炎患者支原體感染診斷中的價值*
張 薇,智深深,榮長仙,李麗娟△
重慶市急救醫療中心:1.檢驗科;2.婦產科,重慶 400014
宮頸炎是國內外常見的婦科疾病,發病率持續上升,發病年齡亦呈年輕化趨勢,嚴重影響女性的生活質量[1-2]。支原體感染是引發宮頸炎的主要原因之一,有研究報道,與宮頸炎相關的支原體陽性率為50%以上,其主要類型是解脲脲原體(Uu)、微小脲原體(Up)、生殖支原體(Mg)和人型支原體(Mh)[3]。女性生殖道感染支原體后,多數情況下只是作為攜帶者,當宿主抵抗力下降或黏膜受損時,支原體可侵入宮頸黏膜細胞引起宮頸炎,繼續向上蔓延引起子宮內膜炎、卵巢炎、不孕,甚至導致流產、早產等[4]。
Uu和Mh的檢測在國內外臨床實驗室開展較早,培養法是主要檢測方法,原理是Uu分解尿素、Mh分解精氨酸后,生成的堿性物質引起pH值上升,使液體培養基由黃色變成紅色。該方法具有操作簡單、易推廣等優點,但耗時較長,不能區分支原體類型,可受雜菌干擾造成假陽性,也是導致國內抗菌藥物濫用和支原體耐藥率上升的原因之一[5]。為此,本課題組前期成功研發了基于環介導恒溫擴增和微流控技術的生殖道支原體基因芯片,經性能驗證后,采用該基因芯片檢測本院宮頸炎患者,判斷生殖道支原體感染類型,以期為臨床快速診斷和合理用藥提供參考價值。
1 資料與方法
1.1一般資料 選取2019年3-8月本院初診的156例宮頸炎患者為研究對象,宮頸炎診斷標準參照《2015美國疾病控制和預防中心關于宮頸炎癥的診治規范》。納入標準:宮頸管流出膿性分泌物;進行拭子操作后宮頸出血;陰道分泌物鏡檢每高倍視野下白細胞計數>10個。排除標準:月經期;24 h內有性生活;3 d內使用陰道藥物或進行陰道沖洗;1周內服用抗菌藥物。
1.2儀器與試劑 生殖道支原體微流控芯片由本課題組研發;RTisochipTM-A恒溫擴增微流控芯片核酸分析儀由博奧生物有限公司提供;恒溫擴增試劑購自上海榮研生物有限公司;DNA提取試劑盒購自Tiangen公司;PCR試劑盒購自北京康為世紀有限公司;Uu和Mh分離鑒定試劑盒購自珠海麗珠有限公司。
1.3方法
1.3.1標本采集 患者取膀胱截石位,會陰處常規消毒,陰道窺器暴露宮頸。無菌拭子插入宮頸管內,輕輕旋轉3~5圈,取出拭子后立即放入無菌管,盡快送檢。
1.3.2芯片法 將拭子放入0.9%氯化鈉溶液中,擠壓、旋轉拭子數次,充分混勻后提取標本核酸。配制恒溫擴增試劑,取9.0 μL恒溫擴增試劑和9.0 μL標本的核酸提取液,混勻后離心。芯片加樣后于RTisochipTM-A恒溫擴增微流控芯片核酸分析儀上進行核酸擴增,50 min后判讀結果。
1.3.3培養法 將基礎液及試驗板于室溫復溫后,吸取50.0 μL基礎液加入試驗板上的空白對照孔。將含分泌物的拭子插入剩余的基礎液中,擠壓、旋轉拭子數次,充分混勻。取混勻后的基礎液加入試驗板余下各孔,每孔50.0 μL,輕輕震蕩至包被上的物質溶解。所有孔滴加1滴無菌液狀石蠟,加蓋后置于37 ℃孵箱培養,Uu和Mh分別于24和48 h后觀察結果。
1.3.4測序法 按照PCR試劑盒操作流程進行操作。引物分別如下,Uu上游引物:5′-GCA ATC TGC TCG TGA AGT AC-3′;Uu下游引物:5′-CTA AGC CAT TTA CAC CTC AA-3′;Up上游引物:5′-GCA ATC TGC TCG TGA AGT AC-3′;Up下游引物:5′-CTA AGC CAT TTA CAC CTC AA-3′;Mg上游引物:5′-CCA TGT GCG CCC TGA TGG GG-3′;Mg下游引物:5′-TCA CGC TAC TAC GTT GCT TAT TTT GGT-3′;Mh上游引物:5′-ACC CTG AAT TTG AAA TCG TTG C-3′;Mh下游引物:5′-CAA ATA TTG AGC CTG CTT TTG CAC CA-3′。PCR反應程序:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,72 ℃ 5 min,產物于測序儀上測序。
1.3.5患者信息收集 收集并分析患者的臨床信息包括年齡、孕次、產次、是否絕經等。
1.4統計學處理 采用SPSS22.0統計軟件進行分析,計數資料以例數或百分率表示,組間比較采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1生殖道支原體芯片法檢測結果 156例標本中,陽性78例(部分標本同時存在兩種或兩種以上支原體感染,陽性率為50.0%),其中Uu 18例(陽性率為11.5%),Up 57例(陽性率為36.5%),Mg 4例(陽性率為2.6%),Mh 14例(陽性率為9.0%)。
2.23種方法檢測的陽性符合率比較 芯片法與測序法比較,Uu、Mg和Mh的陽性符合率均為100.0%,Up的陽性符合率為96.6%。芯片法與培養法比較,Mh的陽性符合率為93.3%;培養法中Uu陽性數為82例,而芯片法中Uu陽性數為18例,Up陽性數為57例,推測培養法檢測的是總的脲原體。見表1~2。

表1 支原體芯片法與測序法的陽性符合率比較

表2 支原體芯片法與培養法的陽性符合率比較
2.3宮頸炎患者發生支原體感染的影響因素 宮頸炎患者發生支原體感染與年齡、孕次、產次、是否絕經無關(P>0.05)。見表3。
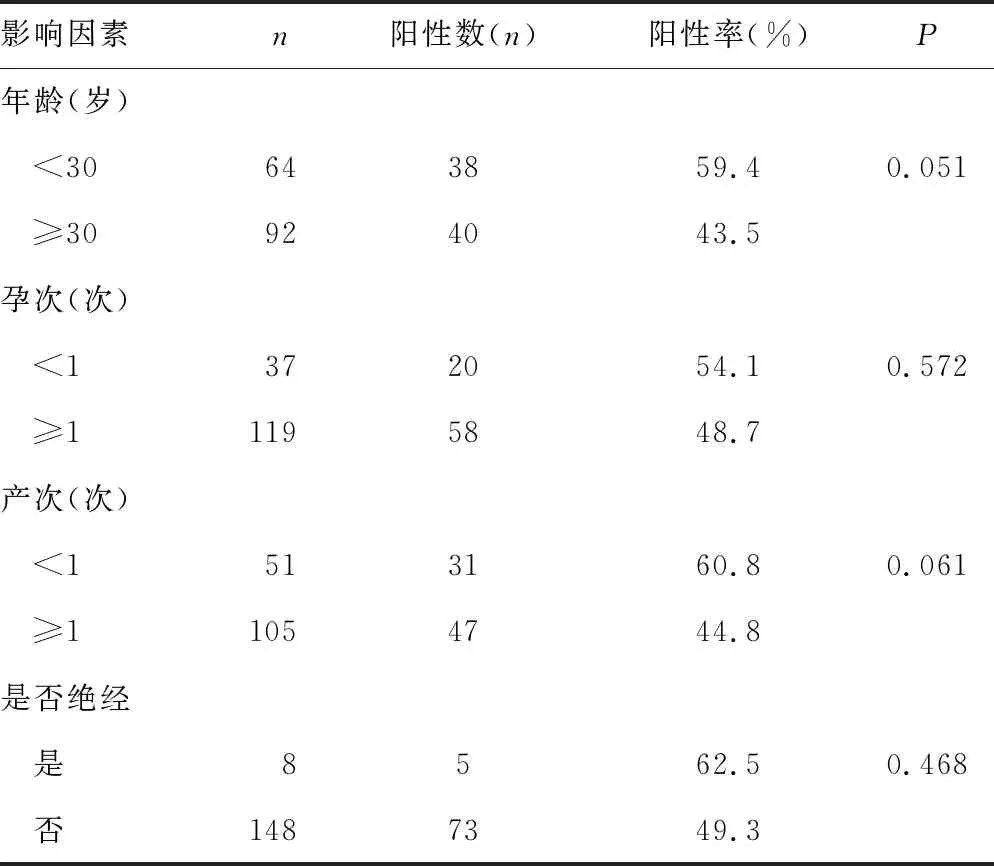
表3 宮頸炎患者支原體感染的影響因素分析
3 討 論
目前大部分實驗室對生殖道支原體感染的鑒定多依賴于培養法或PCR單項驗證,尚未對支原體分型進行同步、高效的鑒定評價[6],因此本研究在這方面有一定的創新性。本課題組前期成功研發了基于環介導恒溫擴增和微流控技術的生殖道支原體基因芯片,以不同分型支原體的特征片段制備引物探針,將標本DNA擴增并熒光標記,通過雜交后檢測的熒光強度來判斷支原體的類型,其特點是標本需要量少、準確性高,整個檢測過程在1 h內完成[7],在婦產科學、生殖醫學、泌尿學等學科具有可觀的臨床應用前景,充分體現了基因芯片技術在生殖道感染診治中的優越性。
本研究顯示,宮頸炎患者生殖道支原體的陽性率為50.0%,其中Uu陽性率為11.5%,Up為36.5%,Mg為2.6%,Mh為9.0%。意大利的一項多中心研究利用實時PCR技術檢測這4種支原體,有癥狀感染者中Uu陽性率為9.0%,Up為38.3%,Mg為0.6%,Mh為8.6%[8],與本研究結果基本一致。然而,也有研究報道脲原體(包括Uu和Up)在宮頸處可能僅是定植,并不是宮頸炎的致病因素[9],經基因分型后,Uu和Up在不同人群中的分布亦有差異,普通人群以Up定植為主,而高危人群以Uu定植為主[10]。
目前支原體的培養法只針對Uu和Mh。Up是從Uu中分離出的一個新種,亦能分解尿素,因此推測培養法很難將Uu和Up區分開[11],芯片法則提供了一個高準確度的脲原體分型。本研究顯示,培養法中Uu陽性數為82例,而芯片法中Uu陽性數為18例,Up陽性數為57例,因此推測培養法檢測的是總的脲原體,并且少數雜菌也可導致假陽性結果。李平衛等[12]報道了Up的感染率遠高于Uu,生殖道感染性疾病與Up具有明顯相關性,Uu大多存在于無癥狀攜帶者。因此,對生殖道支原體進行分型具有重要意義。芯片法與測序法比較,Uu、Mg和Mh的陽性符合率均為100.0%,Up的陽性符合率為96.6%,符合率較高。芯片法中有2例未檢出Up陽性,推測是由于測序法的靈敏度高于芯片法,導致該2例標本測序法結果為陽性但芯片法為陰性。鑒于培養法可獲得藥敏試驗結果,因此在診斷泌尿生殖道支原體感染時建議聯合使用培養法和芯片法。
此外,有研究報道年齡、性生活、流產、分娩史等是女性患宮頸炎的危險因素[13-14],但本研究中宮頸炎患者發生支原體感染與年齡、孕次、產次、是否絕經無關,可能是樣本量較少的緣故。宮頸支原體感染需引起女性重視,臨床醫生也要充分評估其配偶感染的危險因素,以提高支原體感染的診治水平[15]。
關于生殖道支原體感染的臨界值暫未設定,無法區分是定植還是感染,目前只能結合臨床癥狀和藥敏試驗結果給予針對性的治療。基因芯片技術提高了檢測方法之間的符合率,適宜臨床應用推廣。后續,本課題組將繼續收集標本,進行生殖道支原體定植和感染的研究。
綜上所述,生殖道支原體基因芯片可準確、快速地檢測支原體及進行分型,具有可觀的臨床應用價值。

