豬附紅細(xì)胞體eno基因PCR診斷方法的建立
閆宗斌, 薛書江, 宋建臣, 許應(yīng)天
(延邊大學(xué)農(nóng)學(xué)院,吉林 延吉 133002)
豬附紅細(xì)胞體(Mycoplasmasuis),主要附著在豬的紅細(xì)胞表面、血漿及骨髓,引起豬的黃疸性貧血、急性或慢性傳染性貧血[1-3]。患病豬臨床特征表現(xiàn)為發(fā)熱、貧血、黃疸等癥狀,嚴(yán)重時(shí)可導(dǎo)致豬的死亡[4]。而且,該病常與其他的疾病混合感染,增加了該病的診斷難度[5-7],當(dāng)前在全球范圍內(nèi)均流行過該病,給養(yǎng)殖業(yè)帶來了一定的經(jīng)濟(jì)損失。
目前,豬附紅細(xì)胞體病診斷的方法主要有血液壓片鏡檢、血液涂片染色鏡檢、ELISA等血清學(xué)方法、PCR法、熒光定量PCR法和PCR-ELISA法[7-8],這些方法的檢測(cè)時(shí)間、敏感性與特異性等方面都各有一定的局限性。目前,PCR技術(shù)診斷方法相對(duì)于其他方法更為快捷,且準(zhǔn)確性高,是最具有一定優(yōu)勢(shì)的診斷方法。為尋求最佳的豬附紅細(xì)胞體診斷方法,該試驗(yàn)進(jìn)行了豬附紅細(xì)胞體eno基因的PCR診斷方法的研究。
1 材料與方法
1.1 材料
1) 血樣來源 采自延邊某豬場(chǎng)附紅細(xì)胞體病典型臨床癥狀的可疑病例的抗凝血40份。
2) 對(duì)照樣品DNA 豬肺炎支原體DNA、多殺性巴氏桿菌DNA、弓形蟲DNA、豬鏈球菌DNA和豬繁殖與呼吸綜合征病毒cDNA樣本均由延邊大學(xué)預(yù)防獸醫(yī)學(xué)實(shí)驗(yàn)室保存。
3) 主要試劑 DNA血液提取試劑盒,DNA凝膠回收試劑盒,質(zhì)粒小量提取試劑盒均購自O(shè)mega生物工程公司,100 bp DNA Ladder、ExTaq、DL2 000 Marker、DL5 000 Marker、pMD19-T Simple Vector、pfu DNA聚合酶均購自寶生物(大連)生物工程公司。
1.2 方法
1.2.1 引物的設(shè)計(jì)與合成
根據(jù)GenBank上發(fā)表的豬附紅細(xì)胞體基因序列(AB265823.1),設(shè)計(jì)1對(duì)特異引物(P1:5’-AGGTAACCCAACCGTAGCAT-3’,P2:5’-TCTTAACTCCCTTTCCTCCAA-3’),由生工生物工程(上海)股份有限公司合成。
1.2.2 PCR擴(kuò)增與退火溫度的篩選
用DNA血液提取試劑盒提取豬附紅細(xì)胞體基因組,以提取的豬附紅細(xì)胞體基因組DNA為模板,以P1、P2為引物,進(jìn)行擴(kuò)增反應(yīng),預(yù)期擴(kuò)增為170 bp,PCR反應(yīng)各成分及劑量如下:引物各1 μL,10×Buffer 2.5 μL,DNTP 1 μL,EX Taq 0.3 μL,滅菌去離子水17.2 μL。擴(kuò)增豬附紅細(xì)胞體的PCR反應(yīng)程序?yàn)椋?4 ℃預(yù)變性5 min,94 ℃變性45 s,退火45 s,72 ℃延伸85 s,共35個(gè)循環(huán);72 ℃延伸7 min,4 ℃結(jié)束反應(yīng)。設(shè)置退火溫度為52、53、54、55、56、57、58、59 ℃共8個(gè)梯度。用1%瓊脂糖凝膠電泳檢測(cè)結(jié)果,選擇特異性強(qiáng)的梯度溫度作為退火溫度。產(chǎn)物經(jīng)凝膠電泳后,用DNA凝膠回收試劑盒進(jìn)行擴(kuò)增產(chǎn)物的回收并純化。
1.2.3 pMD-19T重組質(zhì)粒的構(gòu)建轉(zhuǎn)化與鑒定
將回收產(chǎn)物與pMD19-T simple載體4 ℃連接過夜,連接產(chǎn)物轉(zhuǎn)化大腸桿菌DH5α感受態(tài)細(xì)胞,在含有Amp的固體LB平板挑選陽性克隆,搖菌過后,按照質(zhì)粒提取試劑盒的方法進(jìn)行質(zhì)粒提取。提取質(zhì)粒后,進(jìn)行PCR鑒定,將經(jīng)瓊脂糖凝膠電泳鑒定結(jié)果陽性的重組質(zhì)粒菌液送至生工生物工程(上海)股份有限公司進(jìn)行測(cè)序,所得測(cè)序結(jié)果用DNAMAN軟件進(jìn)行多序列比較。
1.2.4 特異性試驗(yàn)
以豬肺炎支原體DNA、多殺性巴氏桿菌DNA、弓形蟲DNA、豬鏈球菌DNA和豬繁殖與呼吸綜合征病毒的基因組cDNA為模板,以特異性引物P1、P2進(jìn)行體系為25 μL的 PCR擴(kuò)增反應(yīng)。
1.2.5 敏感性試驗(yàn)
通過紫外分光光度計(jì)測(cè)定陽性質(zhì)粒濃度,然后將其進(jìn)行濃度梯度稀釋,以稀釋后的各濃度梯度的質(zhì)粒為模板進(jìn)行體系為25 μL PCR擴(kuò)增反應(yīng),測(cè)定該方法的敏感程度。
1.2.6 臨床應(yīng)用試驗(yàn)
對(duì)所采集的40份豬抗凝血應(yīng)用本試驗(yàn)所建立的PCR方法和相思宇[9]所建立的PCR-ELISA 方法進(jìn)行檢測(cè),以比較二者的敏感性和符合率。
2 結(jié)果與分析
2.1 PCR擴(kuò)增結(jié)果
以P5、P6為引物,豬附紅細(xì)胞體陽性血液的DNA為模板,進(jìn)行PCR擴(kuò)增,得到大小為170 bp的DNA片段,與預(yù)期的目的片段大小一致(圖1)
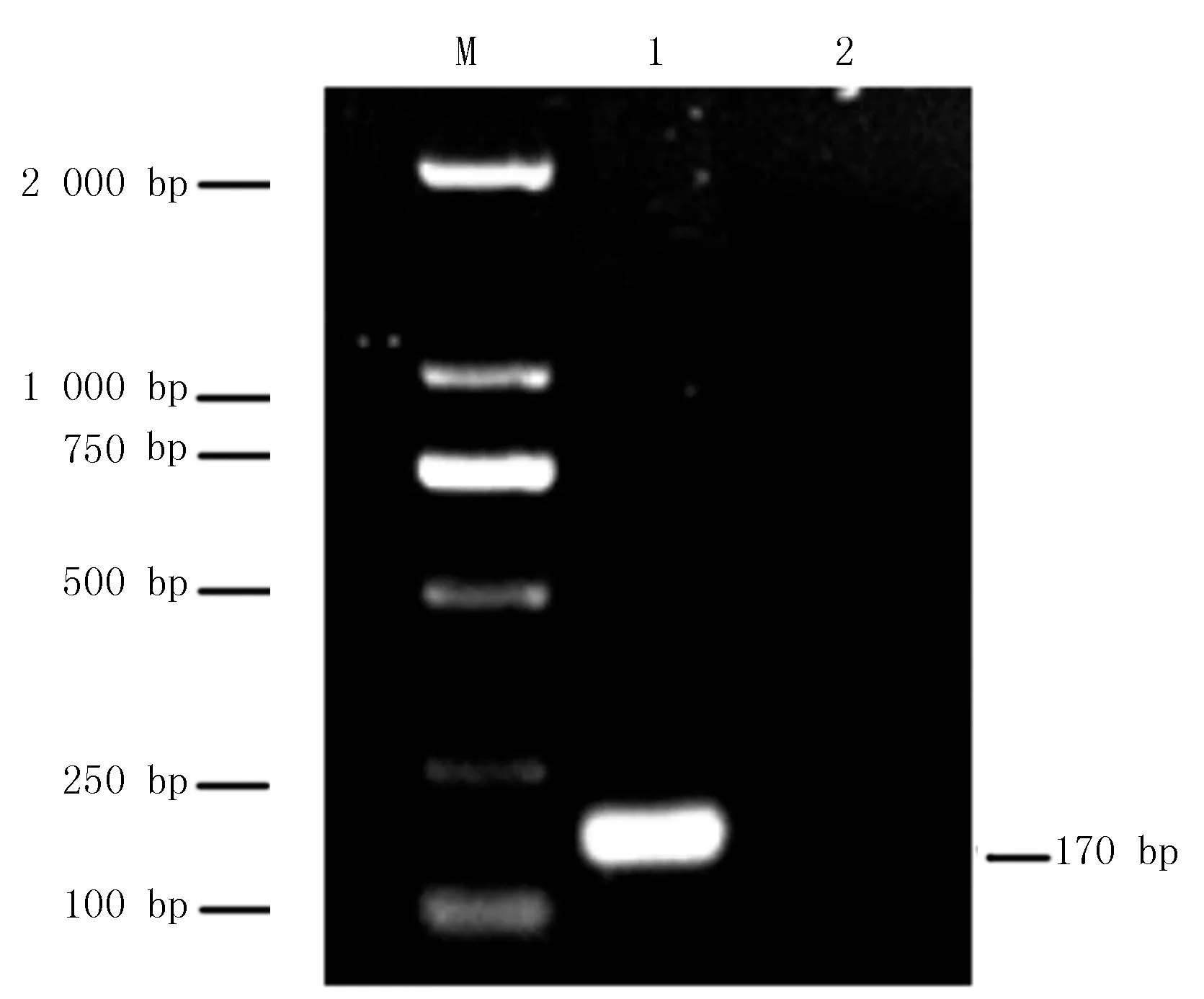
M:DL 5 000 Maker;1:PCR產(chǎn)物;2:陰性對(duì)照?qǐng)D1 PCR擴(kuò)增結(jié)果Fig.1 The result of PCR reaction
2.2 退火溫度的篩選
取濃度相同的豬附紅細(xì)胞體陽性血液DNA,在52~59 ℃梯度區(qū)間進(jìn)行PCR擴(kuò)增,用1%瓊脂糖凝膠電泳檢測(cè),結(jié)果表明,退火溫度為58 ℃時(shí)特異性條帶最亮,所以選擇58 ℃為最適退火溫度(圖2)。
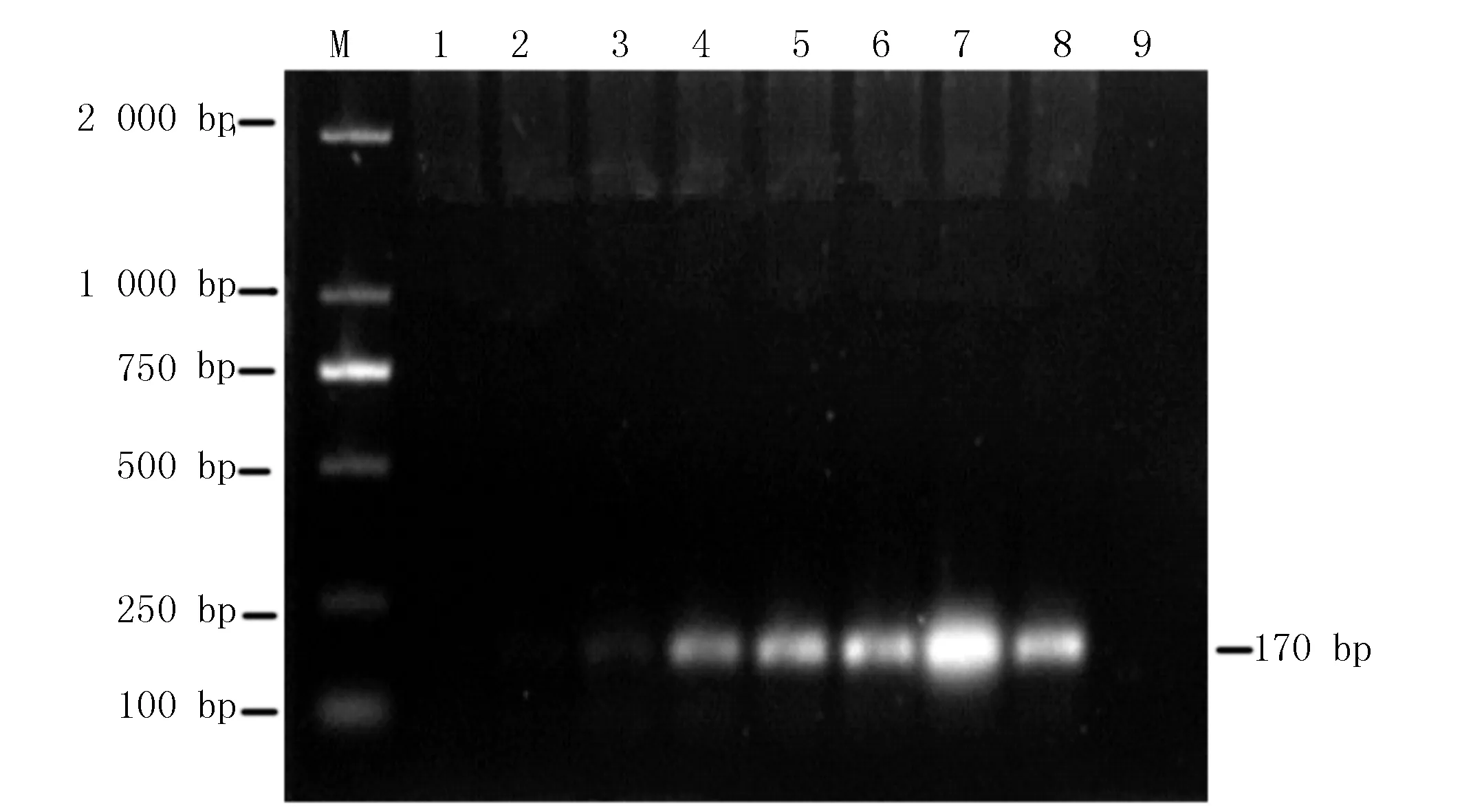
M:DL2 000 DNA Marker;1:52 ℃;2:53 ℃;3:54 ℃;4:55 ℃;5:56 ℃;6:57 ℃;7:58 ℃;8:59 ℃;9:陰性對(duì)照?qǐng)D2 退火溫度篩選試驗(yàn)Fig.2 Optimization of PCR annealing temperature
2.3 重組質(zhì)粒的鑒定
以P1、P2為引物,提取的重組質(zhì)粒為模板進(jìn)行PCR擴(kuò)增,所得擴(kuò)增產(chǎn)物為170 bp,與預(yù)期的目的片段大小一致(圖3)
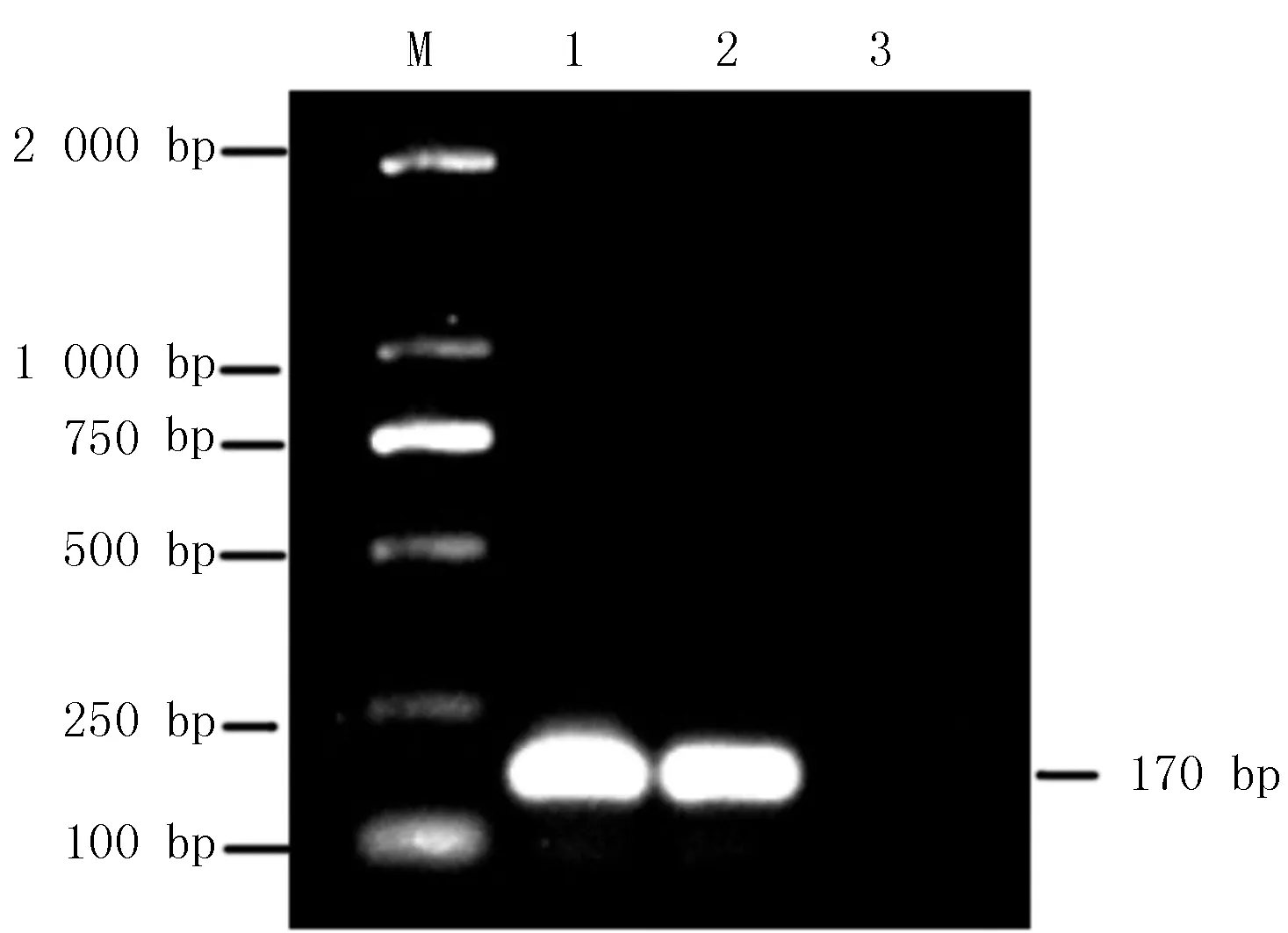
M:DL5 000 Marker;1-2:重組質(zhì)粒PCR擴(kuò)增產(chǎn)物;3:空白對(duì)照?qǐng)D3 重組質(zhì)粒的PCR鑒定結(jié)果Fig.3 The identification of the recombination plasmid by PCR
2.4 測(cè)序結(jié)果的比對(duì)
將鑒定結(jié)果為陽性的重組質(zhì)粒菌液送至生工生物工程(上海)股份有限公司進(jìn)行測(cè)序。序列測(cè)定是長度為170 bp個(gè)核苷酸序列。與GenBank登錄的豬附紅細(xì)胞體序列(AB265823.1)同源性為98%,分別位于第9、16、44、68位的4個(gè)堿基發(fā)生變異(圖4)。

圖4 核苷酸序列對(duì)比圖Fig.4 Nucleotide sequence alignment chart
2.5 特異性試驗(yàn)
將豬附紅細(xì)胞體陽性DNA、豬肺炎支原體、多殺性巴氏桿菌、弓形蟲、豬鏈球菌、豬繁殖與呼吸綜合征病毒和空白無菌水陰性作為模板,以特異性引物P1、P2,進(jìn)行PCR擴(kuò)增反應(yīng)。結(jié)果顯示,除豬附紅細(xì)胞體DNA擴(kuò)增產(chǎn)物在170 bp處可見1條亮的擴(kuò)增條帶外,豬肺炎支原體、多殺性巴氏桿菌、弓形蟲、豬鏈球菌、豬繁殖與呼吸綜合征病毒和空白無菌水陰性對(duì)照均未在170 bp處觀察到擴(kuò)增條帶,表明該方法有較好的特異性(圖5)。
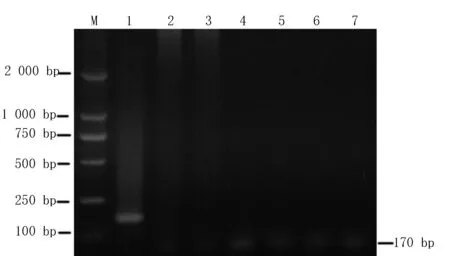
M:DL 2 000 Marker;1:豬附紅細(xì)胞體DNA擴(kuò)增產(chǎn)物;2:豬肺炎支原體;3:多殺性巴氏桿菌;4:弓形蟲;5:豬鏈球菌;6:豬繁殖與呼吸綜合征病毒;7:陰性對(duì)照組圖5 特異性試驗(yàn)鑒定結(jié)果Fig.5 Specific experimental results
2.6 敏感性試驗(yàn)
通過紫外分光光度計(jì)測(cè)定陽性質(zhì)粒的OD260值,將陽性質(zhì)粒DNA按101,102和103進(jìn)行梯度稀釋作為模板,以特異性引物P1、P2進(jìn)行PCR擴(kuò)增反應(yīng)。結(jié)果顯示,當(dāng)質(zhì)粒濃度稀釋1 000倍時(shí),仍可見清晰條帶,說明本方法的敏感性良好(圖6)。
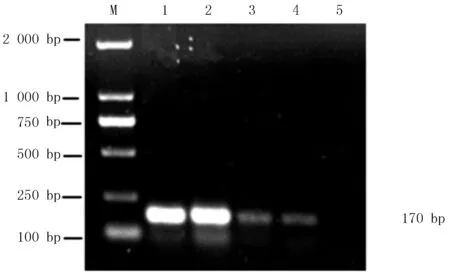
M:DL 5 000 Marker;1:豬附紅細(xì)胞體DNA擴(kuò)增產(chǎn)物;2:101倍稀釋;3:102倍稀釋;4:103倍稀釋;5:陰性對(duì)照組圖6 敏感性試驗(yàn)鑒定結(jié)果Fig.6 Susceptibility results
2.7 臨床應(yīng)用試驗(yàn)
對(duì)采集的40份抗凝血應(yīng)用該試驗(yàn)所建立的PCR方法和相思宇所建立的PCR-ELISA方法進(jìn)行對(duì)比試驗(yàn)。結(jié)果顯示,該試驗(yàn)所建立的PCR方法檢測(cè)出9份陽性血樣,檢出率為22.5%(9/40),利用相思宇建立的PCR-ELISA方法檢測(cè)出9份陽性血樣,檢出率為22.5%(9/40),結(jié)果證明,該試驗(yàn)與相思宇所建立的PCR-ELISA方法的敏感性并無顯著性差異,兩者符合率為100%(表1)。
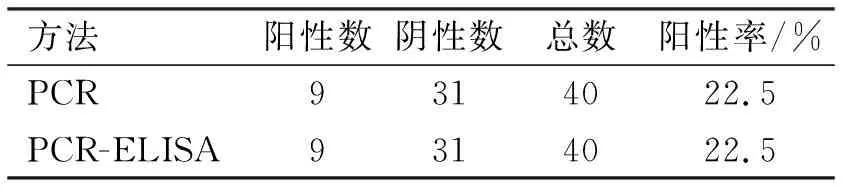
表1 臨床應(yīng)用試驗(yàn)結(jié)果Table 1 Results of clinical trial
3 討論與結(jié)論
豬附紅細(xì)胞體感染的臨床癥狀與多殺性巴氏桿菌、弓形蟲、豬繁殖與呼吸綜合征病毒、豬肺炎支原體、豬鏈球菌等感染的臨床癥狀相似[10-11],所以僅靠臨床癥狀無法進(jìn)行診斷。PCR方法是檢測(cè)附紅細(xì)胞體病常用的分子生物學(xué)方法,該方法敏感性極高,特異性強(qiáng)。此方法在國外早有報(bào)道,1993年Gwaltney等[12]從感染豬附紅細(xì)胞體的病豬血液中提取出豬附紅細(xì)胞體的基因組,利用PCR技術(shù)對(duì)其進(jìn)行基因擴(kuò)增,得到長度為492 bp的擴(kuò)增產(chǎn)物,第1次建立了豬附紅細(xì)胞體的PCR的診斷方法。1999年Joanne等[13]根據(jù)豬附紅細(xì)胞體的16S rRNA基因,設(shè)計(jì)合成了特異性引物,并進(jìn)行PCR擴(kuò)增,所得試驗(yàn)結(jié)果表明該方法敏感性極強(qiáng)。近年來,我國在之后的幾年時(shí)間也陸續(xù)通過PCR擴(kuò)增技術(shù),成功建立附紅細(xì)胞體的檢測(cè)方法[14]。
eno蛋白是新發(fā)現(xiàn)的除MSG1蛋白以外的另一個(gè)主要黏附蛋白,在豬附紅細(xì)胞體侵入宿主細(xì)胞和黏附細(xì)胞的過程中起著重要作用,具有良好的免疫原性,能引起非常強(qiáng)的免疫反應(yīng)[15-17]。然而至今國內(nèi)還沒有關(guān)于豬附紅細(xì)胞體eno基因的PCR診斷方法。所以該試驗(yàn)以eno基因?yàn)檠芯繉?duì)象,設(shè)計(jì)1對(duì)特異性引物,建立豬附紅細(xì)胞體eno基因的診斷方法。
該課題組曾經(jīng)建立了豬附紅細(xì)胞體PCR-ELISA檢測(cè)方法。2種方法都有各自的優(yōu)缺點(diǎn)。PCR-ELISA檢測(cè)方法可以進(jìn)行病原體的定量分析,適合于流行病學(xué)調(diào)查等批量樣本的檢測(cè)。而PCR檢測(cè)方法只能對(duì)病原體進(jìn)行定性分析,適合于小樣本的疾病診斷。從試驗(yàn)結(jié)果分析中可知,2種方法的敏感性和特異性之間沒有統(tǒng)計(jì)學(xué)顯著差異。因此,在實(shí)際應(yīng)用過程中,要根據(jù)實(shí)驗(yàn)?zāi)康暮蛯?shí)驗(yàn)條件等具體情況進(jìn)行相應(yīng)的選擇。
綜上所述,該試驗(yàn)設(shè)計(jì)出了1對(duì)特異性引物,建立了豬附紅細(xì)胞體病的PCR檢測(cè)方法,該方法具有快速、準(zhǔn)確、特異性強(qiáng)、敏感性高的優(yōu)點(diǎn),易于臨床的應(yīng)用。

