人細小病毒B19核酸檢測試劑國家參考品的建立
麻婷婷 許四宏 周海衛
人細小病毒B19(human parvovirus B19,B19V)屬于細小病毒亞科,紅病毒屬[1]。成年后多達40%~60%的人被B19V 感染,老年約90%的人呈抗體陽性[2]。B19V 傳播全年發生,但可能在冬季后期至夏季初見頂[3]。B19V 的唯一傳染源為患者,主要通過呼吸道傳播(飛沫、氣溶膠)、血液制品污染和垂直傳播[4]。B19V 在世界范圍內有1 型、2 型和3 型,其中1 型可分為1a 和1b 型,3 型可以分為3a 和3b 型。1a型是目前在我國流行的主要型別,同時有少量1b 型和3 型存在[5]。目前國內B19V 核酸檢測已有多家公司的產品研發成功,由于該類產品均無系統的質量評價和統一的質量標準,使得這些產品均未在我國獲批上市。因此,建立人細小病毒B19 核酸檢測試劑國家參考品,用于企業試劑研發的質量控制及評價已刻不容緩。為規范和提高國內此類產品的質量,本實驗研制了人細小病毒B19 核酸檢測試劑國家參考品,并制定了其質量標準。現報道如下。
1 材料與方法
1.1 試驗材料
1.1.1 參考品原料來源
血漿樣本由蘭州生物制品研究所、武漢生物制品研究所、深圳市衛光生物制品股份有限公司及首都醫科大學附屬北京地壇醫院提供。
1.1.2 國際標準品
世界衛生組織(world health organization,WHO)國際參考品(3rd WHO International Standard for Parvovirus B19 for Nucleic Acid Amplification Techniques,NIBSC code:12/208),標示濃度為1 410 000 IU/mL。WHO 國際參考品(Parvovirus B19 DNA Nucleic Acid Amplification Technology(NAT)based assays Genotype Panel,NIBSC code:09/110),該參考品包含B19 病毒1 型、2 型和3a 型,標示濃度分別為5.98 log10 IU/mL、5.94 log10 IU/mL和5.97 log10 IU/mL。
1.1.3 檢測試劑
初篩使用上海科華生物工程股份有限公司的人細小病毒B19 核酸檢測試劑盒(PCR-熒光探針法),確認使用In-house 巢式PCR 擴增及測序方法,引物序列見表1[6]。巢式PCR 第一輪反應條件為:第一步94℃熱啟動2 min;第二步94℃20 s,55℃30 s,72℃45 s,40 個 循 環;第 三 步72℃7 min。第二輪反應條件將循環過程中退火溫度升至58℃。

表1 人細小病毒B19 核酸檢測試劑國家參考品PCR 擴增及測序引物[6]Table 1 PCR amplification and sequencing primers of reference panel for Human Parvovirus B19 nucleic acid detection kits[6]
協作標定使用試劑包括蘇州華益美生物科技有限公司、中山大學達安基因股份有限公司、上海之江生物科技股份有限公司和羅氏診斷產品上海有限公司共4 家企業的產品。穩定性研究使用試劑為上海科華生物工程股份有限公司的人細小病毒B19 核酸檢測試劑盒(PCR-熒光探針法)。均勻性研究使用羅氏診斷產品上海有限公司的cobas TaqScreen DPX Test(甲肝和人細小病毒B19檢測試劑盒)檢測。
1.2 試驗方法
1.2.1 參考品制備
篩選及確認后的原料樣本經離心、過濾、稀釋及分包裝后組成參考品,分別編號為8 份陽性參考品PC01~PC08,10 份陰性參考品NC01~NC10,1 份高濃度樣本經陰性稀釋液稀釋后得到精密度參考品(CV1、CV2)、以及1 份高濃度樣本經稀釋得到最低檢出限參考品(L1、L2)。
1.2.2 溯源標定
將WHO 第三代人細小病毒B19 核酸國際標準品(NIBSC 編號12/208)進行梯度稀釋后作為標準品,使用6 家企業的產品對精密度和最低檢出限參考品進行溯源標定和賦值。
1.2.3 穩定性及均勻性考核
本參考品為定性使用。選擇參考品中精密度以及濃度較低的陽性參考品PC04~PC08,分別經室溫(25℃)放置24 h 及反復凍融3 次等處理后使用定性檢測試劑盒進行檢測,以考核其短期穩定性。
選擇精密度參考品CV1 和CV2 進行均勻性研究。分別隨機抽取10 支CV1 和CV2 樣本,使用定性試劑盒進行檢測,每支樣本重復檢測2 次。
1.2.4 統計分析
使用SPSS 16.0 軟件進行統計分析。計量資料采用(±s)表示,組間采用t檢驗,多組間采用F檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 參考品的組成
收集的樣本經PCR 擴增初篩、確認和定值后確定了參考品的組成。見表2。

表2 人細小病毒B19 核酸檢測試劑國家參考品組成Table 2 Composition of reference panel for Human Parvovirus B19 nucleic acid detection kits
2.2 基因分型結果
對參考品中的陽性參考品進行基因分型,除PC01 屬于1b 型以外,其余陽性均屬于1a 型,見圖1。
2.3 協作標定結果及質量標準
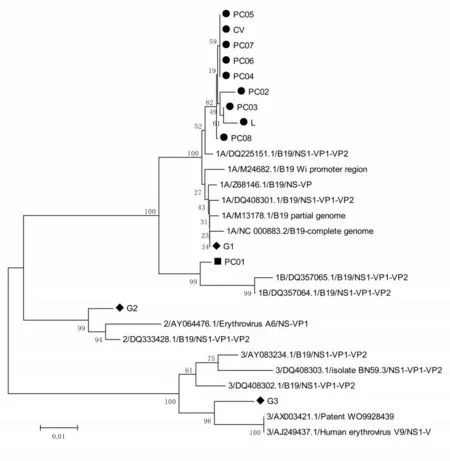
圖1 人細小病毒B19 核酸檢測試劑國家參考品原料樣本基因進化分析結果Figure 1 Phylogenetic tree of reference panel for Human Parvovirus B19 nucleic acid detection kits
精密度參考品CV1 和CV2 的標定結果分別為中強陽性和弱陽性樣本(Ct 值及定量值數據未展示)。4 種檢測試劑對參考品進行標定。見表3。
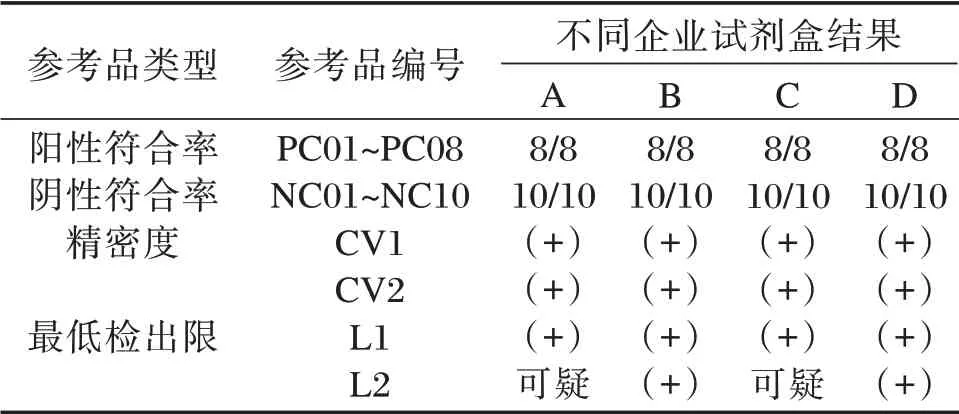
表3 人細小病毒B19 核酸檢測試劑國家參考品協作標定Table 3 Cooperative calibration of reference panel for Human Parvovirus B19 nucleic acid detection kits
參考美國食品和藥物管理局(food and drug administration,FDA)血液篩查標準(104IU/mL)及協作標定結果制定本參考品質量標準[7]:陽性參考品符合率8/8;陰性參考品符合率10/10;精密性變異系數≤5.0%;最低檢出限參考品L1 應為陽性,L2可為陽性或陰性。
2.4 穩定性和均勻性
使用配對T 檢驗對不同處理后檢測的Ct 值與-70℃保存條件下進行比較,室溫25℃放置1 天處理的P值為0.175,反復凍融3 次處理的P值為0.174,表明2 種不同處理均不影響本參考品的穩定性。穩定性考察結果見表4。

表4 人細小病毒B19 核酸檢測試劑國家參考品短期穩定性考察結果Table 4 Short-term stability test on reference panel for Human Parvovirus B19 nucleic acid detection kits
使用單因素方差分析對精密度參考品CV1 和CV2 的均勻性檢測結果進行統計檢驗后顯示,CV1 和CV2 的P值 分別 為0.574(F值=0.330)和0.867(F值=0.029),表明均勻性符合要求。
3 討論
國際已有上市的B19V 核酸檢測商用試劑盒(Qiagen 公司artus Parvo B19 LC PCR Kit 和Roche公司cobas TaqScreen DPX Test)[8]。FDA 對B19V核酸檢測試劑要求必須涵蓋目前已知的所有基因型,同時需要對檢測方法進行方法學驗證包含特異性、精密度、最低檢出限等性能指標,歐洲藥品管理局(european medicines agency,EMA)也有類似的標準[9]。WHO 已建立了第三代人細小病毒B19 核酸國際標準品和第一代人細小病毒B19 核酸分型國際參考品(NIBSC 編號分別為12/208 和09/110)[10]。目前我國還沒有B19V 核酸診斷試劑的行業標準、審評指導原則和標準物質,還沒有上市的B19V 核酸檢測試劑。為對國內此類產品進行系統的質量評價并建立統一的質量標準,本研究研制了人細小病毒B19 核酸檢測試劑定性用國家參考品(編號為370005-201601)。
本課題組對最低檢出限和精密度參考品使用多家試劑進行定值,并已將其溯源至WHO 的第三代人細小病毒B19 核酸國際標準品(NIBSC編碼12/208)。B19V 能明確引起輸血者感染的最低病毒載量還沒有明確,大多數實驗結果顯示,病毒滴度為105IU/mL 時一般不會發生感染[11-12]。因此美國FDA、歐洲藥典和國際血漿蛋白治療協會先后將混合血漿B19V DNA 含量不超過104IU/mL 作為核酸檢測篩查的標準[7,13-14]。本研究將最低檢出限參考品L1 和L2 濃度分別設定為2.4×103和2.4×102IU/mL,并要求L1 應為陽性,L2 可為陽性或陰性,該標準既滿足上述各機構B19 核酸檢測篩查標準又能對試劑進行靈敏度評估并體現試劑間性能差異。同時為保證樣本在運輸、保存和使用過程中的穩定性,對參考品的穩定性進行了考查,結果本研究中的凍融及室溫處理方式不會影響本參考品的穩定性。其均勻性評估結果顯示參考品的均勻性也能夠滿足使用需要。
另外,為滿足國內企業研發試劑溯源需求,本課題組還研制了人細小病毒B19 核酸檢測試劑國家標準品(編號為370023-201601),并同樣將其量值溯源至WHO 的第三代人細小病毒B19 核酸國際標準品,企業可用于研發試劑及質量控制時的量值溯源、性能評估及質量控制等。本參考品及上述標準品的研制確定了我國B19V 核酸檢測試劑的最低質量要求,能夠為企業研發相關試劑建立統一的質量標準。