體外模擬人腸道微生物對葡萄酒花色苷穩定性的影響
劉楊潔,白曉璇,吳璐璐,劉 洋,韓富亮
(1.西北農林科技大學 葡萄酒學院/陜西省葡萄與葡萄酒工程技術研究中心, 陜西 楊凌 712100;2.西北農林科技大學 合陽葡萄試驗示范站, 陜西 合陽 715300)
花色苷是一種天然的可食用水溶性色素,廣泛分布在水果和蔬菜及其相應的食品中。研究表明:花色苷具有抗氧化、抗炎、抗腫瘤、抗菌、心血管保護、神經保護、調節血脂、改善肥胖、修復DNA損傷等多種有益健康的生理活性功能[1-3]。
紅葡萄酒含有豐富的花色苷,新紅葡萄酒中游離花色苷質量濃度在100~2 000 mg·L-1[4-5]。根據其結構,可將歐亞種紅葡萄酒花色苷分為基本花色苷、酰化花色苷、吡喃花色苷和花色苷衍生物(包括寡聚花色苷和多聚花色苷)[6],其中含量最多的花色苷為二甲花翠素-3-O-葡萄糖苷及其相應的乙酰化和香豆酰化葡萄糖苷[7-9]。紅葡萄酒花色苷含量受品種、風土、栽培技術、釀造工藝、陳釀等因素影響[5, 10-12]。
研究表明:多數花色苷的生物可利用度很低[13],花色苷的生物利用率與其在消化系統中的穩定性關系密切。胃腸道理化環境(如pH值、溫度等)影響花色苷的穩定性,在胃部酸性pH條件下,花色苷比較穩定,而在腸道堿性pH條件下,花色苷易降解產生更小分子的酚酸和醛等產物[14-15]。
腸道微生物是影響花色苷穩定性的重要因素[16-17]。人體腸道微生物主要分布在大腸,以細菌為主,且99%以上為厭氧菌,大腸中的微生物種類有500種之多,數量可達3.9×1013(以體重70 kg計算)[17]。
腸道微生物對葡萄酒花色苷穩定性的影響尚不完全明確。本研究采用體外方法培養人體腸道微生物,將赤霞珠紅葡萄酒與腸道微生物混合培養,分析花色苷含量變化,研究腸道微生物對花色苷穩定性的影響,比較花色苷結構與穩定性的關系,為花色苷的消化吸收提供理論和數據支撐,為提高葡萄酒中高穩定性花色苷從而提高其生物利用率提供指導。
1 材料與方法
1.1 材料與試劑
厭氧培養基LA0740,北京索萊寶科技有限公司;磷酸鹽緩沖溶液(phosphate buffer solution,PBS),以十二水合磷酸氫二鈉、磷酸二氫鉀、氯化鉀、氯化鈉配制,試劑分別購自北京索萊寶科技有限公司和廣州市金華大化學試劑有限公司;無水乙醇,成都市科隆化學品有限公司;氫氧化鈉,廣州市金華大化學試劑有限公司;乙腈、甲醇,色譜級,安徽時聯特種溶劑股份有限公司;甲酸、乙酸,色譜級,天津科密歐化學試劑有限公司。二甲花翠素-3-O-葡萄糖苷,純度≥95%, Sigma-Aldrich(上海)貿易有限公司。
1.2 葡萄酒樣品
實驗用酒樣為新疆產的赤霞珠紅葡萄酒(2015年),基本理化指標見表1。
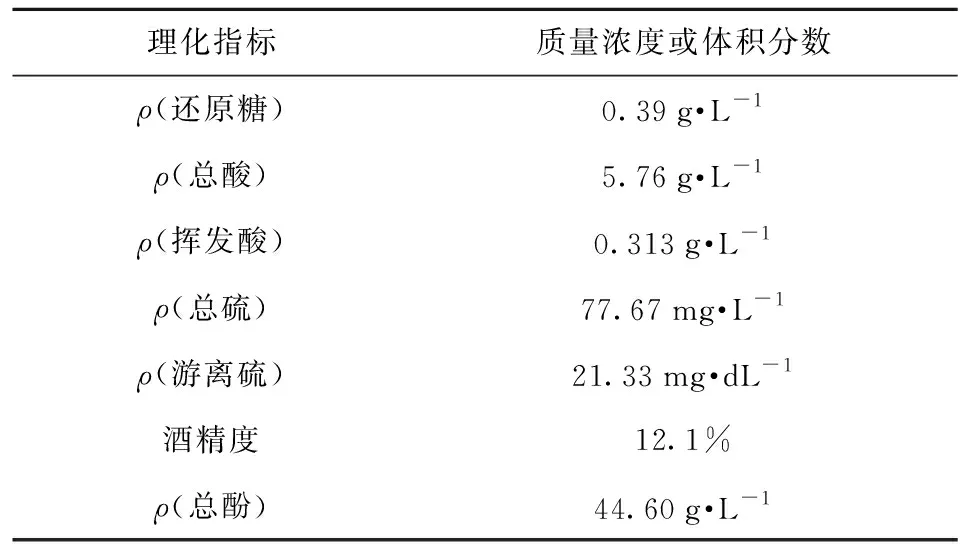
表1 赤霞珠葡萄酒樣理化指標Tab.1 Physicochemical compositions ofCabernet Sauvignon wine
1.3 儀器與設備
YOX- Ⅱ型厭氧培養箱,上海躍進醫療器械有限公司;SW- CJ- 1FD型超凈工作臺,蘇州安泰空氣技術有限公司;TGL- 18M型臺式高速冷凍離心機,上海盧湘儀離心機儀器有限公司;LC- 20A型高效液相色譜儀,日本島津公司;SX- 700型全自動高壓蒸汽滅菌鍋,日本TOMY公司;FD- 1C- 50型真空冷凍干燥機,北京博醫康實驗儀器有限公司;BT25S型萬分之一分析天平,北京賽多利斯科學儀器有限公司;DCG- 9140A型電熱恒溫鼓風干燥箱,上海森信實驗儀器有限公司。
1.4 實驗方法
1.4.1腸道菌群培養液的制備
參考Hidalgo等[18],略做修改。采集腸道狀況穩定良好,至少3個月未服用過抗生素類藥物的健康志愿者的糞便,實驗當天現場采集,立即使用。樣品稱重后用PBS(pH值7.4)以m(糞便)∶V(PBS)=1 g∶9 mL比例制成混懸液,過濾后600 g、37 ℃條件下離心5 min。收取上清液,用無菌厭氧培養基以V(上清液)∶V(厭氧培養基)=1 mL∶9 mL比例混勻,37 ℃厭氧條件下避光無菌培養,模擬人體腸道菌群環境。
1.4.2模擬消化葡萄酒花色苷和二甲花翠素-3-O-葡萄糖苷實驗
紅葡萄酒樣品經冷凍干燥制成干粉,用腸道菌群培養液溶解并稀釋至原酒花色苷濃度的二分之一作為處理組,對照組酒樣干粉使用滅菌的腸道菌群培養液溶解稀釋,37 ℃厭氧環境中避光培養24 h,分別于0、4、12、24 h取樣5 mL,3 000 r/min、4 ℃條件下離心10 min,上清液經0.22 μm孔徑過濾后進行花色苷的高效液相色譜分析。
以二甲花翠素-3-O-葡萄糖苷為標準品,將其與腸道菌群培養液混合,分別制成二甲花翠素-3-O-葡萄糖苷質量濃度為50、10 mg·L-1的標準品處理組1、標準品處理組2,以含有相同濃度二甲花翠素-3-O-葡萄糖苷的無菌培養體系為標準品對照組1、標準品對照組2,培養條件、取樣方法同葡萄酒花色苷。
1.4.3花色苷的高效液相色譜分析
參照Yang等[14]的方法,采用高效液相色譜進行分析。
色譜柱:Kromasil 100-5-C18(250 mm×4.6 mm×5 μm)。流動相A為V(超純水)∶V(乙腈)∶V(甲酸)=8∶4∶1;流動相B為V(超純水)∶V(乙腈)∶V(甲酸)=4∶4∶1。洗脫程序為0~45 min,0%~35% B;45~46 min,35%~100% B;46~50 min,100% B;50~51 min,100%~0% B;51~55 min,0% B。進樣量20 μL;流速1.0 mL/min;柱溫35 ℃;檢測波長520 nm。
HPLC結果參考文獻[14, 19-21],根據保留時間與最大吸收波長,確定各峰代表的花色苷種類,以二甲花翠素-3-O-葡萄糖苷為標準品,對樣品中的花色苷進行定量。
1.5 數據處理
采用SPSS 20.0 軟件對數據進行ANOVA分析,Origin Pro 9.1 繪制花色苷含量的動態變化圖。
2 結果與分析
2.1 葡萄酒中花色苷的分析結果
用高效液相色譜檢測葡萄酒樣品,共檢測出9種花色苷,譜圖和含量分析見圖1和表2。由分析可知,其中包括5種基本花色苷和4種酰化花色苷,總質量濃度為150.51 mg·L-1。其中,二甲花翠素-3-O-葡萄糖苷含量最高,占總花色苷質量分數的56.00%。酰化花色苷中,二甲花翠素-3-O-(6-O-乙酰基)-葡萄糖苷含量最高,占總花色苷質量分數的19.89%。
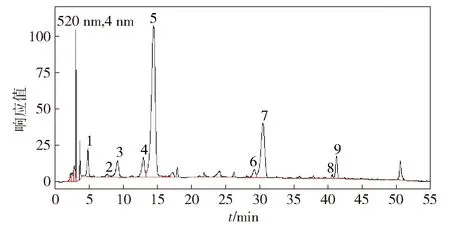
1,花翠素-3-O-葡萄糖苷;2,花青素-3-O-葡萄糖苷;3,3′-甲花翠素-3-O-葡萄糖苷;4,甲基花青素-3-O-葡萄糖苷;5,二甲花翠素-3-O-葡萄糖苷;6,甲基花青素-3-O-(6-O-乙酰基)-葡萄糖苷;7,二甲花翠素-3-O-(6-O-乙酰基)-葡萄糖苷;8,甲基花青素-3-O-(6-O-反式-對香豆酰基)-葡萄糖苷;9,二甲花翠素-3-O-(6-O-反式-對香豆酰基)-葡萄糖苷。圖1 赤霞珠葡萄酒花色苷的液相色譜Fig. 1 HPLC chromatography of anthocyanins in Cabernet Sauvignon red wine

表2 赤霞珠葡萄酒花色苷分析結果Tab.2 Analysis of anthocyanins in Cabernet Sauvignon red wine
2.2 腸道微生物對葡萄酒花色苷穩定性的影響
2.2.1腸道微生物對總花色苷穩定性的影響
圖2為腸道菌群處理組和對照組在24 h內葡萄酒總花色苷含量的變化。無菌條件下總花色苷的降解率為9.57%,而模擬腸道菌群作用下,花色苷降解率約為前者的2倍,達到19.10%,兩者具有顯著差異(P<0.05),這說明腸道菌群可顯著地促進花色苷的降解。
葡萄酒花色苷在模擬腸道菌群條件下0~4 h的降解速率最大,達到10.74%,與花色苷體外共培養研究中,多數花色苷在前5 h有最大降解水平的結果相符[18],這可能與腸道微生物在前期分泌的葡萄糖苷酶活性有關[22-24]。
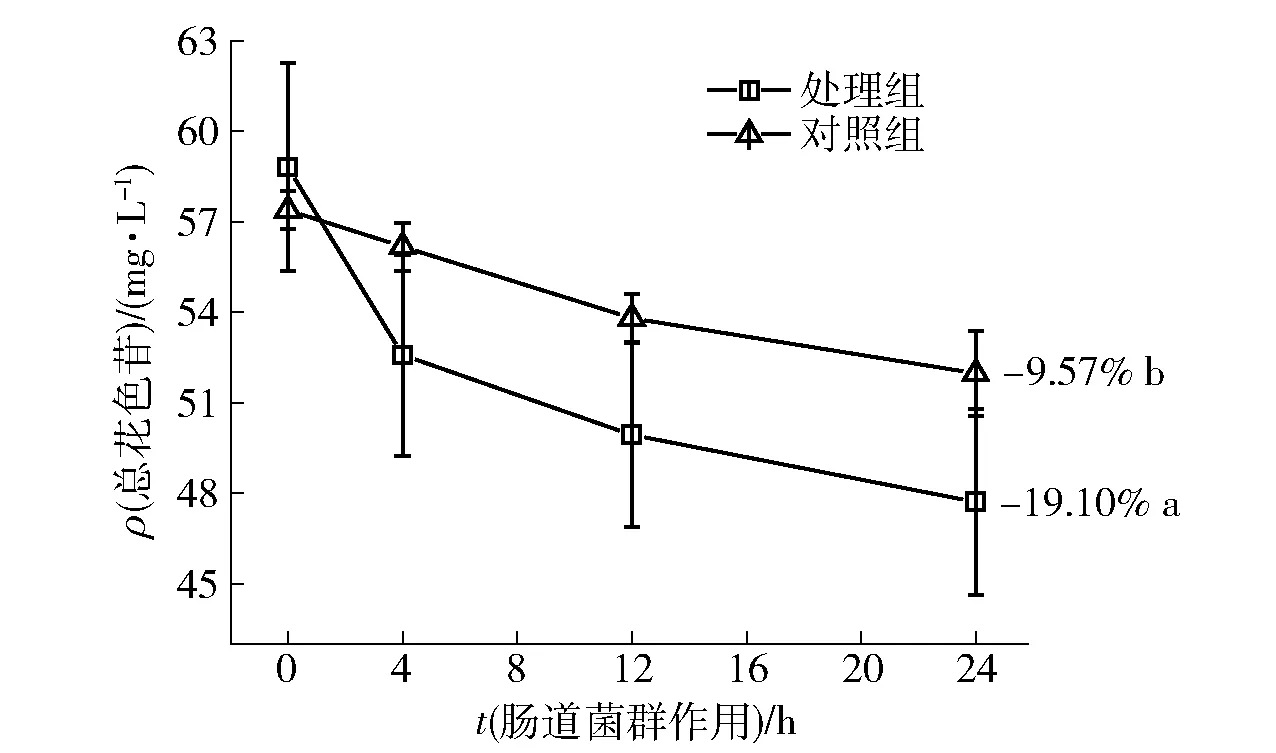
不同字母表示差異顯著(P<0.05)。圖2 腸道菌群作用24 h葡萄酒總花色苷質量濃度變化Fig.2 Mass concentration changes of total anthocyanins in wine within 24 h incubation with gut microbiota
2.2.2腸道微生物對基本花色苷穩定性的影響
葡萄酒中5種基本花色苷在腸道菌群作用24 h內的含量變化如圖3。經過24 h,花翠素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷、3′-甲花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷的質量濃度分別下降35.85%、5.60%、27.20%、18.82%、15.33%,腸道菌群促進了5種基本花色苷的降解,但方差分析表明,對照組和處理組的降解水平沒有顯著差異。
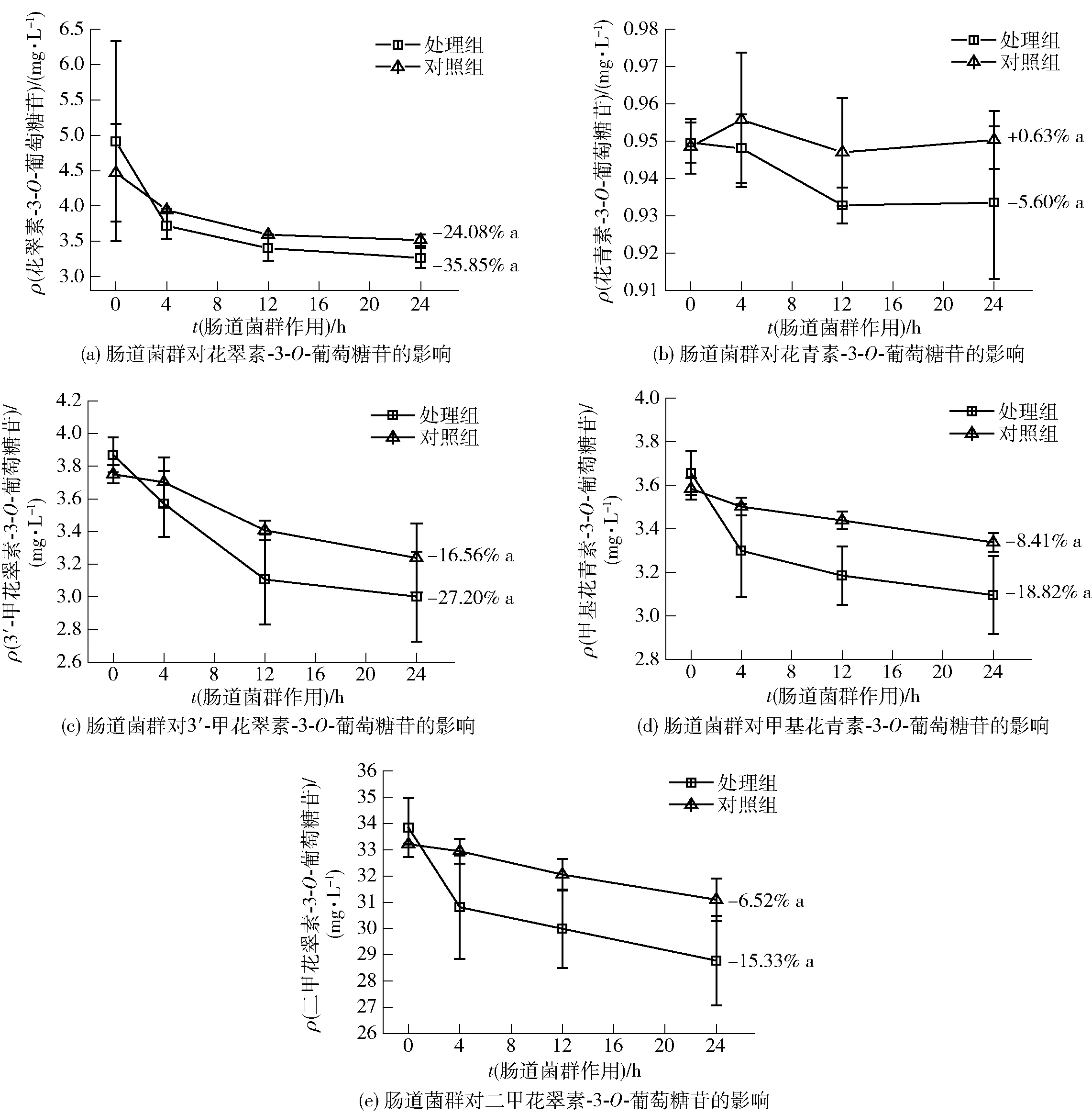
不同字母表示差異顯著(P<0.05)。圖3 腸道菌群作用24 h葡萄酒5種基本花色苷質量濃度變化Fig.3 Mass concentration changes of five basic anthocyanins in wine within 24 h incubation with gut microbiota
基本花色苷降解率的排序由高到低依次為花翠素-3-O-葡萄糖苷、3′-甲花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷,表明花色苷結構的B環影響腸道微生物對基本花色苷的作用。隨著花色苷B環上羥基數量的增加,花色苷降解水平提高,而甲氧基數量的增加有助于穩定花色苷結構,緩解微生物對花色苷的分解。這可能與腸道微生物具有較強的脫羥基作用有關[25-26],但具體機制仍需進一步驗證。花青素-3-O-葡萄糖苷含有羥基,但降解水平最低,對照組甚至出現含量上升的情況,可能與其本身含量較少出現誤差導致,也可能是花色苷在微生物作用下發生結構之間的轉換形成了少量的花青素-3-O-葡萄糖苷,如花翠素-3-O-葡萄糖苷脫羥基,或其他基本花色苷脫甲氧基或甲基形成花青素-3-O-葡萄糖苷[16-17,27]。
2.2.3腸道微生物對酰化花色苷穩定性的影響
葡萄酒中4種酰化花色苷在腸道菌群作用24 h內的含量變化如圖4。經過24 h,甲基花青素-3-O-(6-O-乙酰基)- 葡萄糖苷、二甲花翠素-3-O-(6-O-乙酰基)-葡萄糖苷、甲基花青素-3-O-(6-O-反式- 對香豆酰基)-葡萄糖苷、二甲花翠素-3-O-(6-O-反式- 對香豆酰基)- 葡萄糖苷的質量濃度分別下降20.69%、19.53%、29.30%、28.07%。除甲基花青素-3-O-(6-O-反式- 對香豆酰基)- 葡萄糖苷外,與對照組相比,腸道微生物顯著促進酰化花色苷降解(甲基花青素-3-O-(6-O-乙酰基)- 葡萄糖苷、二甲花翠素-3-O-(6-O-反式- 對香豆酰基)- 葡萄糖苷,P<0.01;二甲花翠素-3-O-(6-O-乙酰基)- 葡萄糖苷,P<0.05)。

不同字母表示差異顯著(P<0.05)。圖4 腸道菌群作用24 h葡萄酒4種酰化花色苷質量濃度變化Fig.4 Mass concentration changes of four acylated anthocyanins in wine within 24 h incubation with microbiota
對比甲基花青素-3-O-葡萄糖苷、二甲花翠素-3-O-葡萄糖苷及其酰化衍生物在腸道菌群作用下的降解率,酰基化降低花色苷結構的穩定性[14],腸道微生物可能優先進行花色苷糖基的去酰基化作用,但具體機制需進一步研究。當母體結構相同時,乙酰化花色苷比反式香豆酰化花色苷更穩定;當酰化結構相同時,花色苷的穩定性與其B環結構有關。
2.3 腸道微生物體對二甲花翠素-3-O-葡萄糖苷穩定性的影響
二甲花翠素-3-O-葡萄糖苷與腸道菌群共培養24 h內的含量變化如圖5。腸道微生物作用24 h后,高濃度與低濃度組的二甲花翠素-3-O-葡萄糖苷均完全降解,而無菌條件下的降解率分別為63.86%和65.07%,腸道微生物顯著促進二甲花翠素-3-O-葡萄糖苷的降解(高濃度P<0.01;低濃度P<0.05)。二甲花翠素-3-O-葡萄糖苷標準品的降解主要發生在4~12 h,標準品幾乎在前12 h完全降解,降解速度和降解水平快于、高于葡萄酒樣品中的二甲花翠素-3-O-葡萄糖苷,這表明:不同花色苷之間可能存在相互作用或者葡萄酒存在基質效應,從而影響腸道微生物對花色苷的降解,具體機制需要進一步研究。
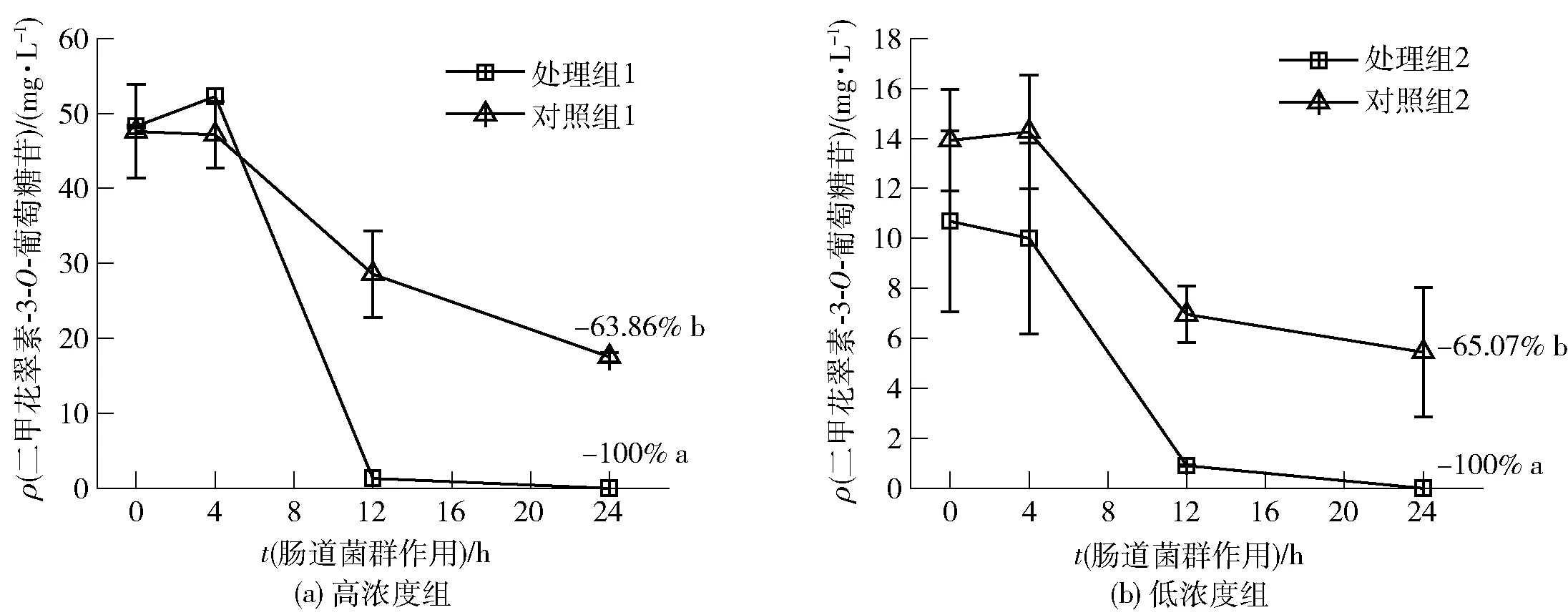
不同字母表示差異顯著(P<0.05)。圖5 腸道菌群作用24 h二甲花翠素-3-O-葡萄糖苷標準品質量濃度變化Fig.5 Mass concentration changes of malvidin-3-O-glucoside within 24 h incubation with gut microbiota
3 結 論
腸道微生物對葡萄酒中9種花色苷的降解具有促進作用。花色苷的B環結構與酰化類型影響腸道菌群的分解作用。花色苷的降解水平隨其B環羥基數量的增加而提高,隨甲氧基數量的增加而降低;腸道微生物對酰化花色苷的降解作用更強,乙酰化花色苷比反式香豆酰化花色苷更穩定。相比于二甲花翠素-3-O-葡萄糖苷標準品,葡萄酒樣品中的二甲花翠素-3-O-葡萄糖苷降解更緩慢,降解水平更低,花色苷之間可能存在影響腸道菌群降解花色苷的相互作用或葡萄酒存在基質效應。腸道微生物是影響葡萄酒花色苷在人體內穩定性的重要因素,對其作用機制進一步研究,有助于了解花色苷在人體結腸的消化吸收規律,指導提高花色苷人體生物可利用率的探究。

