黃芪多糖通過抑制炎癥反應降低SAH大鼠的腦損傷
秦源 熊宇 徐寅生
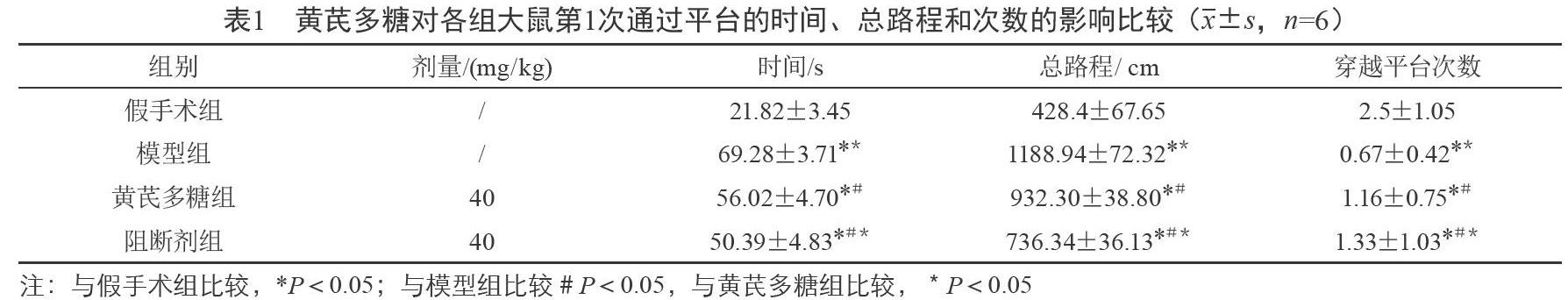


【摘要】目的 研究黃芪多糖通過NF-κB/COX2通路發揮對蛛網膜下腔出血大鼠腦損傷抑制作用的機制。方法 采用顱內血管刺破法建立SAH模型后各組給予相應處理,24 h后進行空間探索實驗,采用HE染色和TEM觀察大鼠海馬區神經元形態結構,免疫蛋白印跡檢測海馬區NF-κB、COX2、TNF-α等因子的表達。結果 與模型組相比,APS和PDTC均能提高大鼠穿越平臺的次數、縮短總路程和降低首次穿越平臺所需時間,上調凋亡抑制因子Bcl2的表達和抑制NF-κB、COX2、Caspase3等因子表達,維持神經元形態結構的穩定,且應用PDTC效果比APS(40 mg/kg)更明顯。結論 黃芪多糖能通過調節炎癥信號通路中相關損傷因子NF-κB、TNF-α等的表達來抑制SAH大鼠海馬部位神經元的凋亡,進而減輕腦損傷并改善大鼠海馬的功能。
【關鍵詞】黃芪多糖;腦出血;凋亡;炎癥
【中圖分類號】R743.3 【文獻標識碼】A 【文章編號】ISSN.2095.6681.2020.26..03
蛛網膜下腔出血(subarachnoid hemorrhage,SAH)是臨床常見的重癥疾病之一,其病死率、致殘率、復發率高,隨著人口老齡化進程的加快,該病的發病率有上升和逐漸年輕化的趨勢[1]。由于腦出血發病迅猛,病機復雜、病情變化多端,是臨床治療的難點,目前未有明顯突破,因此也是目前國內外研究的熱點之一。現代醫學認為腦出血多數存在腦微循環和神經元內環境的變化、腦血流的動力學異常、免疫功能紊亂等,各種變化相互交織影響,最終可以引起細胞凋亡[2],繼而引起腦功能損傷表現為偏癱、意識和功能障礙,嚴重的即可引起人的死亡,其作用機制比較復雜,有待深入研究。
中藥及其提取物因具有多靶點作用,所以常被臨床醫生用來治療在諸多病因不明或病情復雜多變的疾病中,而黃芪多糖具有調節免疫力、抗炎、抑制腫瘤和保護腦神經等作用[3],但具體的作用機制不明。課題組前期證明黃芪多糖能影響轉錄因子κB和下游凋亡蛋白如Caspase-3、Bcl-2的表達發揮對SAH大鼠神經元凋亡的抑制作用,但黃芪多糖的具體作用機制是否通過調節NF-κB信號通路的表達來實現未被明確,且NF-κB能與環氧酶2(cyclooxygenase-2,COX2)基因啟動子序列中位點結合進而調節COX2的表達,參與腦損傷相關疾病的病理過程[4-5]。故課題組擬通過大腦中動脈刺破法建立腦出血模型,進一步明確黃芪多糖調節NF-κB/COX2通路作用具體機制。
1 材 料
1.1 動物及分組
雄性SD大鼠 ,體重280~300 g,由重慶騰鑫比爾實驗動物銷售公司提供。合格證號SCXK(渝)2018-0005。將動物隨機分為4組,即假手術組(A)、SAH模型組(B)、黃芪多糖組(C)和NF-κB抑制劑吡咯烷二硫代氨基甲酸鹽(pyrrolidine dithiocarbamateacid,PDTC)組即阻斷劑組(D),黃芪多糖腹腔注射黃芪多糖40 mg/kg,阻斷劑組腹腔給予8%PDTC,按0.25 mL/100 g,后再給予黃芪多糖40 mg/kg[6]。
1.2 主要試劑
黃芪多糖(APS)購于西安文竹生物科技公司,批號:HK-20171421,分子式為C10H7ClN2O2S,分子量254.69,純度90%,用時稀釋為40mg/kg使用。
1.3 方法
(1)本實驗采用頸內動脈刺破的方法制作模型,具體步驟參照 Bederson法[7],應用水合氯醛,濃度10%,計量1 ml/kg,經腹腔注射,大鼠仰臥固定,逐層鈍性分離后在頸外動脈剪“V”型切口,一次性將4號尼龍線從切口導入到大腦中動脈與大腦前動脈分叉處至出現落空感后(深度20~22 mm),停約10 s,抽出并結扎頸外動脈,縫合消毒,術后黃芪多糖組和阻斷劑組給予阻斷劑8%PDTC腹腔注射黃芪多糖,剩余兩組大鼠腹腔分別給予同劑量的生理鹽水。假手術組在線栓遇到阻力后立即拔出[3]。
(2)空間探索實驗(spatial probe test):該實驗屬于水迷宮(Morris water maze)實驗,其目的是測定觀察對象的空間記憶能力,與大鼠海馬的功能有關。本實驗觀察的是急性損傷,所以僅選擇了利用空間探索的行為實驗反應各組大鼠海馬功能的變化情況。在最后一次定位航行實驗結束后進行相應處理第二天撤去平臺,把大鼠放入原先平臺象限的對側水中,記錄120s大鼠首次通過平臺的時間、穿越平臺的次數和游泳總路程作為檢測指標。
(3)大鼠腦組織海馬的病理形態學觀察:治療24h取各組大鼠,10%水合氯醛麻醉,用動物灌注針將0.9%生理鹽水約300ml沖洗至流出的液體為清澈,用4%多聚甲醛約300 mL滴注10 min左右,然后快速斷頭取腦,放入4%多聚甲醛中后固定(上述液體劑量和灌注時間為每只大鼠所用)。常規石蠟包埋切片(厚度10 μm),采用HE染色,光鏡觀察各組大鼠腦組織海馬區神經元的病理形態學變化。
(4)Western blotting:取四組大鼠海馬放入蛋白提取試管中,超聲粉碎,用BCA法測定蛋白濃度。電泳上樣每孔的蛋白量為60 μg,10%SDS-PAGE分離蛋白質,電轉移至PVDF膜(100 V,100 min),5%BSA室溫封閉1 h,兔抗大鼠Caspase-3多克隆抗體(1∶500,abcam公司,貨號:ab52237),等比例的兔抗大鼠Bcl-2多克隆抗體、NF-κB多克隆抗體和TNF-α等多克隆抗體和小鼠抗大鼠β-actin多克隆抗體(1∶4000,北京普利萊基因技術有限公司)過夜。復溫1 h后分別加相應二抗,HRP標記兔抗小鼠、兔抗山羊和山羊抗兔抗體(1:200,北京普利萊基因技術有限公司),4℃孵育二天。洗滌后,在PVDF膜上滴加ECL發光液(北京普利萊基因技術有限公司),暗室曝光后將蛋白印跡條帶掃描,經Image J圖像軟件分析讀取灰度值并比較。
1.4 統計學方法
采用Sigma Plot 10.0統計學軟件進行實驗數據的統計分析,數據以均值±標準差(x±s)表示。應用單因素方差分析(ANOVA)對空間探索數據和免疫蛋白印跡檢測的蛋白條帶灰度值進行組間比較,P<0.05表示差異有統計學意義。
2 結 果
2.1 黃芪多糖對SAH大鼠空間探索能力的影響
空間探索實驗中,靶象限穿越平臺的次數、總路程和首次穿越平臺的時間數據分析均有統計學意義。與模型組相比,黃芪多糖組和阻斷劑組的大鼠首次穿越平臺所需時間和總路程均減少,差異有統計學意義(P<0.05),而黃芪多糖組與阻斷劑組相比,阻斷劑組首次穿越平臺所需時間和路程要相對更少,阻斷劑組所需時間平均為50.39 s;總路程中與假手術組相比,其他三組游泳路程均高,與模型組相比,黃芪多糖組與阻斷劑組穿越平臺的路程相對減少,差異有統計學意義(P<0.05),其中阻斷劑組的路程平均最少為736.34 cm。在120 s內,穿越象限平臺次數最多的為假手術組,平均為2.5次,與假手術組相比,其他三組穿越象限平臺次數均下降,差異有統計學意義(P<0.05),而與模型組相比,黃芪多糖組與阻斷劑組穿越象限平臺次數有所上升,差異有統計學意義(P<0.05),其中阻斷劑組與黃芪多糖組相比,上升明顯,差異有統計學意義(P<0.05)。因大腦動脈刺破造模技術對出血量無法準確控制的原因造成每組大鼠數值波動較大。以上結果說明黃芪多糖組和NF-κB通路阻斷劑能改善蛛網膜下腔出血大鼠的空間記憶能力,且阻斷劑組大鼠的空間記憶能力改善更為明顯。見表1。
2.2 大鼠腦組織海馬的病理形態學觀察
假手術組大鼠海馬HE染色觀察CA1區錐體細胞體積完整,排列規則,胞核呈圓形或橢圓形,核仁明顯,染色質質地均勻,細胞數量多,相比較模型組大鼠海馬CA1區錐體細胞破碎不完整,壞死明顯,結構松散,部分細胞腫脹明顯,排列雜亂不規整,細胞數量明顯減少;黃芪多糖組和阻斷劑組大鼠正常細胞胞核呈圓形或橢圓形,核仁清晰,染色質豐富,排列較密,存在相對少量細胞核固縮而發生變性的神經元。見圖1。
2.3 黃芪多糖對SAH大鼠NF-κB、COX2、TNF-α蛋白表達的影響(如圖2)
與假手術組相比,黃芪多糖組及模型組大鼠海馬NF-κB、COX2、TNF-α蛋白表達均顯著增加,阻斷劑組COX2、TNF-α蛋白表達也增強,差異有統計學意義(P<0.05),與模型組相比,黃芪多糖組和阻斷劑組大鼠的COX2、TNF-α蛋白表達均顯著性降低,差異有統計學意義(P<0.05);黃芪多糖組NF-κB蛋白表達也明顯降低,而黃芪多糖組與阻斷劑組比較,阻斷劑組COX2、TNF-α蛋白表達相對下降顯著,差異有統計學意義(P<0.05)。
2.4 黃芪多糖對SAH大鼠Bcl 2、Caspase3、IL-1β蛋白表達的影響(如圖3)
與假手術組相比,黃芪多糖組、模型組及阻斷劑組大鼠海馬Bcl 2、Caspase3、IL-1β蛋白表達均顯著增加,差異有統計學意義(P<0.05),與模型組相比,黃芪多糖組和阻斷劑組大鼠的Bcl 2蛋白表達升高,而Caspase3、IL-1β蛋白表達均顯著性降低(P<0.01);而黃芪多糖組與阻斷劑組比較,阻斷劑組Caspase3、IL-1β蛋白表達相對下降顯著,Bcl 2蛋白表達升高顯著,差異有統計學意義(P<0.05)。
3 討 論
蛛網膜下腔出血(Subarachnoid hemorrhage,SAH)具有致死率高、致殘率高及逐漸的年輕化等特點。目前的研究認為,蛛網膜下腔出血后出現的腦損傷可能是SAH后患者死亡或致殘的主要原因[9],其涉及的病理機制復雜包括神經元凋亡、炎癥反應、腦水腫等[10-12]。前期我們的研究證明黃芪多糖能通過影響NF-κB蛋白和凋亡相關蛋白的表達而起到抑制神經凋亡的發生,但是具體作用機制不清楚。
NF-κB是1986年由Sen和Baltimore發現提出,因可與kappa鏈基因結合,故命名為κ基因結合核因子。它不是一種單體蛋白質 ,而是一群功能密切相關的蛋白二聚體,其中在細胞中最常見的作用形式為p65及p50組成的異源二聚體,未受刺激時在細胞質中以非活化形式存在,當有損傷發生后,NF-κB可以活化轉入核內調節一系列基因的表達,對酶類介質和細胞因子如炎性相關因子IL-1、TNF-α、COX2等起到激活作用[13-14]。COX2主要位于細胞漿及細胞核內,因啟動子序列中含有NF-κB特異結合序列,能與NF-κB結合后可以促進COX2基因的轉錄,因此屬于NF-κB通路的重要蛋白因子參與到凋亡及炎癥反應中,對于神經元具有重要意義,有的研究顯示NF-κB在腫瘤具有抗凋亡的作用,也有的研究認為NF-κB的活化會抑制腫瘤細胞的凋亡,促進腫瘤的擴散,通過抑制p65亞基而抑制NF-κB的活性,故而可以抑制腫瘤的增殖[15-16],且NF-κB/COX2通路在蛛網膜下腔出血的具體作用機制還未詳細闡明。課題組研究顯示與模型組相比,SAH大鼠腹腔注射黃芪多糖后能抑制NF-κB(p65)的激活,下調炎癥因子IL-1β、TNF-α和促凋亡因子Caspase-3的表達,提高抗凋亡因子Bcl-2的表達,且應用NF-κB阻斷劑后,作為NF-κB通路的重要蛋白因子COX2因子的表達顯著下降,差異有統計學意義(P<0.05),相應的炎癥反應的相關因子IL-1β、TNF-α及凋亡因子Caspase-3也均下降明顯,說明黃芪多糖能通過NF-κB/COX2通路抑制SAH引起的大鼠腦部炎癥因子的釋放和神經元的凋亡,佐證了上述能通過抑制NF-κB通路中重要蛋白如p65及COX2蛋白的表達進而起到抑制SAH引起神經元凋亡的作用。
海馬結構位于顳葉內側面的基底部,是邊緣系統的重要組成部分,具有多方面的生理功能,目前的研究已證明海馬與學習記憶特別是空間認知功能有關,而Morris水迷宮是測試大鼠學習和記憶非常理想而有效的測試方法。SAH大鼠的空間探索實驗結果表明:與模型組相比,黃芪多糖組與阻斷劑組均能提高SAH大鼠的空間記憶能力,而形態學研究HE染色也表明給予黃芪多糖和阻斷劑的大鼠能提高海馬正常神經元的數量,維持神經元形態結構的完整和穩定。總之,黃芪多糖能通過調節NF-κB/COX2通路中NF-κB(p65)、COX2、IL-1β、TNF-α炎癥相關因子表達而影響凋亡相關因子Caspase-3、Bcl-2的表達,進而可以降低蛛網膜下腔出血對大鼠神經元的損傷,提高其空間記憶能力。

