人參根提取物對小鼠脾淋巴細胞自噬、增殖和細胞因子分泌的影響及機制研究
李芳宇 齊濱 邊帥 趙月 盧姝言 王佳雯 趙大慶

摘 要 目的:研究人參根提取物對小鼠脾淋巴細胞自噬、增殖及細胞因子分泌的影響,并研究其作用機制。方法:將小鼠脾淋巴細胞分為空白對照組、陽性對照組(刀豆蛋白A,5 μg/mL)和不同質量濃度人參根提取物組(32、125、500 μg/mL,以凍干粉末計)。各組細胞加入相應藥物培養48 h后,分別采用吖啶橙染色法檢測細胞的自噬情況;采用CCK-8法檢測細胞的增殖情況;采用酶聯免疫吸附法測定細胞培養液中白細胞介素4(IL-4)、IL-6、腫瘤壞死因子α(TNF-α)的水平;采用Western blotting法檢測細胞中微管相關蛋白輕鏈β3(LC3B)、酵母ATG6同源物(Beclin-1)的表達水平以及腺苷酸活化蛋白激酶(AMPK)、蛋白激酶B(AKT)、雷帕霉素靶蛋白(mTOR)的磷酸化水平。結果:與空白對照組比較,32、125、500 μg/mL人參根提取物均能夠增加小鼠脾淋巴細胞酸性自噬體的數量(P<0.05或P<0.01);125、500 μg/mL人參根提取物均可顯著提高細胞存活率,顯著提高細胞中IL-4、IL-6和TNF-α的水平,顯著促進細胞中LC3BⅠ向LC3BⅡ轉化,顯著上調細胞中Beclin-1蛋白表達水平,顯著提高AMPK蛋白的磷酸化水平,顯著降低AKT和mTOR蛋白的磷酸化水平,差異均有統計學意義(P<0.05或P<0.01)。結論:人參根提取物能通過激活AMPK、抑制AKT活化來抑制mTOR活性,從而誘導小鼠脾淋巴細胞發生自噬、激活脾淋巴細胞活性、調節細胞因子分泌以發揮免疫增強作用。
關鍵詞 人參根提取物;脾淋巴細胞;自噬;細胞因子;免疫增強作用
ABSTRACT ? OBJECTIVE: To study the effects of ginseng root extract on autophagy, proliferation and cytokine of splenic lymphocyte of mice, and to study its mechanism. METHODS: The splenic lymphocyte of mice were divided into blank control group, positive control group (concanavalin A, 5 μg/mL), different concentration of ginseng root extract groups (32, 125, 500 ? ? μg/mL, by lyophilized powder). After 48 h of culture with the corresponding medicine, acridine orange staining method was used to detect autophagy of splenic lymphocyte; CCK-8 assay was used to detect the cell proliferation; ELISA assay was used to determine the levels of IL-4, IL-6 and TNF-α in cell culture; Western blotting method was used to detect the expression of LC3B and Beclin-1, as well as the phosphorylation of AMPK, AKT and mTOR. RESULTS: Compared with blank control group, 32, 125, 500 μg/mL ginseng root extract could increase the number of acidic autophagosomes in splenic lymphocytes of mice (P<0.05 or P<0.01); 125, 500 μg/mL Ginseng root extract could significantly enhance the survival rate of splenic lymphocytes, the levels of IL-4, IL-6 and TNF-α and the transformation of LC3BⅠ to LC3BⅡ, significantly increased the protein expression of Beclin-1, the phosphorylation of AMPK protein, and significantly reduced the phosphorylation level of AKT and mTOR proteins, with statistical significance (P<0.05 or P<0.01). CONCLUSIONS: Ginseng root extract can induce autophagy of mice splenic lymphocytes, activate the activity of splenic lymphocytes, regulate the secretion of cytokine by activating AMPK and inhibiting the activation of AKT which can inhibit the activity of mTOR, so as to exert immune enhancement effect.
KEYWORDS ? Ginseng root extract; Splenic lymphocytes; Autophagy; Cytokine; Immune enhancement effect
人參是五加科人參屬植物人參Panax ginseng C. A. Mey.的干燥根及根莖[1]。據《神農本草經》記載:“人參主補五臟,安精神,定魂魄,除邪氣,明目、開心、益智,久服輕身延年”[2]。現代藥理學研究表明,人參具有改善記憶力、抗疲勞、抗衰老、抗病毒以及提高免疫力等功效,并且對非特異性免疫、體液免疫和細胞免疫均有明顯的調節作用[3-9]。自噬是細胞吞噬自身細胞質蛋白或細胞器進入囊泡,與溶酶體形成自噬溶酶體并降解其包裹的內容物的過程,以此可更新細胞器并完成細胞的自身代謝[10]。同時,自噬在淋巴細胞的活化過程中起著重要的作用[11]。多個研究指出,人參及其主要成分具有免疫調節的作用[12]。然而,人參對脾淋巴細胞自噬及免疫調節方面的作用鮮有報道。鑒于此,本研究選用人參根提取物體外作用于小鼠脾淋巴細胞,探究其對脾淋巴細胞自噬、增殖以及免疫因子分泌的影響,并初步探討其可能的作用機制,為人參根提取物的深入研究和開發提供理論基礎。
1 材料
1.1 儀器
Infinite 200 Pro型酶標儀(瑞士Tecan公司);3111型CO2培養箱、iBright型智能成像系統FL1000(美國 Thermo Fisher Scientific公司);IX73型熒光顯微鏡(日本Olympus公司);1645050型蛋白質凝膠電泳儀、Mini- Protean 1658001型電泳槽(美國Bio-Rad公司)。
1.2 藥品與試劑
人參藥材采購自吉林撫松(采摘時間為2018年9月20日),由長春中醫藥大學藥學院肖井雷副教授鑒定為五加科人參屬植物人參Panax ginseng C. A. Mey.的干燥根;RPMI 1640培養基(美國Hyclone公司);胎牛血清(美國Gibco公司);刀豆蛋白A(美國Sigma公司,批號:C0412,純度:95%);CCK-8試劑盒(美國Boster公司,批號:AR1160-500);白細胞介素4(IL-4)、IL-6、腫瘤壞死因子α(TNF-α)酶聯免疫吸附(ELISA)試劑盒(上海優選生物科技有限公司,批號:YX-091204M、YX-091026M、YX-201606M);紅細胞裂解液、二喹啉甲酸(BCA)蛋白濃度測定試劑盒(上海碧云天生物技術有限公司,批號:C3702、P0010);吖啶橙(AO)染料(北京索萊寶科技有限公司);兔抗蛋白激酶B(AKT)、磷酸化AKT(p-AKT)、腺苷酸活化蛋白激酶(AMPK)、磷酸化AMPK(p-AMPK)、雷帕霉素靶蛋白(mTOR)、磷酸化mTOR(p-mTOR)、β-肌動蛋白(β-actin)多克隆抗體(南京巴傲得生物科技有限公司,批號:BS90043、BS4006、BS6271、BS4010、BS1555、BS4706、AP0060);兔抗微管相關蛋白輕鏈β3(LC3B)、酵母ATG6同源物(Beclin-1)單克隆抗體及辣根過氧化物酶(HRP)標記的山羊抗兔免疫球蛋白G(IgG)二抗(美國CST公司,批號:12741、3495、7074P2);其余試劑均為分析純或實驗室常用規格,水為超純水。
1.3 動物
SPF級C57BL/6小鼠20只,雄性,8周齡,體質量18~20 g,購自長春億斯實驗動物技術有限責任公司,生產合格證號:SCXK(吉)2018-0007。本實驗方案符合《吉林省實驗動物管理辦法》對動物倫理的要求。
2 方法
2.1 人參根提取物的制備
精密稱取人參根50 g,粉碎,過篩(80目),加入10倍量水(mL/g,下同),40 ℃水浴超聲(頻率:40 kHz,功率:600 W)提取2 h,將提取液以3 500 r/min離心5 min后,濾過,收集濾液并進行超濾濃縮。殘渣加10倍量水,80 ℃水浴提取1.5 h,將提取液以3 500 r/min離心5 min后,濾過,收集濾液并進行超濾濃縮。分別將2次濃縮液凍干,即得(人參根提取物收率為21.58%),其中有效成分含量為人參蛋白7.32%、人參多糖8.7%、人參皂苷9.5%。
2.2 小鼠脾淋巴細胞的制備
將小鼠處死,按文獻方法[13]在無菌操作條件下取出其脾組織并制備脾淋巴細胞懸液,用血球計數板進行細胞計數,備用。
2.3 人參根提取物對小鼠脾淋巴細胞自噬的影響考察
采用AO染色法進行測定。將小鼠脾淋巴細胞按5×106個/孔接種至6孔板中,將細胞分為空白對照組(空白培養基)、陽性對照組(刀豆蛋白A,5 μg/mL[14])和不同質量濃度人參根提取物組(32、125、500 μg/mL,以凍干粉末計,質量濃度按照前期預試驗設置)。各組細胞加入相應藥物在37 ℃、5%CO2培養箱中(下同)培養48 h。以1 000 r/min離心5 min,收集各孔細胞,以磷酸鹽緩沖液(PBS)洗滌3次后,以4%多聚甲醛室溫固定10 min,然后以1 000 r/min離心5 min,收集細胞;再次用PBS洗滌3次,然后加入AO染液(終質量濃度為15 ? ? ? ?μg/mL),室溫避光孵育15 min后,在熒光顯微鏡下觀察細胞的形態并拍照。采用Image Pro Plus 6.0軟件進行免疫熒光分析。當自噬水平較低時主要觀察到綠色熒光,當自噬水平較高時紅色熒光增強,兩者合成后呈黃色熒光,黃色熒光強度值越大則表明細胞自噬水平越高。試驗重復3次。
2.4 人參根提取物對小鼠脾淋巴細胞增殖的影響考察
采用CCK-8法進行測定。將小鼠脾淋巴細胞按1×105個/孔接種至96孔板中,按“2.3”項下方法進行細胞分組、給藥。培養48 h后,每孔加入10 μL CCK-8試劑,然后培養2 h。另設不加藥物和細胞的陰性對照組。采用酶標儀于450 nm波長下測定各孔的光密度(OD)值[15],并計算各組細胞的存活率[細胞存活率(%)=(給藥組OD值-空白對照組OD值)/(陰性對照組OD值-空白對照組OD值)×100%]。試驗重復3次。
2.5 人參根提取物對小鼠脾淋巴細胞培養液中IL-4、IL-6和TNF-α水平的影響考察
采用ELISA法進行測定。將小鼠脾淋巴細胞按1×105個/孔接種至96孔板中,按“2.3”項下方法進行細胞分組、給藥。培養48 h后,以3 000 r/min離心10 min,收集各孔細胞培養上清液。參照相應試劑盒說明書方法操作,檢測細胞培養液中IL-4、IL-6和TNF-α水平。試驗重復3次。
2.6 人參根提取物對小鼠脾淋巴細胞中自噬相關蛋白表達的影響考察
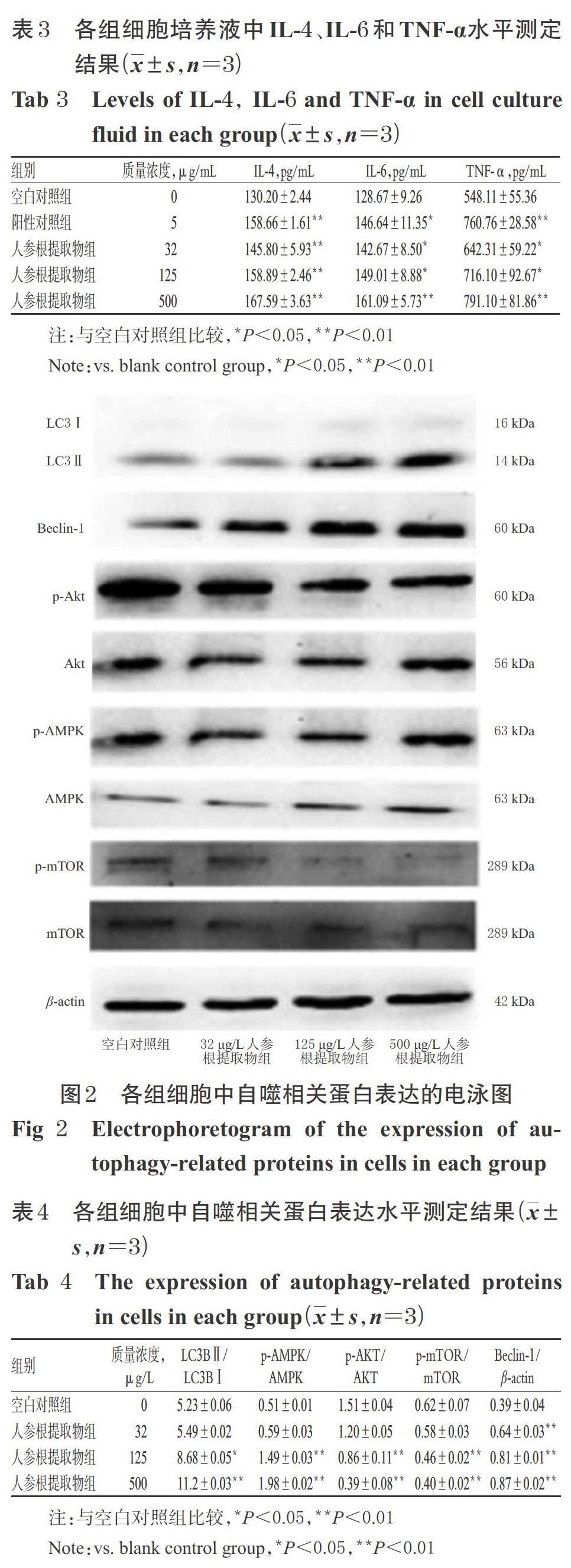
采用Western blotting法進行測定。將小鼠脾淋巴細胞按5×106個/孔接種至6孔板中,將細胞分為空白對照組和不同質量濃度人參根提取物組(按“2.3”項下方法設置為32、125、500 μg/mL,以凍干粉末計)。培養48 h后,以1 000 r/min離心5 min,收集各孔細胞,用PBS洗滌3次,然后加入細胞裂解液充分裂解后,再采用BCA法測定蛋白濃度。將蛋白變性處理后,取50 μg在80 V電壓下行十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳90 min,然后以200 mA濕法轉膜80 min至硝酸纖維素膜(NC)上。將膜放入含5%脫脂奶粉的PBST緩沖液中室溫封閉1 h后,加入LC3B、Beclin-1、AKT、p-AKT、AMPK、p-AMPK、mTOR、p-mTOR、β-actin一抗(稀釋度均為1 ∶ 1 000),4 ℃孵育過夜;以PBST緩沖液洗膜3次,然后加入二抗(稀釋度為1 ∶ 1 000),室溫孵育1 h;以PBST緩沖液再次洗膜3次,然后在智能成像系統中采用ECL化學發光液顯色。采用Image J 1.52a軟件對蛋白條帶進行灰度值分析,以目標蛋白條帶灰度值與內參β-actin條帶灰度值的比值表示目標蛋白的表達水平,分別以p-AKT/AKT、p-AMPK/AMPK、p-mTOR/mTOR比值表示AKT、AMPK、mTOR蛋白的磷酸化水平,以LC3BⅡ/LC3BⅠ的比值反映IC3BⅠ向LC3BⅡ轉化的情況。試驗重復3次。
2.7 統計學方法
采用GraphPad Prism 5 軟件進行數據處理。計量資料以x±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗。P<0.05表示差異具有統計學意義。
3 結果
3.1 人參根提取物對小鼠脾淋巴細胞自噬的影響
與空白對照組比較,各給藥組細胞的熒光強度(指合成后的黃色熒光強度,下同)均顯著增大(P<0.05或P<0.01),說明給藥后細胞的自噬水平均顯著升高,且人參根提取物的作用具有一定的濃度依賴趨勢。各組細胞的AO染色顯微圖見圖1,熒光強度測定結果見表1。
3.2 人參根提取物對小鼠脾淋巴細胞增殖的影響
與空白對照組比較,陽性對照組和125、500 μg/mL人參根提取物組細胞的OD值均顯著升高(P<0.05或P<0.01),其中500 μg/mL人參根提取物組細胞的存活率達到了150.00%。由此可見,125~500 μg/mL人參根提取物可刺激小鼠脾淋巴細胞的增殖。各組細胞的OD值和存活率測定結果見表2。
3.3 人參根提取物對小鼠脾淋巴細胞分泌IL-4、IL-6和TNF-α的影響
與空白對照組比較,各給藥組細胞培養液中IL-4、IL-6和TNF-α水平均顯著升高(P<0.05或P<0.01),表明給藥后可促進小鼠脾淋巴細胞分泌免疫因子IL-4、IL-6和TNF-α,且人參根提取物的作用具有一定的濃度依賴趨勢。各組細胞培養液中IL-4、IL-6和TNF-α水平測定結果見表3。
3.4 人參根提取物對細胞中自噬相關蛋白表達的影響
與空白對照組比較,125、500 μg/mL人參根提取物組細胞中LC3BⅡ/LC3BⅠ、p-AMPK/AMPK均顯著升高(P<0.05或P<0.01),p-AKT/AKT、p-mTOR/mTOR均顯著降低(P<0.01); 32、125、500 μg/mL人參根提取物組細胞中Beclin-1蛋白表達水平均顯著升高(P<0.01)。各組細胞中自噬相關蛋白表達的電泳圖見圖2,蛋白表達水平測定結果見表4。
4 討論
本課題組前期經過設置人參根提取物樣品溶液的系列質量濃度梯度,確定了其在32~500 μg/mL質量濃度范圍內對小鼠脾淋巴細胞無毒性,且能夠提高細胞活性,并具有濃度依賴趨勢。因此,本研究選用32、125、500 μg/mL這3個質量濃度進行研究。脾淋巴細胞增殖是反映機體細胞免疫與體液免疫最直接的指標[16]。本研究結果顯示,人參根提取物作用于小鼠脾淋巴細胞后,細胞增殖能力顯著增強。這說明人參根提取物能促進小鼠體外淋巴細胞增殖,具有增強細胞免疫功能的作用。
淋巴細胞是適應性免疫應答中的關鍵部分[17],本研究主要測定了小鼠脾淋巴細胞中IL-4、IL-6和TNF-α這3種細胞因子的分泌情況。IL-4是由輔助T細胞產生的細胞因子,主要作用于B細胞,可促進B細胞的增殖[18];IL-6在細胞吞噬、抗原提呈、炎癥調節中均扮演著重要角色,其能夠同時調節細胞免疫和體液免疫[19];TNF-α能夠加強免疫反應,并誘導其他免疫因子的分泌[20-21]。本研究結果表明,人參根提取物能夠誘導小鼠脾淋巴細胞分泌IL-4、IL-6和TNF-α,從而增強免疫功能,并且其作用具有一定的濃度依賴趨勢。
自噬是細胞吞噬受損的細胞器及其變性的蛋白質,并將吞噬物轉運到溶酶體中進行降解和再循環,是一種廣泛存在于真核細胞內的自我降解機制[22]。自噬的激活受多種途徑調控,其中mTOR信號傳導途徑為細胞自噬過程中最重要的調控途徑,起負向調控作用[23]。AMPK是一種絲/蘇氨酸激酶,其活化(磷酸化)后在細胞生長、自噬、凋亡等生物學過程中發揮著重要作用[14]。Akt(或稱PKB)同樣也是一種絲/蘇氨酸蛋白激酶,其可協同磷脂酰肌醇依賴性蛋白激酶1/2促進三磷酸磷脂酰肌醇與其自身結合,Akt由細胞質轉移至細胞膜并發生活化(即磷酸化),Akt活化后可激活下游蛋白mTOR(即使其磷酸化)[24]。研究證實,AMPK/mTOR與Akt/mTOR是兩條經典的自噬信號通路[25-26]。近年來,大量的研究表明,自噬參與淋巴細胞的發育、固有免疫和適應性免疫應答途徑[27]。在過去的10年里,自噬已經成為T細胞穩態、激活和分化的重要調節因素,基礎自噬能夠維持T細胞的內環境穩態,活化誘導的巨自噬被認為是細胞增殖和代謝的關鍵調控因素,也是效應CD8+T細胞記憶產生的關鍵[28]。Beclin1是哺乳類動物中第一個被確認的自噬特異性調控基因,通過BH3區域、CCD及ECD在細胞自噬和凋亡過程中發揮至關重要的作用[29]。LC3是控制自噬膜的形成和自噬體與溶酶體融合的關鍵蛋白,在自噬體膜的延伸和成熟中發揮關鍵作用,其分為 LC3Ⅰ和LC3Ⅱ兩種亞型,自噬發生時,可溶性LC3Ⅰ被活化,并修飾形成LC3-Ⅱ后通過融合蛋白轉位至自噬體膜,從而促進自噬體的成熟,參與自噬體形成[30-32]。LC3Ⅱ是自噬體的標志分子,其含量的多少與自噬泡數量的多少呈正比,因此自噬程度與 LC3Ⅱ表達水平呈正相關[30]。本研究結果發現,人參根提取物可增加小鼠脾淋巴細胞自噬水平,使AMPK的磷酸化水平提高,AKT與mTOR的磷酸化水平降低,并可上調自噬相關蛋白Beclin-1的表達,增加LC3BⅠ到LC3BⅡ的轉化[10],這說明人參根提取物可活化小鼠脾淋巴細胞,并通過AMPK/mTOR和AKT/mTOR途徑誘導細胞自噬。
綜上所述,人參根提取物能通過激活AMPK、抑制AKT活化來抑制mTOR活性,從而誘導小鼠脾淋巴細胞發生自噬、激活脾淋巴細胞活性、調節細胞因子分泌來發揮免疫增強作用。后續本課題組將在此基礎上進一步探究其作用的分子機制及其對淋巴細胞不同亞群的影響。
參考文獻
[ 1 ] 國家藥典委員會.中華人民共和國藥典:一部[S]. 2020年版.北京:中國醫藥科技出版社,2020:8.
[ 2 ] 吳普述.神農本草經[M].南寧:廣西科學技術出版社,2016:31.
[ 3 ] 李倩,柴藝匯,高潔,等.人參現代藥理作用研究進展[J].貴陽中醫學院學報,2019,41(5):89-92.
[ 4 ] 許慧.人參皂苷Rg1及其代謝產物Rh1、Ppt 生精保護作用的分子機制研究[D].開封:河南大學,2013.
[ 5 ] 姚根蘭,張婭萍,歐陽柳鳳,等.人參抗疲勞作用的研究進展[J].世界中西醫結合雜志,2015,10(8):1174-1177.
[ 6 ] 潘鑫鑫,鄭衛紅.人參總皂苷抗衰老作用的實驗研究[J].中國老年學雜志,1995,15(5):288-290.
[ 7 ] SONG JH,SONG HH,et al. Antiviral activity of ginse- nosides against coxsackievirus B3,enterovirus 71,and human rhinovirus 3[J]. J Ginseng Res,2014,38(3):173- 179.
[ 8 ] 張南,李娜,李佳琳,等.人參、刺五加提取物對鏈脲佐菌素誘導糖尿病小鼠的降糖作用研究[J].天然產物研究與開發,2014,26(10):1690-1695.
[ 9 ] WANG Y,LIU Y,ZHANG XY,et al.Ginsenoside Rg1 re- gulates innate immune responses in macrophages through differentially modulating the NF-κB and PI3K/Akt/mTOR pathways[J]. Int Immunopharmaco,2014,23(1):77-84.
[10] 鄭祖國,張評滸.細胞自噬形成機制及其功能研究進展[J].中國細胞生物學學報,2016,38(12):1541-1548.
[11] 邢君娜,王金麗,何新新,等.胸腺上皮細胞自噬在T細胞分化發育中的研究進展[J].中國免疫學雜志,2020,36(2):254-258.
[12] 白玉潔,鄭厚勝,王英平,等.人參免疫調節作用研究進展[J].特產研究,2019,41(1):99-103.
[13] 張妍,林昌岫,邵玉健,等.輪葉黨參粗多糖對體外培養小鼠脾淋巴細胞及RAW 264.7細胞的免疫活性[J].食品工業科技,2018,39(12):311-315.
[14] 于思文,張妍,田海玲,等.黃精粗多糖對體外培養小鼠脾淋巴細胞及巨噬細胞免疫活性的影響[J].延邊大學醫學學報,2019,42(2):107-110.
[15] 朱科學,聶少平,李文娟,等.黑靈芝多糖對小鼠脾淋巴細胞增殖及誘生細胞因子的影響[J].食品科學,2010,31(19):351-354.
[16] PARZYCH KR,KLIONSKY DJ. An overview of autophagy:morphology,mechanism,and regulation[J]. Antioxid Redox Signal,2014,20(3):460-473.
[17] LUO B,QUE ZJ,ZHOU ZY,et al. Feiji Recipe inhibits the growth of lung cancer by modulating T-cell immunity through indoleamine-2,3-dioxygenase pathway in an orthotopic implantation model[J]. J Integr Med,2018,16(4):283-289.
[18] 高煥,王德云,郭利偉,等.淫羊藿多糖脂質體對雞淋巴細胞增殖及IL-2、IL-4和IFN-γ mRNA表達的影響[J].畜牧獸醫學報,2013,44(1):115-121.
[19] WU F,ZHOU C,ZHOU D,et al. Structure characterization of a novel polysaccharide from Hericium erinaceus fruiting bodies and its immunomodulatory activities[J]. Food Funct,2018,9(1):294-306.
[20] JI G,CHEN R,ZHENG J. Macrophage activation by polysaccharides from Atractylodes macrocephala Koidz through the nuclear factor-kappa B pathway[J]. Pharm ? Biol,2015,53(4):512-517.
[21] LIU Y,HO RC,MAK A. Interleukin(IL)-6,tumour necrosis factor alpha(TNF-alpha) and soluble interleukin-2 receptors(sIL-2R) are elevated in patients with major depressive disorder:a meta-analysis and metaregression[J]. J Affect Disorders,2012,139(3):230-239.
[22] 屈嶺,梁曉春.自噬對糖尿病慢性并發癥的影響[J].基礎醫學與臨床,2013,33(5):631-634.
[23] 饒小娟,吳毓敏,王彥.麥冬皂苷介導AMPK/Akt/mTOR通路對糖尿病大鼠心肌細胞自噬的影響[J].中國循證心血管醫學雜志,2018,10(11):1362-1367.
[24] GUAN F,DING Y,ZHANG Y,et al. Curcumin suppres- ses proliferation and migration of MDA-MB-231 breast cancer cells through autophagy dependent Akt degradation[J]. PLoS One,2016. DOI:10.1371/journal.pone. 0146553.
[25] XUE JF,SHI ZM,ZOU J,et al. Inhibition of PI3K/AKT/mTOR signaling pathway promotes autophagy of articular chondrocytes and attenuates inflammatory response in rats with osteoarthritis[J]. Biomed Pharmaco Ther,2017,89(17):1252-1261.
[26] ZHANG Y,LING Y,YANG L,et al. Liraglutide relieves myocardial damage by promoting autophagy via AMPK- mTOR signaling pathway in zucker diabetic fatty rat[J]. Mol Cell Endocrinol,2017,448(17):98-107.
[27] WU DJ,ADAMoPOULOS IE. Autophagy and autoimmunityr[J]. Clin Immunol,2017. DOI:10.1016/journal.clim. 2017.01.007.
[28] DOWLING SD,MACIAN F. Autophagy and T cell meta- bolism[J]. Cancer Lett,2018. DOI:10.1017/journal.canlet. 2018.01.033.
[29] YUE Z,JIN S,YANG C,et al. Beclin 1,an autophagy gene essential for early embryonic development,is a haploinsufficient tumor suppressor[J]. Proc Natl Acad Sci U S A,2003,100 (25):15077-15082.
[30] KUMA A,MATSUI M,MIZUSHIMA N. LC3,an autophagosome marker,can be incorporated into protein aggregates independent of autophagy:caution in the interpretation of LC3 localization[J]. Autophagy,2007,3(4):323-328.
[31] LI W,ZOU W,YANG Y,et al. Autophagy genes function sequentially to promote apoptotic cell corpse degradation in the engulfing cell[J]. J Cell Biol,2012,197(1):27-35.
[32] BU T,WANG C,JIN H,et al. Organic anion transporters and PI3K-AKT-mTOR pathway mediate the synergistic anticancer effect of pemetrexed and rhein[J]. J Cell Phy- siol,2020,235(4):3309-3319.
(收稿日期:2020-05-22 修回日期:2020-09-21)
(編輯:林 靜)

