穿膜肽GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體的處方優化及細胞毒性研究
姚雪敏 荊鳴 蔡馥伊 孔亮 李學濤

摘 要 目的:制備穿膜肽GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體,對其處方進行優化,并初步評價其對乳腺癌細胞的體外毒性。方法:采用薄膜分散法和硫酸銨水化法,將柔紅霉素和薯蕷皂苷包載其中,在表面以聚乙二醇-二硬脂酰基磷脂酰乙醇胺2000(DSPE-PEG2000)-GGPFV修飾,制備GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體。以包封率為指標,采用Box-Behnken響應面法優化處方中水化體積、膽固醇用量和柔紅霉素用量;測定按最優處方制備的3批脂質體的包封率。比較柔紅霉素/薯蕷皂苷脂質體、GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體和空白脂質體作用后對人乳腺癌MDA-MB-435S細胞存活率的影響。結果:最優處方為水化體積5 mL、膽固醇4 mg、蛋黃卵磷脂22 mg、柔紅霉素0.55 mg、薯蕷皂苷0.85 mg、DSPE- PEG2000 3.5 mg、DSPE-PEG2000-GGPFV 2 mg。所制3批脂質體中,柔紅霉素的包封率為(96.21±1.54)%,薯蕷皂苷的包封率為(95.39±2.48)%。體外細胞毒性試驗顯示,GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體對MDA-MB-435S細胞的抑制作用顯著強于柔紅霉素/薯蕷皂苷脂質體(P<0.05),膜材無細胞毒性。結論:成功制得GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體,其對人乳腺癌MDA-MB-435S細胞的體外抑制作用明顯增強。
關鍵詞 脂質體;GGPFV;柔紅霉素;薯蕷皂苷;處方優化;Box-Behnken響應面法;細胞毒性
ABSTRACT ? OBJECTIVE: To prepare GGPFV-modified Daunorubicin/dioscin liposomes, and to optimize their formulation and to preliminarily evaluate their cytotoxicity to breast cancer cells in vitro. METHODS: Daunorubicin and diosgenin were wrapped by thin film dispersion method and ammonium sulfate hydration method; the surface was modified with DSPE-PEG2000-GGPFV to prepare GGPFV-modified Daunorubicin/dioscin liposomes. Taking encapsulation rate as index, Box-Behnken response surface methodology was used to optimize the film hydration volume, cholesterol amount and daunorubicin amount in the formulation. The entrapment efficiency of 3 batches of liposomes prepared according to the optimal formulation was determined. The effects of Daunorubicin/dioscin liposomes, GGPFV-modified Daunorubicin/dioscin liposomes and blank liposomes on the survival rate of human breast cancer MDA-MB-435S cells were compared. RESULTS: The optimal formulation was as film hydration volume of 5 mL, cholesterol of 4 mg, yolk lecithin of 22 mg, daunorubicin of 0.55 mg, dioscin of 0.85 mg, DSPE-PEG2000 of 3.5 mg, DSPE-PEG2000-GGPFV of 2 mg. The encapsulation rate of daunorubicin was (96.21±1.54)% and that of dioscin was (95.39±2.48)% in the 3 batches of liposomes prepared. The in vitro cytotoxicity tests showed that the inhibition effect of GGPFV-modified Daunorubicin/dioscin liposome on MDA-MB-435S cells was significantly stronger than that of Daunorubicin/dioscin liposome (P<0.05). There was no cytotoxicity in the membrane. CONCLUSIONS: GGPFV-modified Daunorubicin/dioscin liposomes are successfully prepared, and its inhibitory effect on human breast cancer MDA-MB-435S cells in vitro was significantly enhanced.
KEYWORDS ? Liposome; GGPFV; Daunorubicin; Dioscin; Formulation optimization; Box-Behnken design response surface methodology; Cytotoxicity
柔紅霉素是一種蒽環類抗腫瘤抗生素,易溶于水且水溶液性質穩定,被廣泛用于治療急性白血病、慢性粒細胞性白血病、惡性淋巴瘤、非小細胞肺癌、乳腺癌等[1-2]。柔紅霉素的抗癌機制主要是其經肝臟代謝可生成柔紅霉素醇,后者可通過嵌入癌細胞DNA堿基對來改變DNA拓撲狀態,并可通過抑制DNA聚合酶活性及損傷DNA來影響基因表達,從而達到殺傷腫瘤細胞、治療癌癥的目的[3]。但是,柔紅霉素在臨床上表現出骨髓抑制、心肌損傷、胃腸道刺激、肝腎損傷及局部組織壞死等明顯的毒副作用,故有研究者將其包裹在脂質體內核中,可明顯降低其在機體其余部位的分布,從而起到降低藥物毒性的作用[4]。薯蕷皂苷是一種天然化合物,廣泛存在于薯蕷科、百合科、石竹科等植物中,具有很高的藥用價值,常作為抗腫瘤轉移佐劑應用于癌癥治療研究中[5]。研究表明,薯蕷皂苷可通過誘導阻滯細胞周期S期、通過Caspase途徑誘導癌細胞凋亡、抑制細胞分裂增殖等方式干預癌細胞的生命過程[6-8];同時,其可破壞癌細胞形成的血管生成擬態,抵抗癌細胞侵襲轉移,從而起到抗癌效果[9]。但是,薯蕷皂苷的水溶性差,導致其生物利用度較低,而將其包載在脂質體的磷脂雙分子層中可有效解決這一問題[9]。Gly-Gly-Pro-Phe-Val-Tyr-Leu- Ile (GGPFVYLI,簡稱為“GGPFV”)作為一種穿膜肽,具有水溶性好、可裂解性低、轉運能力高的優點;并且其穿透作用無飽和性,能有效地協助藥物進入細胞,故將其修飾在脂質體表面,可增強脂質體的內化效率,從而更好地發揮藥物療效[10]。
脂質體是以磷脂雙分子層為基本骨架的類細胞膜結構,具有較好的生物相容性。本研究通過薄膜分散法聯合硫酸銨水化法將柔紅霉素包載在脂質體的親水性內核中,將薯蕷皂苷包載在脂質體的疏水性磷脂雙分子層之間,并在脂質體表面修飾GGPFV,制備了GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體,以改善柔紅霉素對機體的毒副作用,并提高薯蕷皂苷的溶解度;同時,采用Box-Behnken響應面法優選了GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體的最佳處方,并通過磺酰羅丹明B(SRB)法考察了所制脂質體制劑對人乳腺癌MDA- MB-435S細胞的毒性作用,旨在初步考察各脂質體對乳腺癌細胞的抑制作用,同時評價GGPFV在脂質體表面修飾的優勢。
1 材料
1.1 儀器
FA1004型電子分析天平(上海越平科學儀器有限公司);DZKW-S-4型電熱恒溫水浴鍋(北京市永光明醫療儀器有限公司);SG3300H型超聲波清洗器(上海冠特超聲儀器有限公司);RE52CS型旋轉蒸發器(上海亞榮生化儀器廠);JY92-2D型超聲波細胞破碎機(寧波新芝生物科技股份有限公司);20AT型高效液相色譜(HPLC)儀(日本Shimadzu公司);葡聚糖凝膠(Sephadex)G50柱(上海華藍化學科技有限公司);TS-1000型搖床振蕩器(江蘇海門市其林貝爾儀器制造有限公司);HBS-1096A型酶標儀(南京德鐵實驗設備有限公司);YA1072型透析袋MD34(8 000~14 000D)(北京索萊寶科技有限公司);85-1型磁力攪拌器(鞏義市予華儀器有限責任公司)。
1.2 藥品與試劑
柔紅霉素對照品(大連美侖生物技術有限公司,批號:28008-55-1,純度:>98%);薯蕷皂苷對照品(成都德銳可生物科技有限公司,批號:19057-60-4,純度:≥98%);蛋黃卵磷脂(EPC,日本NOF公司,純度:>98%);聚乙二醇-二硬脂酰基磷脂酰乙醇胺2000(DSPE-PEG2000,日本NOF公司);膽固醇(批號:F0119A)、SRB(批號:A0702A)均購自大連美侖生物技術有限公司;pH 7.4磷酸緩沖鹽溶液(PBS,北京索萊寶科技有限公司,批號:1022Q021);DSPE-PEG2000-GGPFV由遼寧中醫藥大學藥劑實驗室靶向研究室合成;DMEM培養基、胰蛋白酶、青鏈霉素雙抗、胎牛血清均購自美國Gibco公司;水為娃哈哈牌純凈水,其余試劑均為分析純或色譜純。
1.3 細胞
人乳腺癌MDA-MB-435S細胞購于中國醫學科學院基礎醫學研究所,在含10%胎牛血清和1%青鏈霉素雙抗的DMEM培養基中,于5%CO2、37 ℃條件下培養,備用。
2 方法與結果
2.1 脂質體的制備
通過薄膜分散法和硫酸銨水化法制備GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體。精密稱取膽固醇、EPC、DSPE-PEG2000、DSPE-PEG2000-GGPFV、薯蕷皂苷各適量,以甲醇溶解后置于圓底燒瓶中,超聲(功率:200 W,頻率:40 kHz,下同)混勻,于40 ℃水浴下減壓旋蒸,待圓底燒瓶中形成一層薄膜后向其中加入250 mmol/L的硫酸銨水溶液5 mL,待薄膜溶解完全后將混懸液轉移至10 mL EP管中。將盛有混懸液的EP管置于冰水浴中超聲10 min(超聲間隔5 s,單次超聲時長10 s),以防止因過熱導致脂質體破裂。待超聲結束后,將脂質體混懸液連續2次在0.22 μm聚碳酸酯膜上擠出,以使微粒大小均一化。將擠出后的脂質體裝入透析袋,于500 mL PBS中在磁力攪拌下避光透析24 h,每隔8 h更換1次透析液。精密稱取柔紅霉素對照品適量置圓底燒瓶中,以甲醇溶解,于40 ℃水浴下旋轉蒸發去除溶劑后加入透析后的脂質體混懸液,40 ℃水浴下振搖20 min以包載柔紅霉素,即得GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體。
按上述制備方法,除不加入柔紅霉素和薯蕷皂苷外,其余步驟相同,制備空白脂質體;除不加入DSPE- PEG2000-GGPFV外,其余步驟相同,制備柔紅霉素/薯蕷皂苷脂質體。
2.2 柔紅霉素和薯蕷皂苷的含量測定
采用HPLC法[11-12]測定樣品含量。
2.2.1 柔紅霉素含量測定的色譜條件 色譜柱:Agilent C18(250 mm×4.6 mm,5 ?m);流動相:乙腈-0.02 mol/L磷酸二氫鈉溶液(含0.45% 三乙胺,以磷酸調pH至4)(32 ∶ 68,V/V);柱溫:30 ℃;檢測波長:233 nm;流速:1 mL/min;進樣量:20 μL。
2.2.2 薯蕷皂苷測定的色譜條件 色譜柱:Agilent C18(250 mm×4.6 mm,5 ?m);流動相:乙腈-水(70 ∶ 30,V/V);柱溫:30 ℃;檢測波長:203 nm;流速:1 mL/min;進樣量:20 μL。
2.2.3 溶液的制備 (1)空白溶液:取1 mL空白脂質體與3 mL甲醇混合均勻,超聲破乳,即得。(2)供試品溶液:取1 mL GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體與3 mL甲醇混合均勻,超聲破乳,即得。(3)柔紅霉素對照品溶液:精密稱取10 mg柔紅霉素對照品,以甲醇溶解制成1 mg/mL的柔紅霉素對照品母液;精密吸取該母液20 μL與980 μL甲醇混合均勻,即得20 μg/mL的柔紅霉素對照品溶液。(4)薯蕷皂苷對照品溶液:精密稱取10 mg薯蕷皂苷對照品,以甲醇溶解制成1 mg/mL的薯蕷皂苷對照品母液;精密吸取該母液40 μL與960 μL甲醇混合均勻,即得40 μg/mL的薯蕷皂苷對照品溶液。上述所有溶液均以12 000 r/min離心3 min后取上清液,連續2次以0.45 μm微孔濾膜濾過后使用。
2.2.4 柔紅霉素標準曲線的繪制 取“2.2.3”項下柔紅霉素對照品母液適量,加甲醇稀釋制成柔紅霉素質量濃度分別為240、120、80、40、20、10 μg/mL的系列對照品溶液,按“2.2.1”項下色譜條件進樣測定,記錄色譜圖。以對照品溶液質量濃度為橫坐標(x,μg/mL)、峰面積為縱坐標(y)繪制標準曲線,得回歸方程為y=59.335x-19.145(R2=0.999 0),表明柔紅霉素在10~240 μg/mL質量濃度范圍內與峰面積線性關系良好。
2.2.5 薯蕷皂苷標準曲線的繪制 取“2.2.3”項下薯蕷皂苷對照品母液適量,加甲醇稀釋制成薯蕷皂苷質量濃度分別為240、120、80、40、20、10 μg/mL的系列對照品溶液,按“2.2.2”項下色譜條件進樣測定,記錄色譜圖。以對照品溶液質量濃度為橫坐標(x,μg/mL)、峰面積為縱坐標(y)繪制標準曲線,得回歸方程為y=5.810 9x+14.270(R2=0.999 6),表明薯蕷皂苷在10~240 μg/mL質量濃度范圍內與峰面積線性關系良好。
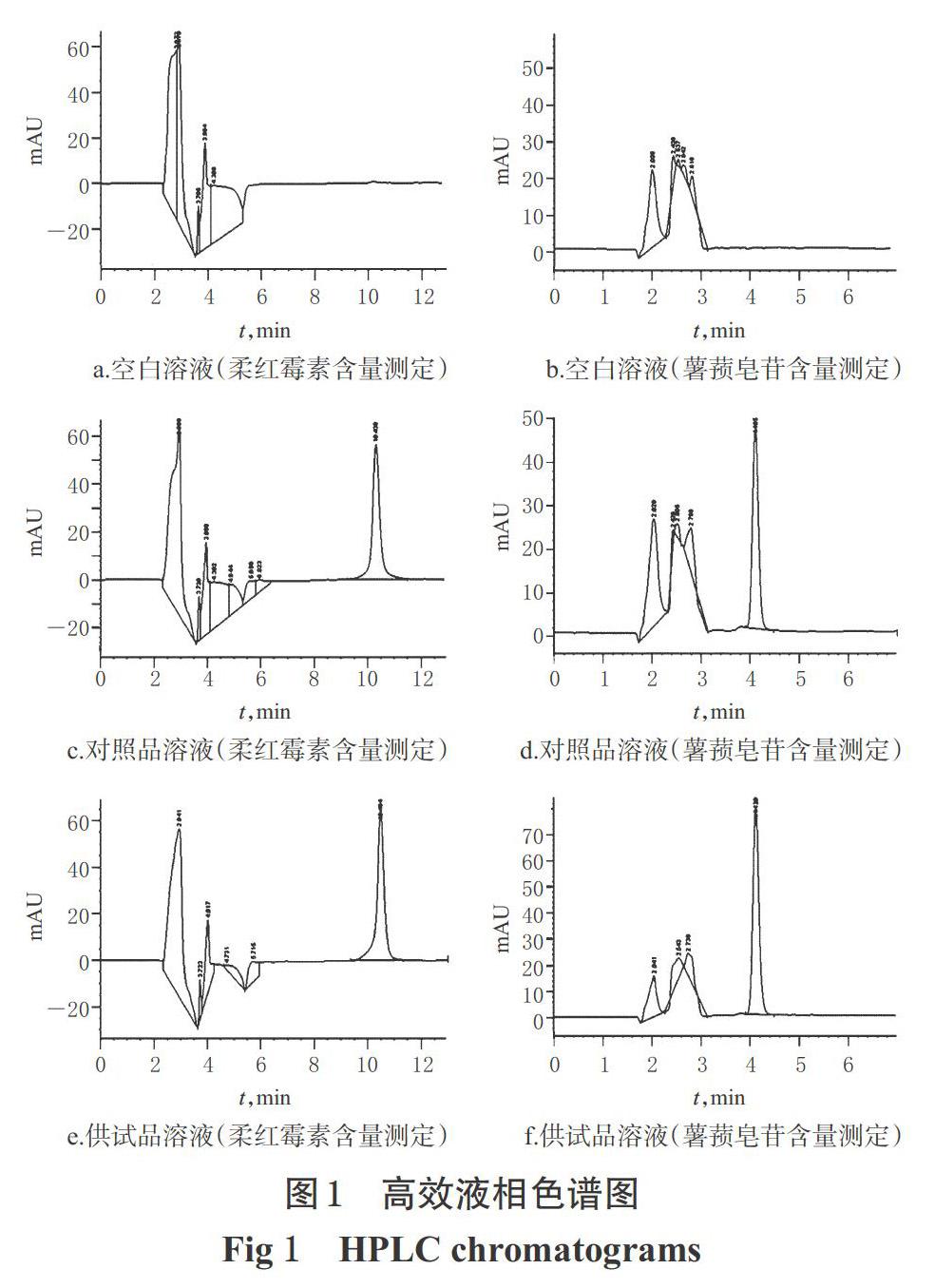
2.2.6 專屬性考察 取“2.2.3”項下空白溶液、供試品溶液、柔紅霉素對照品溶液、薯蕷皂苷對照品溶液各適量,按“2.2.1”“2.2.2”項下色譜條件分別進樣測定,記錄色譜圖,詳見圖1。由圖1可知,柔紅霉素和薯蕷皂苷色譜峰在各自的色譜圖中分離度良好,理論板數分別為31 608(柔紅霉素)和18 635(薯蕷皂苷);空白溶液均不干擾測定。
2.2.7 精密度試驗 取“2.2.3”項下柔紅霉素對照品溶液和薯蕷皂苷對照品溶液,分別按“2.2.1”“2.2.2”項下色譜條件連續進樣測定6次,記錄色譜圖。結果,柔紅霉素和薯蕷皂苷峰面積的RSD分別為1.75%、1.84%(n=6),表明儀器精密度良好。
2.2.8 重復性試驗 取GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體,共6份,分別按“2.2.3”項下方法制備供試品溶液,再按“2.2.1”“2.2.2”項下色譜條件進樣測定,記錄色譜圖,并按標準曲線計算柔紅霉素和薯蕷皂苷的含量。結果,兩者含量的RSD分別為1.55%、0.70%(n=6),表明該方法重復性良好。
2.2.9 穩定性試驗 取“2.2.3”項下供試品溶液,分別于室溫下放置0、2、4、8、12、24 h時,按“2.2.1”“2.2.2”項下色譜條件進樣測定,記錄色譜圖。結果,柔紅霉素和薯蕷皂苷峰面積的RSD分別為1.62%、1.40%(n=6),表明供試品溶液在室溫下放置24 h內穩定性良好。
2.2.10 加樣回收率試驗 按“2.1”項下方法制備GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體,平行制備6份,加入等體積甲醇,稱定質量,超聲破乳,靜置15 min后重新稱定并以甲醇補足減失質量,再以12 000 r/min離心3 min,取上清液,即得破乳液。將已知成分含量的破乳液與相應對照品溶液按1 ∶ 1(m/m)混合均勻,連續2次以0.45 μm微孔濾膜濾過,按“2.2.1”“2.2.2”項下色譜條件進樣測定并計算加樣回收率。結果,柔紅霉素和薯蕷皂苷的平均加樣回收率分別為103.64%、99.83%,RSD分別為0.98%、0.92%(n=6),表明該方法準確度良好。
2.3 GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體包封率的測定
取GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體1 mL,以PBS為洗脫劑,按1 mL/min的流速在Sephadex G50凝膠柱上層析分離,收集乳光部分,以PBS定容至1 mL,取0.5 mL,與0.5 mL甲醇混勻后,超聲破乳并以0.45 μm微孔濾膜濾過,備用。另取GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體0.5 mL,加入0.5 mL甲醇后超聲破乳,并以0.45 μm微孔濾膜濾過后備用。將上述溶液分別按“2.2.1”“2.2.2”項下色譜條件進樣測定,按標準曲線計算柔紅霉素和薯蕷皂苷的含量,并通過以下公式計算包封率:包封率(%)=Wa/Wb[Wa代表柔紅霉素(或薯蕷皂苷)過柱后的含量,Wb代表柔紅霉素(或薯蕷皂苷)過柱前的含量]。
2.4 處方優化
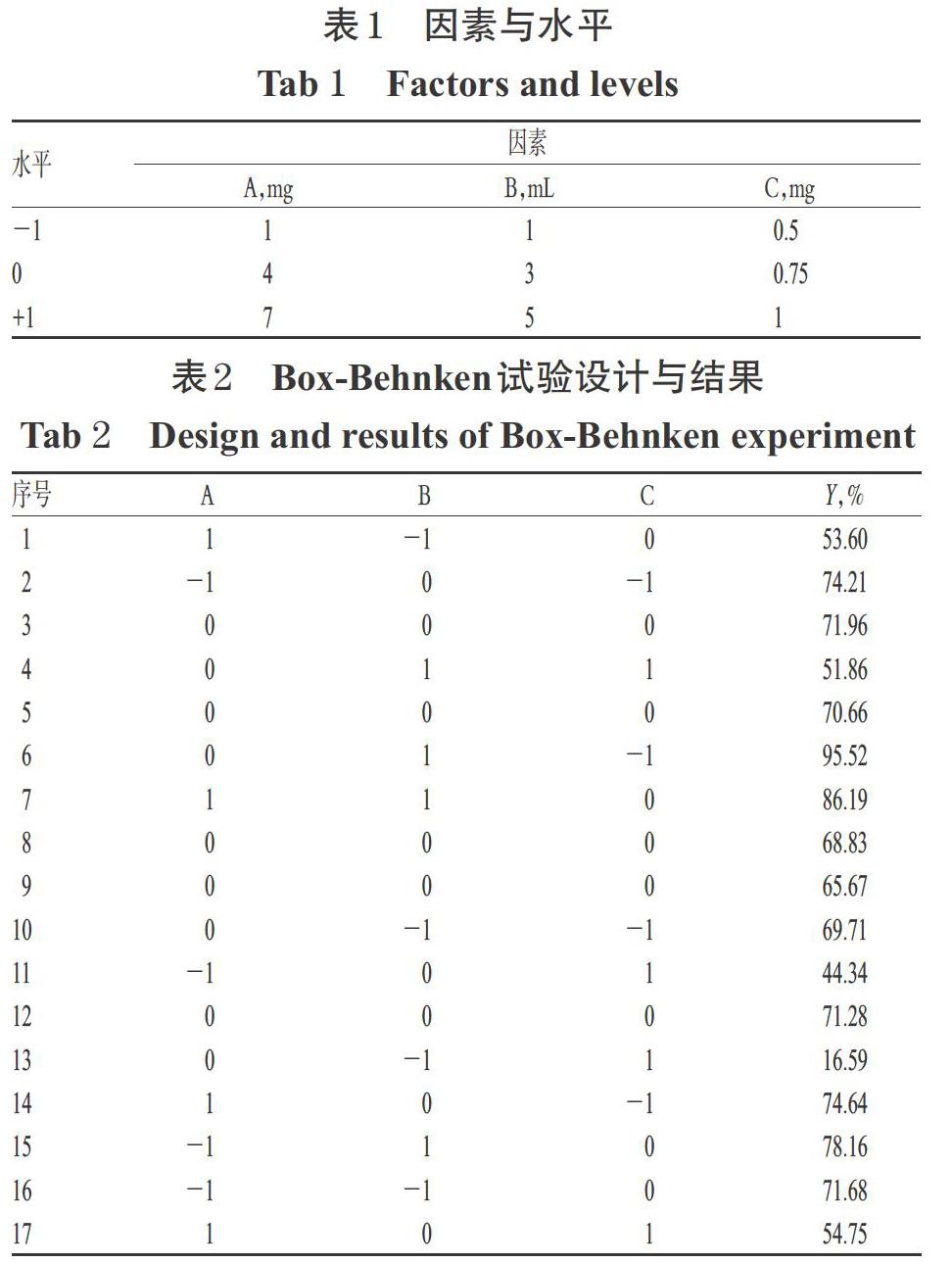
采用Box-Behnken響應面法優化處方。根據本課題組前期研究結果[13]及文獻方法[14],本研究考察了膽固醇用量(A)、水化體積(B)、柔紅霉素用量(C)3個因素對包封率的影響。以包封率加權值(Y)為考察指標,Y=50%×(Y1+Y2),其中Y1表示柔紅霉素的包封率,Y2表示薯蕷皂苷的包封率。固定EPC用量為22 mg、柔紅霉素與薯蕷皂苷的摩爾比為1 ∶ 1,確定各因素的范圍(A:1~7 mg;B:1~5 mL;C:0.5~1 mg),每因素設計3個水平。因素與水平見表1;Box-Behnken試驗設計與結果見表2。
根據表2結果,通過Design Expert 8.0.6軟件得到了Y的擬合方程:Y=46.480 1-8.522 5A-1.011 7B+159.423 3C+1.087 9AB+3.326 7AC+4.730 0BC+0.349 6A2- 0.104 7B2-173.460 0C2(R2=0.918 2,P<0.05)。由此表明,該擬合模型可較好地反映響應值Y的變化,可用于篩選GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體的最佳處方。對上述擬合模型進行方差分析,結果見表3。由表3可知,B、C、AB、BC、B2、C2項對響應值Y具有顯著影響(P<0.05),而A、AC、A2項對其無顯著影響(P>0.05)。固定其中任一因素水平為0,即可生成其余2個因素對包封率影響的等高線圖(圖2)和響應面圖(圖3)。由圖2、圖3可見,在固定磷脂用量、柔紅霉素與薯蕷皂苷摩爾比的情況下,B和C對響應值Y的影響較大,而A對其無顯著影響。
根據本課題組前期研究結果以及上述處方優化結果,將GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體最優處方確定為水化體積5 mL、膽固醇4 mg、EPC 22 mg、柔紅霉素0.55 mg、薯蕷皂苷0.85 mg,DSPE-PEG2000 3.5 mg、DSPE-PEG2000-GGPFV 2 mg。依照該處方平行制備3批GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體,并測定其包封率。結果顯示,柔紅霉素的包封率為(96.21±1.54)%,預測值為98.05%,相對誤差為1.91%;薯蕷皂苷的包封率為(95.39±2.48)%,預測值為82.71%,相對誤差為13.29%。另對按上述方法(不加DSPE- PEG2000-GGPFV)制備的柔紅霉素/薯蕷皂苷脂質體的包封率進行了測定,結果顯示柔紅霉素的包封率為(91.38±2.53)%,薯蕷皂苷的包封率為(92.01±1.86)%,表明GGPFV修飾對兩藥的包封率無明顯影響。
2.5 不同脂質體制劑對人乳腺癌MDA-MB-435S細胞的抑制作用
采用SRB法[15]測定空白脂質體、柔紅霉素/薯蕷皂苷脂質體、GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體的細胞毒性。將對數生長期的人乳腺癌MDA-MB-435S細胞鋪在96孔板上,鋪板密度為1.7×104個/孔,于37 ℃、5% CO2條件下培養,待其長滿單層后,分別向孔中加入以上3種脂質體制劑。將脂質體中柔紅霉素的濃度梯度調整為0.5、1、2、4、6、8、10 μmol/L,以DMEM培養基為空白對照,每個濃度設置4個復孔,給藥后繼續培養48 h。吸棄培養液,將細胞在4 ℃的10%三氯乙酸溶液中固定1 h,棄去固定液并用水洗板5次;晾干,以SRB試劑染色30 min,1%冰醋酸溶液洗板5次以清除多余SRB;晾干,每孔加入200 μL Tris堿溶液,于搖床振蕩器振蕩30 min后,用酶標儀于540 nm波長下測定光密度(OD)值,計算細胞存活率[細胞存活率(%)=藥物組OD值/空白對照組OD值×100%]并繪制存活率曲線,詳見圖4。
由圖4可知,空白脂質體對人乳腺癌MDA-MB- 435S細胞幾乎沒有細胞毒性,而柔紅霉素/薯蕷皂苷脂質體和GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體可使MDA-MB-435S細胞存活率降低,表現出一定細胞毒性。經Graphpad Prism 7.0軟件計算可得兩種含藥脂質體的半數抑制濃度(IC50)分別為(8.87±0.12)、(5.53±0.09) μmol/L。利用SPSS 17.0軟件對本實驗結果進行單因素方差分析,可得不同脂質體對MDA-MB-435S細胞的抑制作用大小排序:GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體>柔紅霉素/薯蕷皂苷脂質體>空白脂質體,組間比較差異有統計學意義(P<0.05)。結果表明,該脂質體的膜材對細胞無毒性,且GGPFV的修飾增強了含藥脂質體對人乳腺癌MDA- MB-435S細胞的抑制作用。
3 討論
柔紅霉素作為一種臨床常用的抗腫瘤藥,因其靶向性較低,導致對機體會產生毒副作用[16-17];薯蕷皂苷可通過多通路、多靶點、多途徑誘導腫瘤細胞凋亡、抑制腫瘤細胞增殖及侵襲轉移,然而其疏水性限制了其臨床應用[18]。將柔紅霉素和薯蕷皂苷同時包載到脂質體中的制劑策略可顯著彌補兩藥在應用中的不足(柔紅霉素被包載于脂質體的親水性內核,薯蕷皂苷被包載于疏水性的磷脂雙分子層之間)。脂質體具有可穿過腫瘤區域微血管內皮間隙的理想粒徑(20~200 nm),可通過高滲透長滯留(EPR)效應進入腫瘤組織,使藥物盡可能多地分布在腫瘤區域[19];GGPFV作為一種高效新型穿膜肽,可攜帶藥物或藥物載體通過胞吞作用進入癌細胞[14]。本研究通過薄膜分散法和硫酸銨水合法制備GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體,將GGPFV修飾在脂質體表面,可增加癌細胞對藥物的攝入量,增強抗癌效果。同時,通過人乳腺癌MDA-MB-435S細胞體外抑制試驗證實,GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體的細胞抑制作用強于未加GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體。
近年來,研究者多以正交設計方法優化藥物脂質體制劑處方及制備工藝,方法雖簡單,但是優選結果不會超越所取水平的范圍,不能給深入優化研究提供明確的指向性。而Box-Behnken響應面法具有試驗設計水平數偏少、預測準確、更具經濟性的優勢[20-21],因而本研究采用該方法優化GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體處方。結果表明,GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體的最優處方為:水化體積5 mL、膽固醇 4 mg、EPC 22 mg、柔紅霉素0.55 mg、薯蕷皂苷0.85 mg、DSPE- PEG2000 3.5 mg、DSPE-PEG2000-GGPFV 2 mg。按照最優處方平行制備了3批樣品并測定其包封率,結果均符合2015年版《中國藥典》(四部)要求[22]。
綜上所述,本研究篩選了GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體的最優處方,測定了所得脂質體中柔紅霉素和薯蕷皂苷的藥物含量,并比較了空白脂質體、柔紅霉素/薯蕷皂苷脂質體、GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體對人乳腺癌MDA-MB-435S細胞的毒性,確定了GGPFV修飾的柔紅霉素/薯蕷皂苷脂質體可應用于進一步的抗乳腺癌研究。
參考文獻
[ 1 ] 林鵬.不同蒽環類藥物為基礎的誘導方案治療成人初治急性髓系白血病的療效觀察[D].石家莊:河北醫科大學,2016.
[ 2 ] JU RJ,CHENG L,PENG XM,et al. Octreotide-modified liposomes containing daunorubicin and dihydroartemi- sinin for treatment of invasive breast cancer[J]. Artificial Cells,2018,46(Suppl 1):1-13.
[ 3 ] 李丁. NF-κB/LncRNA-uc002jit.1/PARP1形成環路調節柔紅霉素誘導的急性髓系白血病細胞DNA損傷修復[D].福州:福建醫科大學,2019.
[ 4 ] LIU XL,HAN MT,XU JW,et al. Asialoglycoprotein receptor-targeted liposomes loaded with a norcantharimide derivative for hepatocyte-selective targeting[J]. Int J Pharm,2017,520(1/2):98-110.
[ 5 ] 宋正偉,張奇能.薯蕷皂苷下調ABCC1表達對人肝癌細胞HepG2/ADM耐藥的影響[J].中國藥師,2020,23(1):34-39.
[ 6 ] ZHAO XW,TAOXF,XU LN,et al. Dioscin induces apoptosis in human cervical carcinoma HeLa and SiHa cells through ROS-mediated DNA damage and the mitochon- drial signaling pathway[J]. Molecules,2016. DOI:10. 3390/molecules21060730.
[ 7 ] DING QY,ZHANG WD,CHENG C,et al. Dioscin inhi- bits the growth of human osteosarcoma by inducing ? ? ? G2/M-phase arrest,apoptosis,and GSDME-dependent cell death in vitro and in vivo[J]. J Cell Physiol,2020,235(3):2911-2924.
[ 8 ] ZHANG YS,MA YL,THAKUR K,et al. Molecular me- chanism and inhibitory targets of dioscin in HepG2 cells[J]. Food ChemToxicol,2018. DOI:10.1016/j.fct. 2018.07.016.
[ 9 ] KONG L,CAI FY,YAO XM,et al. RPV-modified epirubicin and dioscin co-delivery liposomes suppress non- small cell lung cancer growth by limiting nutrition supply[J]. Cancer Sci,2020,111(2):621-636.
[10] R?DIS-BAPTISTA G,CAMPELO IS,MORLIGHEM JRL,et al. Cell-penetrating peptides (CPPs):from delivery of nucleic acids and antigens to transduction of engineered nucleases for application in transgenesis[J]. J Biotechnol,2017. DOI:10.1016/j.jbiotec.2017.05. 002.
[11] 黃周鋒,胡筱希,黃建猷,等. Box-Behnken設計-響應面法優化小槐花中檸檬酚的超聲輔助乙醇-硫酸銨雙水相提取工藝[J].中國藥房,2020,31(9):1085-1090.
[12] WANG YY,FU M,LIU JJ,et al. Inhibition of tumor metastasis by targeted daunorubicin and dioscincodelivery liposomes modified with PFV for the treatment of non-small-cell lung cancer[J]. Int J Nanomedicine,2019,DOI:10.2147/IJN.S194304.
[13] YAO XM,NIU FJ,KONG L,et al. GGP modified daunorubicin plus dioscin liposomes inhibit breast cancer by suppressing epithelial-mesenchymal transition[J]. Drug Dev Ind Pharm,2020,46(6):916-930.
[14] 高菲,劉莉.酒石酸長春瑞濱殼聚糖納米粒的制備及質量評價[J].西北藥學雜志,2019,34(2):217-222.
[15] LIU JJ,TANG W,FU M,et al. Development of R8 modified epirubicin-dihydroartemisinin liposomes for treatment of non-small-cell lung cancer[J]. Artif Cells Nanomed Biotechnol,2019,47(1):1947-1960.
[16] 康瑜,謝紅軍. OCT修飾柔紅霉素與雙氫青蒿素脂質體的處方優選及主藥含量測定[J].西藏醫藥,2019,40(4):19-22.
[17] 張紅. pH敏感羧甲基殼聚糖-柔紅霉素納米載藥系統的構建與評價[D].武漢:武漢理工大學,2016.
[18] GUO XQ,DING X. Dioscin suppresses the viability of ovarian cancer cells by regulating the VEGFR2 and PI3K/AKT/MAPK signaling pathways[J]. Oncol Lett,2018,15(6) :9537-9542.
[19] 王海軍.仿生響應性納米載藥體系用于腫瘤精準診療研究[D].上海:東華大學,2020.
[20] 許天陽,董坤園,宋鳳媛,等. Box-Behnken響應面法優化炒赤芍炮制工藝[J].中國藥房,2019,30(20):2845-2850.
[21] 劉聰,梁廣裕,周韻秋,等.白藜蘆醇聚合物膠束制備工藝的Box-Behnken設計-響應面法優化[J].時珍國醫國藥,2020,31(4):856-859.
[22] 國家藥典委員會.中華人民共和國藥典:四部[S]. 2015年版.北京:中國醫藥科技出版社,2015:371-374.
(收稿日期:2020-02-17 修回日期:2020-09-21)
(編輯:胡曉霖)

