可注射磁性液固相變材料用于骨肉瘤的磁共振成像與低溫磁熱治療研究
徐 東,朱鈺方,鄭元義,羅 宇,陳航榕
(1. 上海理工大學 材料科學與工程學院,上海 200093; 2. 中國科學院 上海硅酸鹽研究所,上海 200050; 3. 上海交通大學附屬第六人民醫院 上海超聲醫學研究所,上海 200233; 4. 同濟大學 化學科學與工程學院,上海 200092)
骨肉瘤是一種常見的惡性腫瘤,起源于骨,主要發生在兒童和青少年時期。它常在股骨遠端和脛骨近端發芽,并容易轉移到肺。目前臨床上對骨肉瘤的治療主要采取手術切除或者截肢方式[1]。手術切除雖然可以去除腫瘤病灶,但是難清除由于骨肉瘤浸潤生長殘留的腫瘤細胞,往往術后一定時間復發[2]。此外,截肢雖然在某種程度上更為徹底清除原發病灶,但是由于骨肉瘤的高轉移性,在截肢前腫瘤已轉移到其他臟器,截肢意義不大,同時截肢后病人往往失去勞動能力,給病人后期回歸生活造成了巨大障礙[3]。現今,雖然可以采用保守的化學治療,但是其全身性毒副作用以及較低的抗腫瘤效率也難以滿足治愈骨肉瘤的需求。由此可見,研發一種更為安全高效的骨肉瘤治療藥物或者技術迫在眉睫。
熱療作為一種新型的高效治療技術正在被越來越多的科研人員所關注,主要分為光熱治療和磁熱治療[4]。光熱治療受限于激光的穿透深度,且存在光熱性能衰減的問題[5],限制了其在臨床上的應用。磁熱治療因其無穿透深度限制、非侵入性等特點[6-8],在腫瘤的深部治療方面具有獨特的作用。前期的研究,幾乎都采用過高溫(>50 ℃)的磁熱消融方式殺死腫瘤細胞[9-10],然而過高溫度會對瘤周正常組織產生熱輻射,從而破壞正常組織使其喪失生物學功能。因此,如何實現在較低磁熱溫度(正常組織細胞能耐受的溫度約為43 ℃)下高效殺死腫瘤細胞成為急需解決的問題[11]。據報道利用低熱可誘導腫瘤細胞程序性凋亡,但是,由于腫瘤細胞在低于45 ℃刺激下會誘發應急反應產生大量的熱休克蛋白(HSP90)抑制細胞凋亡,削弱低熱對腫瘤細胞的殺傷能力,療效并不理想[12-14]。
圍繞骨肉瘤的低溫、高效磁熱治療這一研究目標,借鑒臨床治療脊柱壓縮性骨折時可注射骨水泥液固相變原理[15],我們研發了一種可注射的液固相變磁熱材料,通過微創的方式將材料注入腫瘤組織,液態材料在接觸腫瘤之后迅速轉化為固態磁性復合材料。在外加脈沖磁場刺激下,局部產生熱殺死腫瘤細胞。此外,利用表沒食子兒茶素沒食子酸酯(EGCG)抑制腫瘤細胞在低溫刺激下產生大量的熱休克蛋白(HSP90)的活性,有效提高了低溫磁熱下對骨腫瘤細胞的殺傷力,避免了高溫對瘤周正常組織的熱輻射損傷。
1 實驗方法
1.1 Fe3O4@PEI的制備
將FeCl3·6H2O的水溶液(1.3 g,20 mL)放入200 mL的三頸燒瓶中,通入高純氮氣30 min以上去除水中溶解氧,在氮氣氛圍下持續攪拌15 min。將Na2SO3水溶液(0.2 g,10 mL)滴加到上述溶液中,在氮氣氛圍下持續攪拌30 min后,將超支化的聚乙烯亞胺(PEI.NH2) (0.5 g,5 mL)和氨水(2 mL)依次加入上述混合物溶液中。撤去氮氣保護,將混合物溶液在60~70 ℃下攪拌30 min,冷卻至室溫后繼續攪拌1.5 h,采用磁分離方式收集、洗滌黑色產物Fe3O4@PEI納米顆粒,重復洗滌三次以上。最后,將Fe3O4@PEI分散在超純水中4 ℃保存備用。
1.2 PLGA/Fe3O4及PLGA/Fe3O4/EGCG的制備
首先稱量聚乳酸-羥基乙酸(PLGA)(1 g)溶于1 mL N-甲基吡咯烷酮(NMP),然后放入37 ℃的干燥箱中過夜。采用磁分離方式用二甲亞砜(DMSO)洗滌Fe3O4@PEI納米顆粒,最后將含Fe 100 mg 的納米顆粒分散在2 mL的DMSO中,并通過磁力攪拌方式將其分散到的PLGA溶液中形成PLGA/Fe3O4的共混液。然后將小分子抑制劑EGCG分散在PLGA/Fe3O4混合溶液中形成PLGA/Fe3O4/EGCG的混合溶液,PLGA/Fe3O4(PF),PLGA/Fe3O4/EGCG(PFE)復合材料可在水溶液中液固相變之后得到。
1.3 磁熱性能測試
將不同Fe濃度(0.45、0.9、1.8、3.6 mg/mL)的溶液1.5 mL置于2 mL離心管中,將其放在交變電流頻率為550 kHz,輸出功率恒定為7 kWh、線圈大小為10 cm的磁場下,利用Fotric-225熱紅外相機監測材料的升溫曲線。
1.4 r2弛豫率測試及T2加權磁共振(MR)成像
用0.5%瓊脂糖溶液稀釋Fe3O4溶液配置一系列Fe濃度梯度(0.8、0.4、0.2、0.1、0.05和0.025 mmol/L)樣品,冷卻至室溫后,測不同Fe濃度樣品的T2弛豫時間,計算出r2弛豫率[16]。
用臨床使用的3.0 T磁共振成像儀評估上述樣品T2加權MR成像性能(TR=4313.7,TE=99.6)。另外將PLGA/Fe3O4配制成不同Fe濃度的溶液,分別取50 μL注射到去離子水中使其液固相變,考察液固相變之后的復合材料在3.0 T磁共振成像儀中T2加權MR成像[17]。
1.5 細胞毒性測試
將一定體積的PLGA、PF、PFE注射到2 mL超純水中,得到PLGA相變體及PF、PFE復合材料,將得到的三組材料放置水中過夜以充分排盡NMP。將材料轉移至完全培養基中使材料的質量濃度為0.1 g/mL,浸泡24 h后棄去材料,將浸提液用新鮮培養基稀釋成不同濃度(不同百分含量的浸提液)。將骨肉瘤MG-63細胞以104個細胞/孔的密度種植在96孔板中,貼壁過夜,然后將稀釋后的復合材料浸提液100 μL與細胞在37 ℃、5vol% CO2的環境下共培養24 h,棄掉培養基,90 μL無血清培養基+10 μL細胞活力檢測試劑CCK-8共培養2~4 h后用酶標儀測定430 nm波長吸收值。
1.6 體外細胞低熱治療
將骨肉瘤MG-63細胞以5×104個細胞/孔密度種植在24孔板中,在37 ℃、5vol% CO2的濕潤氣氛中貼壁培養24 h。分別加入50 μL PLAG、PF、PFE液體形成的PLGA相變體及PF、PFE復合材料分別共培養12 h后,利用電流頻率為550 kHz,輸出功率恒定為7 kW,線圈大小為10 cm的磁場升溫(SPG400KZ高頻感應加熱器),利用熱紅外相機將監測溫度控制在43 ℃ 40 min,棄掉三組材料再培養24 h后,再棄掉培養基,90 μL無血清培養基+10 μL CCK-8試劑共培養2~4 h,用酶標儀測定430 nm波長吸收值。
2 結果與討論
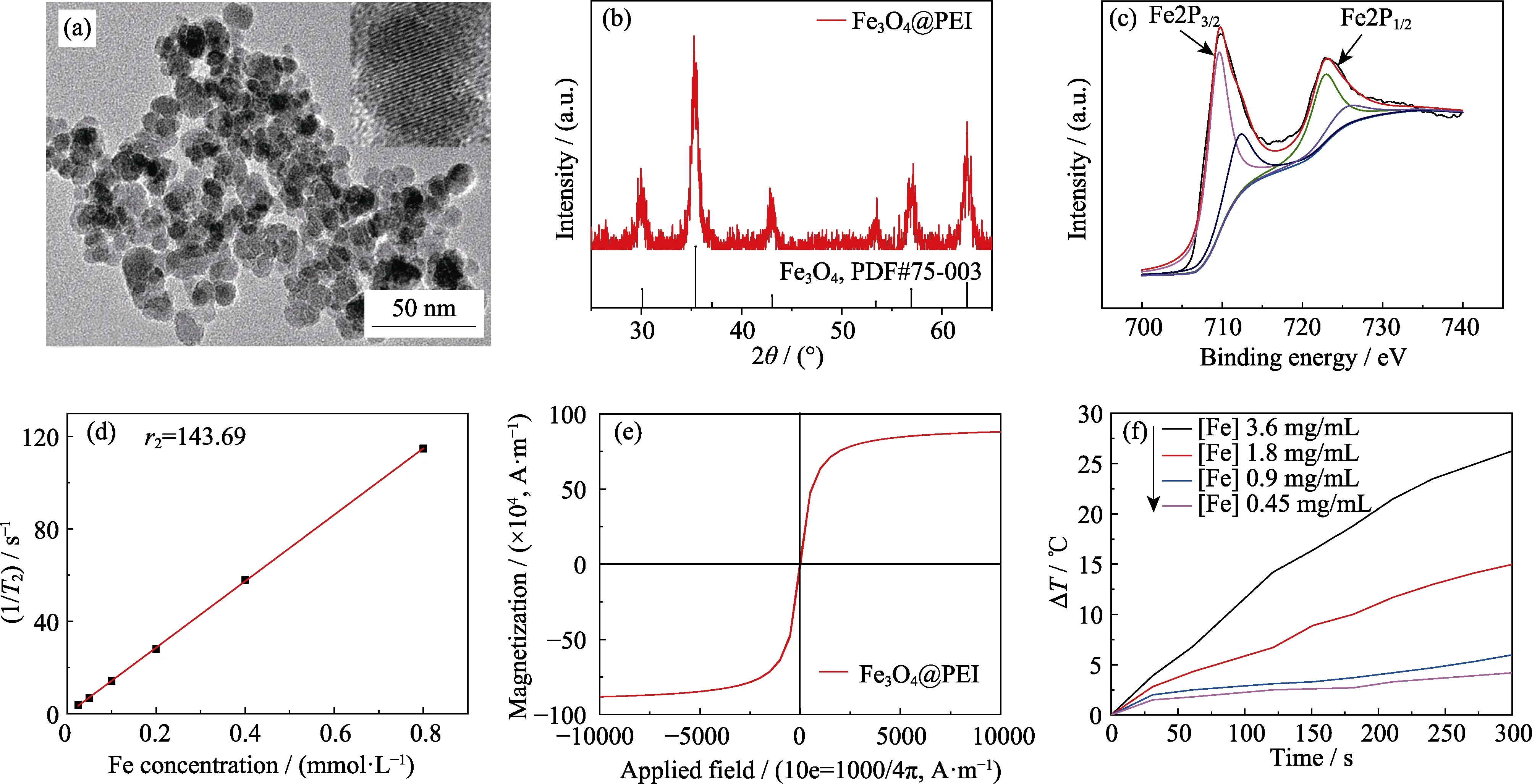
圖1 超順磁性Fe3O4納米顆粒的透射電鏡照片(a)、X射線衍射圖譜(b)、X射線光電子圖譜(c)、r2弛豫率(d)、飽和磁化強度(e)以及在交變磁場中不同Fe濃度的升溫曲線(f)Fig. 1 TEM images of superparamagnetic Fe3O4 nanoparticles (a),XRD patterns (b),XPS spectra (c),r2 relaxation rate (d),saturation magnetization (e),and temperature rise curves of different Fe concentrations in an alternating magnetic field (f)
采用溫和還原法[17-19]合成了超順磁性氧化鐵納米顆粒(SPION),如圖1(a)所示,制備得到的納米顆粒呈準球形,直徑約為15 nm。XRD分析顯示納米顆粒晶體結構的三強峰(2θ=35.422°、56.942°、62.515°)與標準卡片PDF#75-003較好對應,表明合成樣品物相組成為Fe3O4(圖1(b))。為了驗證樣品中Fe2+與Fe3+的相對比值,采用X射線光電子能譜(XPS)對樣品進行測試,從圖1(c)可看到兩個明顯的Fe2P3/2(709.78 eV)和Fe2P1/2(722.88 eV)特征峰,經過擬合計算得到樣品中的Fe2+:Fe3+= 33.2 :66.8 ≈1 :2,進一步證實了制備得到的氧化鐵納米顆粒為Fe3O4。磁性能測試表明所合成的氧化鐵納米顆粒飽和磁化強度為8.96×104A·m-1(圖1(e)),與文獻報道的超順磁性Fe3O4飽和磁化強度基本一致[20],表明制備得到納米顆粒具有潛在的MR成像性能。弛豫率是衡量納米顆粒MR成像性能的重要指標之一,通過測定材料的馳豫時間,經擬合后計算得到Fe3O4的r2值為143.69 mmol·L-1·s-1(如圖1(d)),表明制備得到的納米顆粒具有較高的T2加權MR成像性能。隨后在交變磁場頻率為550 kHz、輸出功率恒定為 7 kW、線圈大小為10 cm的條件下[21]測定制備得到的磁性氧化鐵納米顆粒的磁熱升溫曲線如圖1(f)所示,隨著Fe濃度的升高,納米顆粒升溫能力逐漸增強,呈濃度依賴性。當Fe濃度為3.6 mg/mL時,5 min內材料溫度增加26.3 ℃,可滿足體外細胞實驗及活體動物實驗磁熱升溫需求。
如圖2(a,b)所示裝載有Fe3O4納米粒子的PLGA/Fe3O4復合物(PF)在未與水相接觸之前,呈可注射的粘稠流動液體,可用1 mL注射器吸取,為其體內腫瘤磁熱治療提供了可能。將流動的PF注入水中后,可快速發生液固相變形成PF復合材料(如圖2(c)所示),表明在進行腫瘤內注射后,PF可以錨定在腫瘤部位,發揮被動靶向功能。

圖2 Fe3O4分散到PLGA液體中得到均勻流體的數碼照片(a),用1 mL注射器吸取PLGA/ Fe3O4流體數碼照片(b),用注射器將PLGA/Fe3O4流體打入水中液固相變數碼照片(c)Fig. 2 Digital photo of Fe3O4 dispersed in PLGA liquid to obtain a homogeneous fluid (a); Digital photo of PLGA / Fe3O4 fluid sucked with a 1 mL syringe (b); Digital photo of liquid-solid phase transition of PLGA / Fe3O4 fluid driven into water with a syringe (c)
通過掃描電鏡對PF復合物在發生液固相變之后所形成的PF復合材料表面形貌進行觀察,結果顯示在液固相變之后形成的復合材料具有多孔表面且粗糙褶皺的結構(如圖3(a)所示),這樣的結構有利于小分子藥物的釋放,為后續HSP90小分子抑制劑的裝載提供了可能。此外,通過能量色散X射線光譜(EDX)測試發現有Fe元素存在,并且分散均勻,表明Fe3O4成功地均勻分散到PLGA流體中(圖3(b,c))。

圖3 PLGA/Fe3O4(PF)復合材料的SEM照片(a)及其對應能量色散X射線光譜(b),以及不同元素分布掃描(c)Fig. 3 SEM image of PLGA/Fe3O4 (PF) composite (a),with its corresponding EDX spectrum (b),and different elements mapping (c)
為了控制復合材料的磁熱升溫幅度,對材料體系的體積/含鐵量進行了優化,最終確定比例為注射體積50 μL、Fe含量為10%。對優化后的PF復合材料在不同介質(空氣和水)中磁熱升溫性能進行了研究。如圖4(a)所示,50 μL、Fe含量為10%的PF在交變磁場作用下,5 min內在水中和空氣中溫度上升量分別為11 ℃和21.3 ℃,滿足體外細胞實驗以及活體動物實驗需求。不同鐵含量PF復合材料的T2加權MR成像性能表征結果顯示(圖4(b))隨著Fe濃度的增加,PF復合材料的MR信號逐漸衰減,呈現濃度依賴性,表明PF具有良好的T2加權MR成像潛能[22]。采用浸提液共培養方法評估了PF復合材料的細胞毒性(圖4(c)),結果顯示當復合材料在培養基中濃度為0~80 mg/mL范圍內時,骨肉瘤MG-63細胞存活率均保持在90%以上(圖4(c)),表明體外細胞治療實驗所用PF復合材料(50 μL,液固相變之后濃度為59.45 mg/mL)具有良好的細胞相容性。評估HSP90小分子抑制劑EGCG的細胞相容性,以支撐后續的體外細胞治療實驗。采用培養箱升溫模擬磁熱升溫[23],研究發現43 ℃低溫處理骨肉瘤MG-63細胞40 min后,骨肉瘤MG-63細胞的存活率隨小分子抑制劑EGCE濃度增加而顯著降低,當EGCE濃度為200 μg/mL時,37 ℃正常培養組骨肉瘤MG-63細胞存活率為84%,而低熱43 ℃治療組的細胞存活率僅有24%,結果證實小分子抑制劑能有效地抑制了熱休克蛋白(HSP90)活性,削弱了HSP90對骨肉瘤細胞的保護作用實現了在低溫下殺死骨肉瘤的研究目的(圖4(d))。
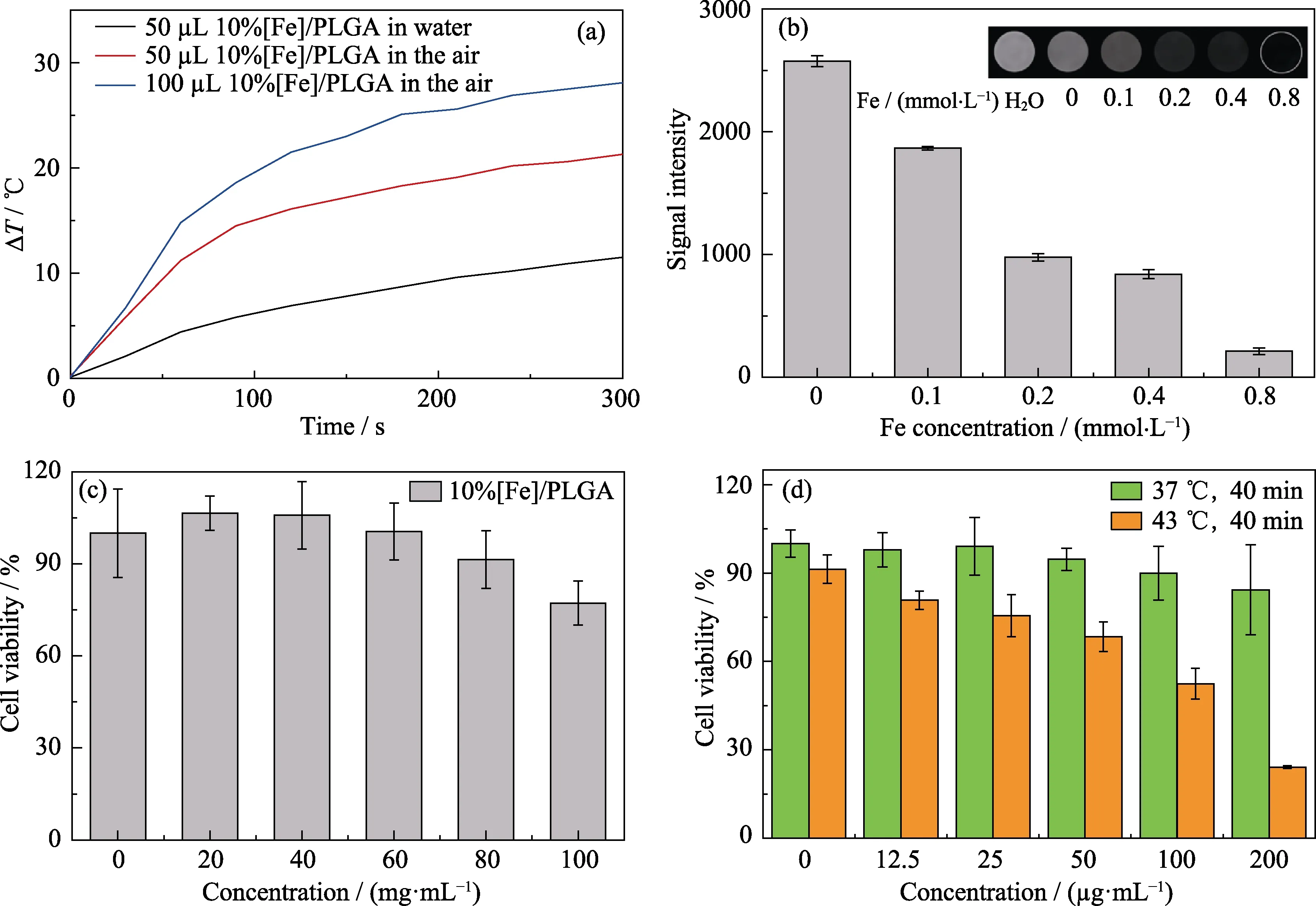
圖4 PLGA/Fe3O4復合物(PF)在交變磁場中的升溫(a)、細胞毒性(b)及體外T2加權MR成像(c),以及在模擬磁熱升溫(43 ℃)下抑制劑EGCG的細胞相容性(d)Fig. 4 Temperature rise of PLGA/Fe3O4 composite (PF) in AMF (a),cytotoxicity (b) and in vitro T2-weighted MR imaging (c),and the cytocompatibility of the inhibitor EGCG under simulated magnetocalormic temperature rise (43 ℃,d)
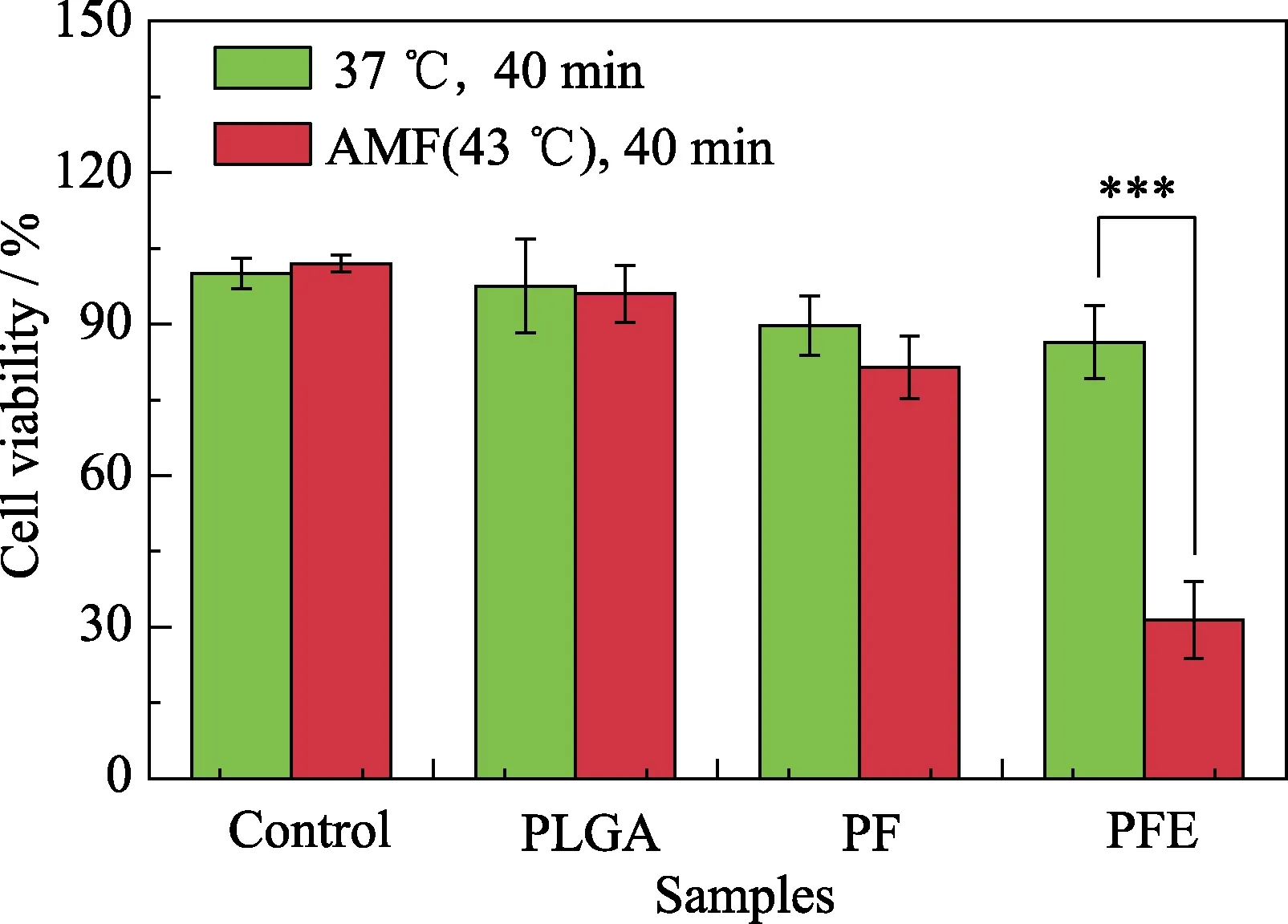
為了評估PFE復合材料對骨肉瘤的治療效果,將PLGA、PF、PFE三組材料與骨肉瘤細胞共培養后的24孔細胞板置于電流頻率為550 kHz、輸出功率恒定為7 kW、線圈大小為10 cm的磁場中,通過控制交變磁場的工作時間,利用紅外相機監控溫度。在AMF下(圖5),對照組與PLGA組都未升溫,且骨肉瘤細胞MG-63的存活率都在95%以上,表明磁場對腫瘤細胞無損傷作用。而PF、PFE復合材料組都可在AFM下升溫。利用熱紅外相機監測并控制溫度在43 ℃,保持40 min,實驗結果表明,PF組低溫磁熱處理前后骨肉瘤細胞都具有高于80%的存活率,這是由于熱休克蛋白HSP90在低熱刺激下的大量表達啟動熱應激保護[24],造成低熱(43 ℃)下不能有效殺死腫瘤細胞。值得注意的是,PFE組低溫磁熱處理后骨肉瘤細胞31%的存活率大大低于未低溫磁熱處理81%的存活率,表明HSP90小分子抑制劑ECGG可以有效地抑制HSP90的活性,使得骨肉瘤細胞在較低的溫度下就能被高效殺死,從而有望實現在低溫下治療腫瘤的目的,為后續的動物活體實驗提供支撐。
3 結論
本研究通過簡易方法制備出基于PLGA液固相變的可注射磁性材料。其中超順磁性氧化鐵納米顆粒Fe3O4實現腫瘤T2加權MR成像的同時在交變磁場激發下可以發生磁熱轉化,從而實施腫瘤的磁熱治療。此外,利用小分子抑制劑有效抑制熱休克蛋白HSP90活性,削弱腫瘤細胞的熱應激保護機制,可實現低溫(43 ℃)磁熱殺死骨肉瘤細胞,有望克服高溫磁熱對瘤周正常組織存在熱輻射損傷的不足,為深部腫瘤的磁熱治療提供新的方法和材料支撐。

