白藜蘆醇激活Notch1/Hes1信號減輕大鼠川崎病誘發心肌損傷的機制
熊鳳梅,孔令恒,孫 娜,丁 輝,石曌玲
川崎病(Kawasaki disease, KD),又被稱為皮膚黏膜淋巴結綜合征,是一種常見于5歲以下嬰幼兒,以全身非特異性中、小動脈血管炎性反應為主要病理特點的急性發熱性、出疹性疾病,病因不明,易侵害冠狀動脈進而引起冠狀動脈擴張和冠狀動脈瘤,嚴重危害患兒的心臟功能[1-3]。流行病學結果顯示,KD發病率逐年升高,并且已經取代風濕熱成為嬰幼兒獲得性心臟病的主要原因之一[4]。部分KD患兒還會出現血栓栓塞、心肌炎或心肌梗死[5,6],加之KD繼發的心肌損傷的病因和具體機制未完全闡明,這使得臨床上至今還未有針對KD誘發心肌損傷的有效治療方法。因此,有必要探討KD誘發心肌損傷的機制并尋找有效的治療藥物和潛在的治療靶點,為臨床上治療KD心肌損傷提供理論依據。
白藜蘆醇(resveratrol, Res)是一種存在于葡萄、桑葚、花生和多種中藥材中的多酚類化合物,化學結構式為3,5,4′-三羥基二苯乙烯,由于其具有明顯的抗腫瘤、抑制炎性反應、抗動脈粥樣硬化等生物學活性及心血管保護作用,受到了廣泛關注[7-10]。Notch信號通路是一類進化高度保守的跨膜受體家族,由配體、受體和下游分子組成,在胚胎期和成年后細胞穩態以及組織損傷修復中發揮重要作用,該通路的活化還參與炎性反應和氧化應激過程[11-13]。有研究表明,Notch1可減輕心肌缺血損傷,改善心肌梗死后心臟功能,并在梗死區修復中發揮重要作用[14]。然而Notch信號通路是否在KD誘發的心肌損傷中有變化,是否介導Res改善KD誘發心肌損傷的作用還不清楚。因此,本研究擬采用幼年雄性SD大鼠KD模型,即腹腔注射干酪乳酸桿菌胞壁成分(lactobacillus casei cell wall extract, LCWE)制備KD,并探討Res對KD誘發心肌損傷的保護作用以及對Notch信號通路的調控,為闡明KD誘發心肌損傷的機制提供新的實驗依據。
1 材料和方法
1.1 材料 幼年雄性SD大鼠(4周齡)48只,體重80~100 g,購買于西安交通大學醫學院實驗動物中心。Bax、Bcl2、Notch1和Hes1抗體均購買于Cell Signaling Technology公司,GAPDH購于谷歌生物科技有限公司(武漢);TNF-α和IL-1β含量檢測試劑盒購買于碧云天生物技術公司;RIPA裂解液購于碧云天生物技術有限公司(上海);蛋白酶抑制劑購買于Roche公司;BCA蛋白定量試劑盒購于Thermo Fisher公司;Res購于Sigma公司(上海);干酪乳酸桿菌(Lactobacillus case)購于工業微生物菌種保藏中心;乳酸桿菌肉湯培養基和鼠李糖定量試劑盒購于上海廣銳生物科技有限公司。
1.2 制備KD模型 首先培養干酪乳酸桿菌,采用文獻[15]報道的方法:將購買的干酪乳酸桿菌菌種接種于肉湯培養基中,并在37 ℃厭氧環境中培養2 d;將培養基以5000 g離心20 min,棄上清,沉淀中加入40 g/L SDS過夜以充分裂解。以5000 g離心裂解液30 min,PBS洗滌后,加入RNA酶(250 μg/ml)混勻,37 ℃孵育4 h,離心棄上清,重復3次。再加入DNA酶(250 μg/ml)混勻,37 ℃孵育4 h,離心棄上清,重復3次。最后沉淀中加入胰蛋白酶(250 μg/ml),37 ℃孵育4 h,離心棄上清,重復3次。用PBS將沉淀重懸,超聲破碎儀冰上破碎2 h,低溫高速離心機4 ℃ 12 000 g離心1 h,上清即為LCWE。采用比色法定量,并將LCWE終濃度稀釋為1 mg/ml。
1.3 實驗分組 幼年雄性SD大鼠(4周齡)48只,隨機分為對照組、Res對照組(Res組)、KD模型組(KD組)和Res處理KD組(Res+KD組);其中,對照組大鼠僅腹腔注射0.5 ml生理鹽水,Res組僅腹腔注射Res(100 mg/kg),KD組大鼠腹腔注射0.5 ml LCWE(1 mg/ml),Res+KD組大鼠腹腔注射0.5 ml LCWE(1 mg/ml)和Res(100 mg/kg)。每天監測大鼠的生存狀況,包括體重、飲水、飲食和活動狀況等。在造模后28 d結束實驗取材,并檢測相關指標。
1.4 小動物超聲檢測各組心臟功能 4%異氟烷麻醉大鼠,并將大鼠仰臥位固定在Visual Sonics Vevo 2100小動物超聲儀加熱板上,將恒溫加熱板溫度設定為37 ℃。將左胸前被毛脫去后開始檢測。用探頭置于大鼠左胸前,在乳頭肌水平位置用M型取樣線監測心率,測量收縮期左室內徑、舒張期左室內徑等指標,并經計算得到左室射血分數(left ventricular ejection fraction, LVEF)和左室短軸縮短率(left ventricular fractional shortening, LVFS)。
1.5 HE染色 實驗結束后,將各組大鼠心臟取下放入PBS中清洗,再固定于4%多聚甲醛中過夜,采用常規脫水復蠟方法進行石蠟包埋,并切成3 μm厚的薄片,然后行常規HE染色步驟,光鏡下觀察各組心臟形態結構。
1.6 心肌組織TNF-α和IL-1β含量檢測 各組均稱取50 mg的心肌組織并放入離心管中,加入1 ml預冷的PBS,用眼科剪將心肌組織剪成小塊,低溫高速離心機4 ℃ 3000 g離心5 min,棄上清,沉淀中加入RIPA裂解液(質量/體積比1∶5)和蛋白酶抑制劑,在冰上將心肌組織充分研磨并裂解30 min,低溫高速離心機4 ℃ 12 000 g離心30 min,吸取上清,棄沉淀。按照TNF-α含量檢測說明書,采用分光光度計在450 nm處測量吸光值并根據說明書繪制標準曲線計算各組心肌組織中TNF-α含量;按照IL-1β含量檢測說明書,在450 nm處檢測吸光值并根據標準曲線計算各組心肌組織中IL-1β含量。
1.7 Western blot檢測蛋白表達 實驗結束后,各組稱取50 mg重量的心肌組織并放入離心管中,加入1 ml預冷的PBS,用眼科剪將心肌組織剪成小塊,低溫高速離心機4 ℃ 3000 g離心5 min,棄上清,沉淀中加入RIPA裂解液(質量/體積比1∶4)和蛋白酶抑制劑,在冰上將心肌組織充分研磨并裂解30 min,低溫高速離心機4 ℃ 12 000 g離心30 min,吸取上清,棄沉淀;采用BCA法進行蛋白定量,采用常規電泳和濕轉法將蛋白轉移至PVDF膜,并用5%脫脂奶粉室溫下封閉1.5 h,將條帶放入相應的Bax抗體(1∶1000)、Bcl2抗體(1∶1000)、Notch1抗體(1∶1000)、Hes1抗體(1∶1000)和GAPDH抗體(1∶5000)中,搖床4 ℃過夜孵育;TBST洗膜5次,6 min/次,將條帶放入山羊抗兔或山羊抗鼠二抗(1∶5000)室溫搖床孵育1 h,TBST洗膜5次,6 min/次,用ECL顯色液避光檢測,Image Lab統計灰度值。
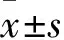
2 結 果
2.1 Res改善KD誘發的心臟功能障礙 超聲結果顯示,和對照組比較,Res組大鼠心臟功能沒有明顯變化;和對照組比較,KD組大鼠心臟LVEF和LVFS顯著降低(P<0.05);而和KD組比較,Res+KD組大鼠心臟LVEF和LVFS明顯升高(P<0.05,圖1和表1)。

圖1 各組大鼠心臟超聲原始圖

表1 各組川崎病大鼠誘發心臟LVEF和LVFS的比較
2.2 Res減輕KD誘發的心肌細胞凋亡 Western blot和TUNEL染色結果顯示,和對照組比較,Res組大鼠心肌細胞凋亡數量和凋亡相關蛋白表達無明顯變化;和對照組比較,KD組大鼠心肌細胞凋亡數量和Bax蛋白表達增加,Bcl2蛋白表達減少(P<0.05);而和KD組比較,Res+KD組大鼠心肌細胞凋亡數量和Bax蛋白表達降低,Bcl2蛋白表達增加(P<0.05,圖2,表2和圖3)。

圖2 各組川崎病大鼠誘發心肌損傷Bcl2和Bax蛋白表達的western blot結果

表2 各組川崎病大鼠心肌組織Bcl2和Bax蛋白表達的比較

圖3 各組川崎病大鼠心臟TUNEL染色結果
2.3 Res減輕KD引起的心肌組織炎性反應 HE染色和ELISA結果顯示,對照組和Res組大鼠心肌纖維排列整齊,心肌組織中TNF-α和IL-1β含量無明顯差異;和對照組比較,KD組心肌纖維排列紊亂,并出現部分斷裂,心肌組織中TNF-α和IL-1β含量顯著增加(P<0.05);而和KD組比較,Res+KD組心肌纖維排列改善,斷裂減輕,心肌組織中TNF-α和IL-1β含量明顯降低(P<0.05,圖4和表3)。

圖4 各組川崎病大鼠心臟HE染色結果(200×)

表3 各組川崎病大鼠心肌組織Bcl2和Bax蛋白表達的比較
2.4 Res激活KD心肌組織中Notch1/Hes1信號 Western blot結果發現,和對照組比較,Res組大鼠心肌組織中Notch1和Hes1蛋白表達沒有明顯差異;和對照組比較,KD組心肌組織中Notch1和Hes1蛋白表達明顯降低(P<0.05);和KD組比較,Res+KD組心肌組織中Notch1和Hes1蛋白表達顯著升高(P<0.05,圖5和表4)。

圖5 各組川崎病大鼠誘發心肌損傷Notch1和Hes1蛋白表達的western blot結果

表4 各組川崎病大鼠心肌組織Notch1和Hes1蛋白表達的比較
3 討 論
川崎病已經成為嬰幼兒獲得性心臟病的主要原因之一,作為一種急性、發熱性和出疹性疾病,由于病因和機制不明,使其成為臨床診斷和治療的難點。KD主要以非特異性血管炎為病理特征,對冠狀動脈的侵害尤為嚴重,對患兒心血管系統直接或間接的損害是KD引發損傷甚至導致死亡的重要原因[16]。為了進一步闡明KD的發病機制,為臨床治療尋找潛在的藥物和可能的治療靶點,本研究利用LCWE制備幼年雄性SD大鼠KD模型,觀察了Res對KD誘發心肌損傷的保護作用和機制,證明Res可通過激活Notch1/Hes1信號,減輕心肌細胞凋亡和心肌炎性反應發揮保護KD心肌損傷的作用。
幼年雄性SD大鼠腹腔注射LCWE制備的KD模型,是目前實驗室比較常用的動物模型,為闡明KD病因及其對心血管損傷的分子機制提供了重要手段[15]。本研究發現,KD組大鼠心臟LVEF和LVFS明顯降低,同時,心肌組織Bcl2蛋白表達降低,Bax蛋白表達升高,心肌細胞凋亡指數明顯增加,心肌組織炎性分子TNF-α和IL-1β含量顯著增加,這些結果說明,KD組大鼠心臟功能障礙,心肌細胞凋亡和炎性反應明顯增加。
Res是從多種天然植物中提取的多酚類化合物,在抗衰老、降脂、抗氧化、抗癌、抗炎性反應和改善心血管疾病等方面均具有生物學活性,尤其是在心血管保護方面受到了廣泛關注。有研究表明,Res能改善血管內皮功能紊亂,抑制TNF-α誘導的NF-κB核轉位,減輕細胞炎性反應[17]。同時,Res還能通過調控NF-κB、Sirt1、Nrf2或AMPK等分子在心肌梗死、缺血/再灌注損傷和心力衰竭等疾病的進展過程中發揮保護作用[18,19]。本研究在成功制備KD模型的基礎上,又進一步觀察了Res對KD誘發心肌損傷的保護作用。結果發現,Res處理KD組大鼠心臟LVEF和LVFS得到改善,心肌組織Bcl2蛋白表達升高,Bax蛋白表達和心肌細胞凋亡指數也明顯降低,同時,心肌組織炎性分子TNF-α和IL-1β含量明顯降低,這些結果說明,Res可以改善KD組大鼠心臟功能障礙,并減輕KD誘導的心肌細胞凋亡和炎性反應。
Notch1/Hes1信號在組織器官發育、細胞增殖、分化和修復中發揮重要作用,而Hes1是Notch信號下游重要的靶基因[11]。越來越多的研究表明,Notch1/Hes1信號在心血管疾病中扮演重要的角色[12,20]。因而,我們又觀察了Notch1/Hes1信號在Res改善KD誘發心肌損傷中的作用。結果發現,KD組心肌組織中Notch1和Hes1蛋白表達均顯著降低,而給予Res處理后,可明顯上調Notch1和Hes1蛋白表達。這些結果說明,Res能夠激活KD引起的Notch1/Hes1信號抑制發揮心肌保護作用。
總之,本研究進一步明確了Res在KD誘發心肌損傷中發揮保護作用,其作用與Res減輕KD導致的心肌細胞凋亡和降低心肌組織炎性反應有關,而Res發揮保護作用的機制可能與激活Notch1/Hes1信號有關。這為臨床上預防和治療KD誘發的心肌損傷提供了新的實驗依據和策略。

