白術多糖對環磷酰胺誘導的免疫抑制小鼠白細胞數量及功能的修復作用
相雪蓮,許丹寧,曹 楠,錢 隆,田允波,李婉雁
(1.仲愷農業工程學院動物科技學院,廣東 廣州 510225;2.廣東省水禽健康養殖重點實驗室,廣東 廣州 510225)
規模化養殖作為未來養殖模式的主流,對動物疫病的防控提出了更高的要求,因此,開發無毒、無殘留的免疫調節劑以提高動物機體的抗病能力顯得尤為重要。白術多糖(Polysaccharide ofAtractylodesmacrocephalaKoidz,PAMK)作為中藥白術的主要有效成分,可提高動物機體免疫力,并具有抗炎、抗腫瘤、抗應激等作用[1]。大量前期研究結果表明,PAMK具有提高免疫器官指數、提高淋巴細胞增殖和轉化、調節細胞因子的分泌及糾正T淋巴細胞亞群分布紊亂等免疫活性效應[2-4],但關于對免疫抑制動物白細胞形態和功能方面的報道較少。據此,本試驗利用環磷酰胺(Cyclophosphamide,CTX)小鼠模型,初步探討了PAMK對免疫抑制小鼠白細胞數量、形態及功能的影響,為多糖類免疫調節劑的應用提供理論依據。
1 材料與方法
1.1 實驗動物 60只5周齡SPF級昆明小鼠,雌性,購自南方醫科大學動物科學實驗中心。
1.2 試驗分組及處理 小鼠隨機分為4組,每組15只,分別為對照組(N)、環磷酰胺組(H)、白術多糖組(B)和白術多糖+環磷酰胺組(BH)。B組和BH組小鼠灌胃PAMK 200 mg/(kg·bw),另兩組灌胃生理鹽水0.5 mL,1次/d,連續28 d。H組和BH組小鼠在29 d、30 d、31 d連續腹腔注射CTX 80 mg/(kg·bw),另兩組小鼠腹腔注射0.5 mL生理鹽水。35 d采集樣品并保存。
1.3 主要儀器 全自動酶標儀(ELX800),購自美國博騰儀器公司;分光光度計(UV-3100),購自MAPADA 公司;定量溶光光度分析儀(T6),購自北京普析有限公司;比濁儀(Wi94748),購自東西儀科技有限公司;生化培養箱(HCS-65A-A),購自廣州恒創有限公司;透射電子顯微鏡(JEM-1400),購自日本電子株式會社公司;光學顯微鏡(ECLIPSE E100),購自Nikon公司。
1.4 主要藥品和試劑 白術多糖(20160323),購自西安天園生物制劑廠;注射用環磷酰胺(H14023686),購自山西普德藥業有限公司;金黃色葡萄球菌(FSCC223005),購自廣東環凱微生物科技有限公司;ELISA試劑盒(XY-ELA9021),購自上海心語生物科技有限公司;豚鼠血清(HQ30076),購自廣東鴻泉生物科技有限公司;綿羊紅細胞(HQ80073),購自廣東鴻泉生物科技有限公司;瑞士-吉姆薩染液(416093),購自珠海貝索生物技術公司;H.E.染液(DH0006),購自LEAGENE公司。
1.5 試驗方法
1.5.1 樣品采集及預處理 采集樣品前,小鼠禁食12 h,禁水6 h,乙醚麻醉,剪去尾尖,取約2 μL血液制備血涂片,瑞氏-吉姆薩法染色,光學顯微鏡下觀察白細胞,取400倍30個視野,計算白細胞總數,計數200個白細胞用于比例計算;眼靜脈取血分別制備抗凝血及血清,用于相關指標檢測;快速收取1~3 mm3的脾臟、胸腺組織置于2.5% 戊二醛溶液保存,送廣州金域醫學檢驗中心制備透射電鏡切片及拍照觀察;取小鼠左側股骨置于福爾馬林溶液浸泡保存,用于石蠟切片制備。
1.5.2 中性粒細胞吞噬能力測定 將新鮮抗凝血和金黃色葡萄球菌液以2∶1比例混合,置37 ℃水浴30 min,每隔15 min輕輕搖晃均勻。室溫下3 000 r/min離心10 min。吸取約3 μL中間白細胞層液體,制備白細胞涂片,瑞氏-吉姆薩法染色,計數100個中性粒細胞,用于中性粒細胞吞噬百分比及吞噬指數計算,公式如下:
1.5.3 血清中IL-2濃度檢測 按ELISA試劑盒操作說明書進行IL-2濃度的測定。
1.5.4 B淋巴細胞產生抗體能力檢測 小鼠腹腔注射綿羊紅細胞,處理5 d后,無菌摘取脾臟,分離淋巴細胞,臺盼藍染色檢測細胞活性在95%以上,將細胞濃度調整為5×106個/mL,淋巴細胞懸液10 μL 取加入體積分數為10%的綿羊紅細胞0.5 mL,補體1 mL,37 ℃水浴30 min,2 000 r/min離心10 min,取上清,分光光度計波長413 nm處測定OD值。
1.5.5 統計分析 采用Prism 5.0(GraphPad Software,CA,USA)軟件處理數據,選擇單因素方差分析,Tukey多重比較法進行多組間差異比較,文中數據均以平均值±標準差(Mean±SD)表示,股骨組織切片采用CCD顯微成像分析系統進行拍照分析。
2 結果
2.1 白術多糖對小鼠外周血白細胞數量以及比例的影響 結果如表1所示,小鼠經環磷酰胺誘導后,外周血中白細胞數量和淋巴細胞比例與對照組相比顯著下降(P<0.05),中性粒細胞百分比顯著上升(P<0.05),單核細胞及嗜酸性粒細胞比例無明顯變化(P>0.05)。白術多糖組小鼠的白細胞數量及比例與對照組差異不顯著(P>0.05),灌服白術多糖能顯著提高免疫抑制小鼠的白細胞數量(P<0.05),但仍低于對照組及白術多糖組(P<0.05),對淋巴細胞及中性粒細胞比例也無明顯影響(P>0.05)。
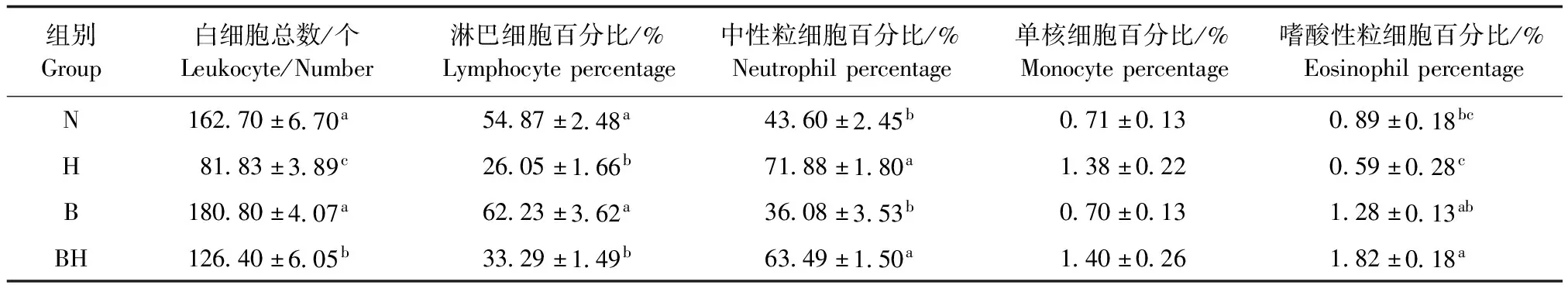
表1 白術多糖對小鼠白細胞數量及比例的影響
2.2 白術多糖對小鼠胸腺、脾臟超微結構的影響 從圖1可以看出,對照組及白術多糖組小鼠胸腺組織致密,細胞排列有序(圖1A,1E),可見發育不同時期的胸腺細胞及胸腺上皮細胞,胸腺細胞核內易染色質呈團塊狀沿核周分布,核質比高,胞膜上突起少,細胞器較少(圖1B,1E)。免疫抑制小鼠胸腺組織中,正常細胞數量明顯減少(圖1C),胸腺細胞核內染色質多出現邊集,可見凋亡小體、髓樣小體及變性泡狀結構(圖1D),并伴有電子密度顆粒沉積。灌胃白術多糖可明顯增加免疫抑制小鼠胸腺組織密度(圖1G),胸腺細胞形態正常,但胸腺細胞胞漿內細胞器多于對照組及白術多糖組,仍有細胞凋亡現象(圖1H),未見髓樣小體,整體細胞狀態較免疫抑制小鼠有明顯好轉。
圖2表明,對照組及白術多糖組小鼠脾臟組織結構正常,可見T淋巴細胞(圖2F)、漿細胞(圖2B)、中性粒細胞、單核細胞等,細胞形態規則,偶見凋亡初期細胞(圖2A,2E)。環磷酰胺組小鼠脾臟結構明顯異常,細胞數量減少,細胞核電子密度降低,染色質減少,可見較多細胞凋亡(圖2D),染色質邊集、核固縮現象明顯,出現大量巨型轉化淋巴細胞(圖2C),胞漿內充滿大量擴展、泡狀光面內質網,胞核異型度高,多核。灌胃白術多糖對免疫抑制小鼠的脾臟結構有明顯修復作用,組織致密性增加(圖2G),巨型轉化淋巴細胞及凋亡細胞數量明顯減少,但胞漿中細胞器損傷仍較嚴重(圖2H)。
2.3 白術多糖對小鼠股骨骨髓細胞的影響 封二彩版圖3結果顯示,對照組和白術多糖組小鼠股骨組織結構正常,骨髓細胞數量多,粒細胞系、紅細胞系、淋巴細胞系的細胞發育良好(封二彩版圖3A,3B,3E,3F),環磷酰胺誘導小鼠的股骨組織疏松,各系細胞及巨核細胞數量明顯減少,出現脂肪空泡,細胞核淡染,染色質缺失,成熟紅細胞數量也明顯減少(封二彩版圖3C,3D)。添加白術多糖以后,環磷酰胺組小鼠骨髓結構有了明顯的改善,骨髓細胞數量增多,但細胞核淡染現象依舊比較嚴重(封二彩版圖3G,3H)。
2.4 白術多糖對小鼠白細胞功能的影響 由圖4可知,和對照組相比,環磷酰胺組小鼠的中性粒細胞吞噬百分數、中性粒細胞吞噬指數、IL-2濃度以及B淋巴細胞分泌抗體量水平均顯著降低(P<0.05)。白術多糖可以顯著提高免疫抑制小鼠的中性粒細胞吞噬能力、血清中IL-2含量以及B淋巴細胞分泌抗體水平(P<0.05),達到對照組水平(P>0.05),而白術多糖還可以顯著提高正常小鼠淋巴細胞分泌細胞因子及抗體能力(P<0.05)。

圖4 PAMK對免疫抑制小鼠白細胞功能的影響
3 討論
環磷酰胺是制備免疫抑制動物模型的常用藥物,通過抑制骨髓造血干/祖細胞,引起白細胞減少癥,導致免疫功能低下[5-6]。本試驗采用80 mg/(kg·bw)劑量CTX誘導小鼠,發現小鼠外周血中白細胞數量急劇減少,白細胞比例紊亂,骨髓細胞損傷嚴重,胸腺及脾臟中死亡及凋亡細胞明顯增多,對T、B淋巴細胞及中性粒細胞的功能也有強烈的抑制作用,這與許多相關領域的研究結果一致[7-9]。
白細胞是機體防御系統的重要組成部分,起源于骨髓造血干細胞,在骨髓及胸腺中發育分化后,在血液及脾臟中執行功能,計算白細胞數量及比例是評估免疫功能的有效方法。本試驗結果顯示,白術多糖對正常小鼠白細胞的數量及比例無明顯干預作用,對免疫抑制小鼠外周血中白細胞數量有明顯的提升作用,但不能改變淋巴細胞及中性粒細胞比例紊亂現象,這可能與環磷酰胺的免疫抑制機制有關。環磷酰胺作為治療癌癥、自身免疫及免疫介導疾病的藥物,主要免疫抑制機制是使T、B淋巴細胞絕對數目減少[5],這種機制除了通過抑制骨髓造血干細胞外,對外周血中成熟的淋巴細胞更具有直接殺傷效果。而白術多糖作為一種調節性免疫增強劑,并不能徹底糾正這種免疫抑制現象。試驗數據盡管沒有統計學意義,但能看出淋巴細胞百分比有上升的趨勢。Li W Y等在研究中也發現,白術多糖可以糾正因環磷酰胺所致的雛鵝白細胞比例失衡,并能明顯提高T、B淋巴細胞的體外增殖能力[10],還有其他一些中草藥活性物質也都能夠明顯改善環磷酰胺誘導的免疫抑制小鼠白細胞減少現象[11-12]。
骨髓、胸腺及脾臟是白細胞發育、分化及執行功能的場所。骨髓組織在環磷酰胺的作用下,骨髓細胞數量明顯減少,相對淋巴系及紅系細胞而言,粒細胞系損傷最輕,而白術多糖能夠明顯增加骨髓細胞的數量,從而拮抗環磷酰胺的抑制作用。胸腺是T淋巴細胞發育分化場所,超微結構的結果顯示,環磷酰胺對胸腺細胞的破壞程度最嚴重,主要體現在不同發育時期淋巴細胞的數量急劇減少、凋亡及壞死現象增多。進行白術多糖干預后,胸腺細胞的數量明顯增多,細胞形態有明顯的改善,凋亡細胞數量也顯著減少。脾臟在環磷酰胺的作用下出現了大量的巨型轉化淋巴細胞及凋亡細胞,說明環磷酰胺對淋巴細胞的破壞最嚴重,而白術多糖能夠明顯減少巨型轉化淋巴細胞的數量,并能使脾臟中的淋巴細胞保持正常形態,同時也減少了壞死和凋亡的細胞,綜合分析發現,白術多糖對造血及免疫器官中淋巴細胞的修復作用比較顯著,但對淋巴細胞總量的提升作用不明顯。
白術多糖雖然對正常小鼠白細胞數量、比例及組織細胞沒有正向或負向的干預作用,但對正常小鼠的T、B淋巴細胞功能有顯著的促進作用。T淋巴細胞是IL-2的主要產生者,IL-2的分泌水平是衡量T淋巴細胞功能的重要指標,同時IL-2對胸腺中的調節性T細胞的發育也有重要影響[13],本試驗結果發現,白術多糖對正常小鼠血清中IL-2的含量有明顯的提升作用,從而可以推斷,白術多糖對胸腺中T細胞的分化也有一定的促進作用。體液免疫主要是通過B淋巴細胞轉化成漿細胞分泌抗體及激活相關免疫細胞分泌細胞因子來發揮作用,B淋巴細胞表面有免疫球蛋白(BCR),特異抗原只能和相應的受體結合才能發揮作用,因此B淋巴細胞產生抗體量是衡量體液免疫的重要指標。已有研究發現,多糖可以提高機體的體液免疫功能,例如玉屏風多糖能夠提高綿羊紅細胞處理時B淋巴細胞分泌的抗體量,從而提高小鼠的體液免疫功能[14]。而白術多糖也能夠顯著高正常小鼠B淋巴細胞分泌抗體的能力,上述研究結果證實了在正常生理條件下,白術多糖通過提高淋巴細胞的功能,從而增強機體的特異性免疫功能。李鵬等[15]也從血清抗體的測定、脾淋巴細胞的轉化能力角度證實了白術多糖對正常小鼠特異性免疫具有調節作用。
白術多糖對免疫抑制小鼠的白細胞功能則表現出了明顯的正向調節作用,4種指標均恢復至對照組水平。中性粒細胞的吞噬指標是評定功能的重要指標,吞噬能力越強,則代表中性粒細胞的功能越完善,能夠在短時間內發揮強大的防御作用。白術多糖雖然不能提升正常小鼠中性粒細胞的吞噬能力,但可增強免疫抑制小鼠的中性粒細胞功能,原因可能是白術多糖可以明顯修復骨髓粒細胞系,增加了外周血中中性粒細胞的數量并增強其活力。試驗結果進一步顯示,在機體免疫功能低下時,白術多糖能從非特異性和特異性免疫角度全面改善機體的防御能力,顯示出了強大的免疫促進作用。
綜上所述,白術多糖可以通過提高白細胞數量、修復骨髓、脾臟及胸腺的組織結構、提高白細胞功能等途徑減輕環磷酰胺對小鼠白細胞的抑制和破壞作用,并對正常小鼠的淋巴細胞功能具有明顯的提升作用。本試驗初步探索了白術多糖對免疫抑制小鼠白細胞的保護作用,為進一步研究白術多糖的作用機制及臨床應用提供了基礎數據。

