樂伐替尼與瑞格菲尼對肝癌細胞PD-L1的作用及機制*
許靜, 喻超, 楊盛力, 孫誠誼
(貴州醫科大學附屬醫院 肝膽外科, 貴州 貴陽 550004; 貴州醫科大學 肝膽胰脾重點實驗室, 貴州 貴陽 550004; 貴州省肝膽胰脾疾病研究所, 貴州 貴陽 550004)
過去十年來,肝癌(hepatocellular carcinoma,HCC)成為全球癌癥死亡的第三大主要原因,其主要是由乙型肝炎病毒或丙型肝炎病毒的慢性感染、酗酒及代謝綜合征(糖尿病和肥胖癥)引起的[1-2]。發達國家疾病檢測方案中,約40%~50%的早期肝細胞癌患者可進行潛在的治療[3],中期肝癌的患者可以接受局部治療,而晚期肝癌的患者可以從全身治療中受益[4],大約50%的肝癌患者會接受全身治療[5-6]。目前,分子靶向治療在肝癌治療中起著至關重要的作用[7]。瑞格菲尼是口服的血管生成性血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)及基質受體酪氨酸激酶的抑制劑[8],基于3期隨機雙盲對照試驗的結果,該藥已被批準用作治療肝癌的二線藥物[9-10]。樂伐替尼是一種口服的多靶點酪氨酸激酶抑制劑,可選擇性抑制血管生成性血管內皮生長因子、成纖維細胞生長因子受體及血小板衍生的生長因子受體[11-13]。臨床前期研究表明,樂伐替尼能有效阻斷血管內皮生長因子和成纖維細胞生長因子驅動的血管生成,阻斷VEGFR相關的淋巴管生成[14],已被用于治療進行性、局部復發性及放射性碘難治性甲狀腺癌[14];樂伐替尼聯合依維莫司以血管內皮生長因子為靶點,用于治療轉移性腎細胞癌[15]。最近,在樂伐替尼的肝癌3期臨床試驗中,樂伐替尼通過統計證實治療效果不亞于索拉菲尼,并證明了對總體生存率有明顯的影響[14],且該藥在肝癌疾病的緩解率,無復發生存期方面取得了重大的臨床效果[16]。研究發現腫瘤細胞免疫檢查點蛋白通常表達上調,從而通過抑制T細胞攻擊來逃避宿主免疫系統的殺傷[17];腫瘤細胞中的程序性死亡-配體1(programmed cell death -ligand1,PD-L1)與在T細、B細胞、樹突狀細胞和自然殺傷性T細胞上表達的程序性死亡1(programmed cell death protein 1,PD-1)結合,可以抑制抗癌免疫力[18-19]。因此,抗PD-L1和抗PD-1抗體已用于治療癌癥,但對分子靶向藥對PD-L1表達的調控及分子機制尚不清楚,本研究探討分子靶向藥物瑞格菲尼與樂伐替尼調控PD-L1的作用及分子機制,現將結果匯報如下。
1 材料與方法
1.1 材料
1.1.1細胞與實驗動物 人肝癌Hep3B和SMMC-7721細胞購自中國典型培養物保藏中心(武漢);4周齡雌性裸鼠(BALB/c)小鼠30只,體質量(16±5)g,購自華中科技大學同濟醫學院實驗動物中心。
1.1.2藥物、主要試劑與儀器 樂伐替尼粉劑(批號S1164,2 mg/支)和瑞格菲尼粉劑(批號S1178,5 mg/支)購自美國Selleck公司,缺氧誘導因子-1α(hypoxia inducible factor-1α,HIF1α)、髓細胞增生原癌基因(myelocytomatosis oncogene,MYC)、缺氧誘導因子-2α(hypoxia inducible factor-2α,HIF2α),信號傳導與轉錄激活因子3(signal transducer and activator of transcription3,STAT3)、黏蛋白1-C(mucin 1-C,MUC1-C)、細胞周期素依賴蛋白激酶5(cyclin-dependent kinase 5,CDK5)、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK14)、表皮生長因子受體(epidermal growth factor receptor,EGFR)、間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)及轉化生長因子-β1(transforming growth factor-β1,TGF-β1)引物購自武漢谷歌生物科技有限公司,二甲亞砜(dimethyl sulfoxide, DMSO)購自美國MP Biomedical公司,胎牛血清、DMEM細胞培養基、青霉素-鏈霉素雙抗、Lipofectamine 3000、Opti-MEM培養基、siRNA轉染試劑盒及提取RNA所用的Trizol均購自美國Invitrogen公司,TGF-β1的空載質粒、干擾質粒和Western blot試劑盒購自武漢谷歌生物科技有限公司,TGF-β1、PD-L1和甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗體購自武漢三鷹生物技術有限公司,CO2恒溫培養箱購自美國Cellstar公司。
1.2 方法
1.2.1TGF-β1干擾RNA的轉染 無酶水稀釋TGF-β1干擾RNA干粉后,調節濃度至20 mmol/L。取長滿50%~60%培養瓶的肝癌Hep3B和SMMC-7721細胞進行轉染,2種細胞各分為對照組和干擾組。2種細胞的干擾組進行轉染時,取2支1.5 mL EP管,再分別取si-TGF-β1 5 μL、Opti-MEM 125 μL、lipofectamine3000 5 μL及Opti-MEM 125 μL混合均勻并靜置5 min,2支EP管的液體輕輕混合均勻、靜置20 min;混合液加入培養瓶中,與換好的培養液搖晃混勻;2種細胞的對照組按上述方法進行轉染。將培養瓶置于37 ℃的恒溫加濕培養箱中培養6 h后換液。
1.2.2皮下成瘤實驗及分組 取人肝癌Hep3B細胞(1×106個)皮下接種于所有小鼠右側腹肋下,觀察裸鼠皮下成瘤情況;1周后將皮下成瘤的30只小鼠隨機分為對照組[DMSO 20 μg/(kg·d)]、樂伐替尼組[注射樂伐替尼4 μg/(kg·d)]及瑞格菲尼組[注射瑞格菲尼20 mg/(kg·d)],10只/組,每2 d對各組小鼠進行皮周注射,持續3周;末次給藥后24 h處死小鼠,取腫瘤塊,待后續實驗使用。
1.2.3細胞培養及實時熒光定量PCR(real-time quantitative PCR,qRT-PCR)檢測 取人肝癌Hep3B、SMMC-7721細胞,分別轉染TGF-β1的空載體、干擾質粒后置于含5%胎牛血清及1%青霉素-鏈霉素雙抗的DMEM培養基中,37 ℃、5%CO2加濕培養箱中培養;使用Trizol試劑分別從上述細胞中提取總RNA,用PrimeScript RT試劑盒進行逆轉錄,用SYBR Prime Script RT-PCR試劑盒進行qRT-PCR試驗,檢測肝癌細胞中HIF1α、MYC、HIF2α、STAT3、MUC1-C、CDK5、MAPK14、EGFR、ALK及TGF-β1的mRNA表達水平,所有測定均重復3次。見表1。

表1 qRT-PCR引物序列Tab.1 Primer sequences of qRT-PCR
1.2.4Western blot實驗 分別取各組小鼠的皮下瘤組織及1.2.2項下各組肝癌細胞加入RIPA緩沖液,置于冰上裂解40 min,4 ℃、12 000 r/min離心30 min,取上清液于5×SDS-PAGE上樣緩沖液中煮沸10 min,10%SDS-PAGE分離,轉移到硝酸纖維素膜上;將膜置于含5%脫脂奶粉的TBST中室溫封閉1 h,4 ℃與抗PD-L1(1 ∶3 000)、抗TGF-β1(1 ∶500)和抗GAPDH(1 ∶3 000)的抗體孵育過夜;次日與PD-L1和TGF-β1的二抗于室溫孵育2 h,TBST溶液洗脫3次,增強化學發光(Electro Chemi Luminescence,ECL)檢測,使用ImageJ圖像分析軟件分析PD-L1和TGF-β1的表達量。
1.3 統計學分析
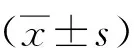
2 結果
2.1 藥物對PD-L1各上游基因的調控作用
qRT-PCR檢測結果顯示,與對照組相比,樂伐替尼組和瑞格菲尼組小鼠皮下肝癌移植瘤組織中HIF1α、MYC、HIF2α及MUC1-CmRNA表達均上調,STAT3、CDK5、MAPK14、EGFR及ALKmRNA表達均下調,但樂伐替尼組TGF-β1 mRNA表達增加,瑞格菲尼組TGF-β1 mRNA表達降低,差異均有統計學意義(P<0.05)。見圖1。

注:(1)與對照組比較,P<0.05。圖1 各組小鼠皮下肝癌移植瘤組織中PD-L1各上游基因的表達(qRT-PCR)Fig.1 The expression levels of the upstream gene of PD-L1 in the xenograft tumors tissues of each group(qRT-PCR)
2.2 藥物對PD-L1和TGF-β1的影響
qRT-PCR結果顯示,與對照組比較,樂伐替尼組肝癌Hep3B和SMMC-7721細胞的TGF-β1 mRNA表達水平均上升,瑞格菲尼組的TGF-β1 mRNA表達水平下降(P<0.05,圖2A); Western blot結果顯示,與對照組比較,樂伐替尼組肝癌Hep3B和SMMC-7721細胞的PD-L1和TGF-β1蛋白表達量均上升,瑞格菲尼組PD-L1和TGF-β1蛋白表達量下降,差異均有統計學意義(P<0.05,圖2B和2C)。

注:A為qRT-PCR檢測結果,B、C為Western blot檢測結果;(1)與對照組相比,P<0.05。圖2 樂伐替尼組和瑞格菲尼組不同肝癌細胞中TGF-β1和PD-L1的表達Fig.2 Expression of TGF-β1和PD-L1 in hepatocellular carcinoma cells in lenvatinib group and regorafenib group
2.3 干擾RNA轉染效果的驗證
轉染siRNA后qRT-PCR檢測結果顯示,肝癌Hep3B和SMMC-7721細胞干擾組TGF-β1 mRNA表達量分別較對照組降低,差異均有統計學意義(P<0.05,圖3A);Western blot檢測結果顯示,肝癌Hep3B和SMMC-7721細胞干擾組的TGF-β1蛋白表達量分別較對照組降低,差異均有統計學意義(P<0.05,圖3B和3C)。

注:A為qRT-PCR檢測結果,B、C為Western blot檢測結果;(1)與對照組比較,P<0.05。圖3 對照組和干擾組TGF-β1的表達Fig.3 Expression of TGF-β1 in the control and interfering group
2.4 干擾TGF-β1表達后對肝癌細胞PD-L1表達的影響
qRT-PCR結果顯示,肝癌Hep3B和SMMC-7721細胞干擾組的PD-L1 mRNA表達量分別較對照組降低,差異均有統計學意義(P<0.05,圖4A);Western blot 結果顯示,肝癌Hep3B和SMMC-7721細胞干擾組的TGF-β1和PD-L1蛋白表達量分別較對照組下降,差異均有統計學意義(P<0.05,圖4B和4C)。

注:A為qRT-PCR檢測結果,B、C為Western blot檢測結果;(1)與對照組相比,P<0.05。圖4 抑制TGF-β1后肝癌細胞PD-L1的表達Fig.4 Expression of PD-L1 after inhibited the expression of TGF-β1
3 討論
瑞格菲尼和樂伐替尼具有多個靶點,并在腫瘤治療中廣泛使用,且兩者均已獲得FDA批準,可用于治療肝細胞癌[20]。然而,以分子靶向的腫瘤很少能完全抑制腫瘤,藥物的治療作用往往是暫時的,因此,大多數患者最終會產生耐藥性并復發[21]。因此,迫切需要更有效的治療策略和藥物,來改善表現出抗藥性的肝細胞癌患者的預后。PD-L1是PD1的配體,在許多類型的腫瘤細胞(包括黑素瘤,卵巢癌和肺癌)中均表達上調[22-23]。由于PD1和PD-L1的阻斷在抑制腫瘤上已產生了可喜的臨床效果,因此,了解兩種分子靶向治療藥物影響PD-L1的調節機制可能有助于尋找有效的臨床治療策略。本研究先構建了裸鼠的皮下肝癌成瘤模型,根據文獻報導,本實驗常規使用雌性裸鼠[24];同時通過閱讀文獻,篩選出與PD-L1相關度較高的調控基因HIF1α、MYC、HIF2α、STAT3、MUC1-C、CDK5、MAPK14、EGFR、ALK及TGF-β1,先進行qRT-PCR實驗,結果顯示樂伐替尼和瑞格菲尼對TGF-β1具有反向調節作用,這與2種靶向藥對PD-L1的調節方式一致。本研究中qRT-PCR對裸鼠植皮下肝癌移植瘤中PD-L1的上游調控基因進行檢測結果發現,樂伐替尼和瑞格菲尼對TGF-β1表達出現了差異性調節,即樂伐替尼使TGF-β1表達增加,瑞格菲尼組使TGF-β1表達降低,再通過qRT-PCR和Western blot在細胞水平上驗證樂伐替尼和瑞格菲尼對TGF-β1表達的調控,結果與肝癌組織一致。因此推測樂伐替尼和瑞格菲尼可能通過TGF-β1調節PD-L1的表達,進而在肝癌中產生不完全相同的治療效果。
TGF-β1是一種多功能的多肽細胞因子,在炎癥中起作用,由巨噬細胞、基質細胞和腫瘤細胞產生[25]。在缺氧和炎性條件下,TGF-β1通過調節多種細胞過程(例如細胞增殖,分化,遷移和凋亡)從而在腫瘤進展中發揮作用[26-28]。最近的證據表明,TGF-β1是癌前細胞中的主要腫瘤抑制因子,但在癌癥進展晚期,TGF-β1可誘導上皮-間質轉化(epithelial-mesenchymal transition,EMT)并導致癌細胞轉移增加[29]。由于TGF-β1在轉移過程中的關鍵作用,已開發出靶向TGF-β1信號轉導的拮抗劑來治療癌癥[30]。但是,TGF-β1與免疫檢查點之間的關系尚不清楚。雖然樂伐替尼和瑞格菲尼對瘤體中的TGF-β1具有反向調節作用,但腫瘤的發生發展是一個復雜的過程,因此進一步在肝癌SMMC-7721和Hep3B細胞中用qRT-PCR法和Western blot分別從分子和蛋白水平檢測樂伐替尼和瑞格菲尼對肝癌細胞TGF-β1 表達量的影響,結果提示樂伐替尼和瑞格菲尼導致肝癌細胞TGF-β1的相反調節。轉染siRNA干擾TGF-β1的表達,用qRT-PCR從分子水平確認轉染成功,肝癌細胞中TGF-β1 mRNA表達量下降。而TGF-β1被抑制后,PD-L1的表達下調:qRT-PCR和Western-blot結果均提示,轉染TGF-β1 shRNA后,PD-L1 mRNA及蛋白表達量均下降。
綜上所述,本研究確定了瑞格菲尼和樂伐替尼對肝癌細胞中PD-L1和TGF-β1之間的機制和功能聯系。這些結果為靶向TGF-β1/PD-L1軸建立了潛在的臨床策略,該調控機制可能會提高多激酶激酶抑制劑的療效,并成功解決耐藥性問題。

