外源性硫化氫對氟誘導損傷SH-SY5Y細胞的作用及機制*
潘際剛, 吳昌學, 齊曉嵐, 李成, 朱衛, 劉宇, 官志忠2,,4**
(1.貴州醫科大學 基礎醫學院 生理學教研室, 貴州 貴陽 550025; 2.貴州醫科大學 地方病與少數民族疾病教育部重點實驗室, 貴州 貴陽 550004; 3.貴州醫科大學 分子生物學重點實驗室, 貴州 貴陽 550004; 4.貴州醫科大學附屬醫院 病理科, 貴州 貴陽 550004)
研究表明,氟中毒可造成染氟成年及子代大鼠學習記憶能力下降,其機制與氧化應激水平增高、膽堿酯酶活性降低有關[1-6]。硫化氫(hydrogen sulfide,H2S)目前已被公認為是機體重要的內源性抗氧化劑,可直接發揮抗氧化保護作用[7];并可通過增加谷胱甘肽(glutathione,GSH)水平和超氧化物歧化酶(superoxide dismutase,SOD)活性,間接降低活性氧(reactive oxygen species,ROS)、丙二醛(malondialdehyde,MDA)等氧化應激損傷[8-9],然而H2S在氟中毒神經損傷方面的保護作用未見報道。因此,本實驗觀察離體SH-SY5Y細胞在給予外源性H2S后對氟中毒導致的神經損傷發揮的保護作用、并研究其抗氧化保護機制,現將結果匯報如下。
1 材料與方法
1.1 材料
1.1.1細胞來源 SH-SY5Y細胞購自美國ATCC公司。
1.1.2主要試劑與儀器 胎牛血清、DMEM培養基(美國Hyclone公司),NaF和NaHS(美國Sigma公司),ROS檢測試劑盒(江蘇碧云天生物技術研究所),臺盼藍(美國Amresco公司);321型CO2培養箱(美國Thermo公司),FACS CantoTMII system型流式細胞儀(美國Becton Dickinson公司),H-7650透射電鏡(日本日立公司),CKX41奧林巴斯顯微鏡、TX51型熒光顯微鏡(日本Olympus公司)。
1.2 方法
1.2.1細胞培養及分組 SH-SY5Y細胞用含10%胎牛血清、雙抗(青霉素100 000U/L,鏈霉素100 000 U/L)的DMEM培養基、5%CO2、37 ℃恒溫培養。細胞生長至50%~70%時,換無血清培養基培養12 h后進一步分別加NaF、NaHS孵育48 h分別作為NaF組、NaHS組,NaHS預處理30 min后加2 mmol/L NaF 48 h作為NaF聯合NaHS組,不進行處理孵育48h作為Control組。
1.2.2臺盼藍拒染法 收集各組細胞,胰酶消化制備單細胞懸液與0.4%臺盼藍溶液以9 ∶1混合混勻后染色3min,在倒置顯微鏡100倍下計數藍染及不染色細胞,計算細胞存活率[細胞存活率=活細胞總數/(活細胞總數+死細胞總數)×100%]。
1.2.3細胞形態觀察 各組細胞生長約70%~80%后,無血清培養基培養12 h,加NaF或NaHS 48 h,在光學顯微鏡100倍下進行觀察;收集Control、NaF和NaF聯合NaHS組細胞于離心管37 ℃、1 000 r/min離心5 min,2.5%戊二醛室溫固定2 d,100 mmol/L磷酸緩沖液沖洗,1%鋨酸后固定2 h,丙酮梯度脫水、滲透、包埋、聚合12 h,組織定向包埋、超薄切片、染色,透射電鏡4 000倍下觀察各組細胞。
1.2.4ROS水平檢測 收集六孔板各組細胞用PBS洗2次,加10 μmol/L DCFH-DA(無血清培養液1 ∶1 000稀釋)37 ℃避光、孵育20 min,培養液洗2次,洗除多余DCFH-DA。用激發波長488 nm,發射波長525 nm流式細胞儀檢測細胞內ROS水平。
1.3 統計學分析
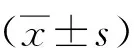
2 結果
2.1 細胞毒性效應
臺盼藍拒染法實驗結果顯示,Control組和NaF聯合NaHS組SH-SY5Y細胞的存活率分別高于NaF組,差異均有統計學意義(P<0.05);Control組和NaHS組、Control組和NaF聯合NaHS組組間細胞存活率差異均無統計學意義(P>0.05)。見圖1。

注:(1)與Control組相比,P<0.05;(2)與NaF組相比,P<0.05。圖1 NaHS和NaF對SH-SY5Y細胞存活率的影響Fig.1 Effects of NaHS and NaF on the survival rates of SH-SY5Y cells
2.2 細胞形態結構的變化
光鏡和相差顯微鏡顯示,Control組SH-SY5Y細胞大小均勻、透亮;NaF組壞死的SH-SY5Y細胞明顯增多,細胞狀態較差,存活細胞數下降;NaF聯合NaHS組細胞則細胞活性及數量與Control組無異(圖2)。透射電鏡顯示Control組SH-SY5Y細胞形態規則,亞細胞結構完好、線粒體豐富、細胞染色質分布均勻;NaF組SH-SY5Y亞細胞結構模糊不清,大量線粒體灰白色,呈空泡樣變性(圖3),這些異常形態和結構的紊亂可被NaHS預處理所預防。

注:箭頭顯示不同處理后的細胞狀態。圖2 NaHS和NaF對SH-SY5Y細胞生長的影響(200×)Fig.2 Effects of NaHS and NaF on SH-SY5Y cell growth(200×)

Control組 NaF組 NaF聯合NaHS組注:箭頭表示線粒體。圖3 透射電鏡顯示NaHS和NaF對細胞超微結構的影響(4 000×)Fig.3 Effects of NaHS and NaF on the ultrastructure of SH-SY5Y cells shown by transmission electron microscopy(4 000×)
2.3 ROS水平
NaF組SH-SY5Y細胞ROS水平分別高于Control組和NaF聯合NaHS組,差異均有統計學意義(P<0.05或P<0.01);但Control組和NaF聯合NaHS組SH-SY5Y細胞ROS水平比較,差異無統計學意義。見圖4。

注:A、B、C為細胞ROS熒光圖像,D為ROS水平的定量結果;(1)與Control組相比,P<0.01;(2)與NaF組相比,P<0.05。圖4 NaHS和NaF對SH-SY5Y細胞ROS水平的影響Fig.4 Effects of NaHS and NaF on the levels of ROS in SH-SY5Y cells
3 討論
有報道,CCK-8檢測30、40和80 mg/L NaF暴露24 h可抑制SH-SY5Y細胞活力[10],與本實驗臺盼藍染色所測細胞活力受到氟抑制結果相一致,不同之處在于實驗所測細胞活力方法不同;另外,本實驗使用細胞氟的濃度和時間分別是2 mmol/L和48 h;2 mmol/L相當于80 mg/L這一高劑量,時間更長相對損害要大活力下降到一半,而其他實驗室80 mg/L NaF暴露24 h細胞活力下降至69%[10]。在有些實驗室,動物實驗使用100 mg/L含氟飲用水2個月制造慢性氟中毒大鼠模型,模擬人類地方性氟暴露地區的情況,尼氏染色結果發現氟對大鼠腦神經元形態及學習記憶行為同樣造成損害[11]。
研究發現,氟抑制細胞呼吸和線粒體三磷酸腺苷(adenosine triphosphate,ATP)的生成[12]。線粒體不僅作為細胞能量工廠,還參與氧化還原平衡、鈣儲存和信號傳遞、調節程序性細胞死亡,決定細胞的存活[13]。有報道,慢性氟中毒動物神經細胞密度降低、細胞膜內卷、線粒體腫大、堆積、核固縮、空泡變性、突觸間隙融合或增寬、結構模糊不清[14-16]。本實驗中SH-SY5Y染氟細胞也出現亞細胞結構模糊不清,線粒體空泡變性。
H2S不僅被哺乳動物細胞線粒體當能量物質使用[17],而且它還可以穩定線粒體膜電位,阻止細胞色素C的釋放、Caspase-9/3的激活和聚二磷酸腺苷核糖聚合酶的裂解來阻斷魚藤酮誘導的細胞凋亡發生[18-19]。臨床及動物實驗發現,燃煤型地方性氟中毒患者內源性H2S水平顯著下降,大鼠腦組織胱硫脒-β-合成酶(cystathionine β-synthetase,CBS)酶活性受到抑制,CBS蛋白表達代償性增加[20-21]。這些結果表明,氟中毒已顯著影響了機體內源性CBS/H2S的水平。由于H2S這種能量物質在線粒體中的缺乏可能引起神經細胞線粒體等亞細胞形態、結構的損傷,而補充H2S可拮抗氟誘導的細胞毒性效應、逆轉以上形態和結構的紊亂。
氧化應激是氟損傷發病機制得到廣泛認可的一個重要機制[22]。氟中毒可導致線粒體ROS的產生造成大分子的氧化,導致線粒體膜磷脂受到自由基攻擊、DNA碎裂、核染色質濃縮和細胞凋亡[23-24]。本實驗中,NaF暴露48h細胞活性氧較Control組明顯增加(P<0.01)。
H2S能夠促進線粒體生物能量生成和功能,因此可以抵抗細胞應激;不僅能提高線粒體谷胱甘肽水平、清除ROS,還能進行蛋白質轉錄后修飾[7-9, 25]。本實驗NaHS預處理后可顯著拮抗氟所致ROS水平的增加,表明H2S可以抑制細胞高氟引起的氧化應激水平增加,發揮一定保護作用。盡管本實驗初步表明,H2S對氟損傷的神經細胞的保護作用涉及抗氧化這一途徑。然而,H2S降低線粒體ROS、改善染氟細胞形態和功能的詳細過程還有待進一步證實。

