胃鏡活檢不同部位病理組織組合的價值分析
宋紅杰 馮鵬飛 付雪琴 唐建榮
國內胃癌的發病率現僅次于肺癌居第2位,胃癌的詳細發生發展機制現階段雖尚未完全闡明,但普遍認為可能致病因素為幽門螺桿菌(H.pylori)感染,進程依次為淺表性胃炎、慢性萎縮性胃炎、腸化生(胃黏膜腸上皮細胞化生)、異型增生、黏膜內癌、侵襲性癌,其中胃黏膜萎縮、腸化生均存在癌變的可能[1]。準確評估并嚴密監測胃黏膜的炎癥程度是降低胃癌發病率及改善患者預后的關鍵。內鏡及內鏡下胃黏膜活檢組織病理學檢查(簡稱活檢)是當前診斷胃黏膜病變的金標準,活檢取材的部位與數量起著決定性作用[2]。與此同時,胃炎評價標準(operative link for gastritis assessment,OLGA)和胃黏膜腸化生評價標準(operative link for gastric intestinal metaplasia assessment,OLGIM)分期系統均依據新悉尼系統推薦的活檢取材要求進行胃黏膜萎縮、腸化生程度及范圍的綜合評估,即于胃體大彎(A1)、胃體小彎(A2)、胃角(B1)、胃竇大彎(C1)、胃竇小彎(C2)5個部位進行取材,能夠較為準確地預測胃癌發生風險[3-4]。胃鏡下活檢取材的部位越多,毫無疑問評價胃黏膜病變的準確性就越高,但取5個部位的活檢組織不但所需費用高,而且由此帶來的潰瘍創面也不可忽視,故多應用于臨床研究,難以在臨床實踐中推廣[5]。基于此,本研究致力于分析胃黏膜不同部位病變情況,以期尋求較少的組織活檢取材組合,達到與標準取材數量活檢結果接近的胃黏膜病變篩查方法,繼而為臨床實際篩查診斷提供借鑒。
1 資料與方法
1.1 一般資料 回顧性分析2017年5月至2019年4月河南省駐馬店市中心醫院245例行胃鏡檢查患者的臨床資料,其中男性128例,女性117例;年齡24~75歲,平均(47.03±10.20)歲;長期吸煙(煙齡≥5年)71例(28.98%);有飲酒史94例(38.37%);有胃癌家族史6例(2.45%);H.pylori陽性105例(42.86%);初診癥狀包括上腹不適、反酸、噯氣、胞脹等,依據胃炎新悉尼系統標準[6],本次胃鏡檢查結果提示慢性非萎縮性胃炎109例(44.49%),萎縮性胃炎136例(55.51%)。納入標準:①年齡≥18歲;②有明顯的消化道癥狀,結合病史擬診為胃黏膜病變;③自愿接受無痛胃鏡檢查,簽署同意書;④臨床檢查、診治資料詳實。排除標準:①已確診的胃癌、胃泌素瘤、非甾體類抗炎藥相關性潰瘍;②有胃部手術史;③心、肺、腦、肝、腎等重要臟器功能不全;④內鏡檢查未完成或內鏡活檢取材不完全(新悉尼系統推薦的活檢取材的5個部位);⑤胃鏡檢查前1個月內曾服用抗生素或抗凝藥;⑥合并認知功能障礙或精神疾病。
1.2 方法
1.2.1 活檢取材與胃鏡檢查 所有患者均行普通無痛胃鏡檢查,儀器為日本Olympus公司普通高清白光胃鏡,采用一次性活檢鉗,胃鏡操作均由本院資深內鏡醫師完成。每例患者嚴格結合新悉尼系統取5塊病理組織,即分別位于胃體大彎(A1)、胃體小彎(A2)、胃角(B1)、胃竇大彎(C1)、胃竇小彎(C2)處。取得不同部位的組織標本后分裝、固定于10%甲醛溶液中,并以石蠟包埋處理。
1.2.2 組織病理學檢查 病理組織切片由主治醫師職稱以上的病理科醫師操作,采用免疫組化染色、PAS染色法判斷胃黏膜萎縮、腸化生及H.pylori感染情況。①結合胃炎新悉尼系統標準[6]對每塊活檢組織按直觀模擬評分進行萎縮程度、腸化生程度評估,均為4級評分;萎縮程度:無萎縮(胃固有腺體無減少)記0分,萎縮輕度(胃固有腺體減少不超過1/3)、中度(胃固有腺體減少1/3~2/3)、重度(胃固有腺體減少超過2/3)分別記1分、2分、3分;腸化生程度:無腸化生(腺體未發生腸化生)記0分,輕度腸化生(腸化生面積不超過腺體、表面上皮總面積的1/3)、中度(腸化生面積占比為1/3~2/3)、重度(腸化生面積占比超過2/3)分別記1分、2分、3分。②根據胃竇、胃角及胃體黏膜的萎縮程度與腸化生程度評分結果,結合OLGA、OLGIM分期系統[7]進行分期。以A1、A2、B1、C1、C2共5處病理活檢為金標準,評價其他病理組織組合進行OLGA、OLGIM分期判定的效果,組合方式包括4處、3處及2處病理活檢,其中無論何種組合均至少保證胃體部位(A1或A2)和胃竇部位(B1或C1或C2)各有1處。
1.3 統計學方法 采用SPSS 19.0統計學軟件進行數據處理,計數資料以例或率描述,采用χ2檢驗;病理活檢金標準OLGA與OLGIM分期的一致性,4處、3處、2處病理組織組合檢查與金標準檢查對OLGA與OLGIM分期的一致性均通過Kappa一致性檢驗;以P<0.05為差異有統計學意義。
2 結果
2.1 不同部位胃黏膜萎縮及腸化生情況 C2部位黏膜萎縮、腸化生發生率均高于A1部位(χ2=12.695,42.194,P均<0.001)、A2部位(χ2=19.923,49.500,P均<0.001)和C1部位(χ2=4.035,5.176,P=0.045,0.016),差異均有統計學意義;B1部位黏膜萎縮、腸化生發生率高于A1部位(χ2=22.565,31.443,P均<0.001)、A2部位(χ2=7.795,8.836,P均<0.05),差異有統計學意義;A2部位、C1部位黏膜萎縮、腸化生發生率高于A1部位,差異有統計學意義(χ2=4.213,7.822,P均<0.05;χ2=23.436,18.981,P均<0.001)。見表1。
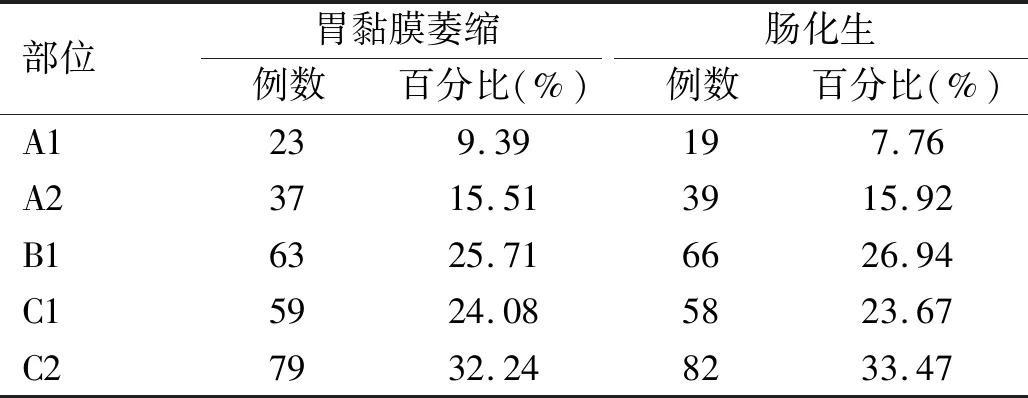
表1 不同部位胃黏膜萎縮及腸化生程度(n=245)
2.2 病理活檢金標準OLGA與OLGIM分期的一致性 A1、A2、B1、C1、C2共5處病理組織活檢(金標準)患者的OLGA分期與OLGIM分期一致性為94.29%(95%CI為90.20%~96.73%,Kappa值0.944,P<0.001)。見表2。

表2 病理活檢金標準OLGA與OLGIM分期的一致性(例)
2.3 不同病理組織組合檢查與OLGA分期的一致性 4處病理組織組合中,C2+B1+A2+A1組合與金標準活檢OLGA分期一致性最高,一致性為92.24%(95%CI為88.16%~93.88%,Kappa值0.917,P<0.001),漏診2例高危(Ⅲ期、Ⅳ期)患者,漏診率0.82%;3處病理組織組合中,C2+B1+A2組合與金標準活檢OLGA分期一致性最高,一致性為90.20%(95%CI為87.34%~93.88%,Kappa值0.902,P<0.001),漏診3例高危患者,漏診率1.22%;2處病理組織組合中,C2+A2組合與金標準活檢OLGA分期一致性最高,一致性為81.22%(95%CI為75.51%~84.89%,Kappa值0.796,P<0.001),但有9例高危漏診,漏診率3.67%。見表3。

表3 不同病理組織組合檢查與OLGA分期的一致性(例)
2.4 不同病理組織組合檢查與OLGIM分期的一致性 4處、3處、2處病理組織組合中與金標準活檢OLGIM分期一致性最高的組合分別為C2+B1+A2+A1、C2+B1+A2、C2+A2,一致性分別為92.65%(95%CI為89.38%~94.69%,Kappa值0.922,P<0.001)、90.61%(95%CI為86.93%~93.06%,Kappa值0.907,P<0.001)、79.59%(95%CI為73.89%~83.26%,Kappa值0.746,P<0.001),C2+B1+A2+A1、C2+B1+A2漏診1例和3例,C2+A2有11例高危漏診,漏診率分別為0.41%、1.22%、4.49%。見表4。

表4 不同病理組織組合檢查與OLGIM分期的一致性(例)
3 討論
由胃腸病專家和病理學專家組成國際萎縮研究小組于2005年提出了OLGA、OLGIM分期系統,二者將病變嚴重程度的病理評分與病變在胃黏膜的分布范圍進行緊密結合,0~Ⅱ期、Ⅲ~Ⅳ期分別提示胃癌低、高風險,通過明確胃黏膜病變分期可實現胃黏膜癌變風險的評估[8-9]。近年來,大量薈萃報道[10-12]論證了OLGA、OLGIM分期的科學性與可行性,且2017年《中國慢性胃炎共識意見》[13]也對此分期系統進行了推薦。本研究“金標準”活檢結果顯示,OLGA分期與OLGIM分期一致性達94.29%,進一步證實胃黏膜病變嚴重程度與病變分布范圍具有一致性。值得關注的是,新悉尼系統推薦的活檢取材的要求涉及5個部位的病理組織,由此帶來的高人工潰瘍發生率及醫療費用使其臨床實際推廣較難。
為此,本研究推測減少活檢取材或許亦可取得相對理想的篩查診斷效果,首先獲取245例嚴格結合新悉尼系統取5塊(A1、A2、B1、C1、C2)病理組織行胃鏡檢查患者的診斷資料,結果顯示C2部位黏膜萎縮、腸化生發生率最高,明顯高于A1、A2和C1部位;其次為B1部位,黏膜萎縮、腸化生發生率明顯高于A1、A2部位,A2、C1部位黏膜萎縮、腸化生發生率明顯高于A1部位,提示為了盡早發現更多的病變,活檢時應優先考慮胃竇小彎、胃角部位,且活檢時取材于胃體小彎相較于胃體大彎、胃竇大彎更有利于提高胃黏膜萎縮程度檢測的準確性。分析可能原因為,在胃黏膜炎性反應發展過程中,H.pylori相關性胃炎或功能性消化不良患者的胃竇小彎和胃角是萎縮和腸化生轉變發生最早的部位[14]。既往研究[15-16]指出,胃黏膜病變是一個慢性遷延發展的過程,胃黏膜萎縮、腸化生病變均從胃竇小彎、胃角開始產生,并沿小彎側蔓延,隨后逐步蔓延至前后壁、胃竇大彎最終至胃體大彎,從而引起全胃萎縮和腸化生。
本研究以新悉尼系統建議的5塊病理組織確定的OLGA與OLGIM分期為金標準,對比4處、3處、2處病理組織組合判斷此分期系統的一致性,結果4處、3處、2處病理組織組合中與金標準活檢OLGA、OLGIM分期一致性最高的組合分別為C2+B1+A2+A1(Kappa值0.917,0.922)、C2+B1+A2(Kappa值0.902,0.907),C2+A2(Kappa值0.796,0.746),提示此3種組合均可取得較為準確的病理診斷,但C2+B1+A2+A1、C2+B1+A2組合判斷OLGA、OLGIM分期與“金標準”的一致性更佳,且前者對高危患者漏診率為0.82%、1.22%,后者為0.41%、1.22%,提示此2種不同部位病理組合對高危患者漏診風險低。張夢等[17]的研究結果與本研究類似,認為相較于C2+B1+A2組合,C2+B1+A2+A1組合多取1塊組織進行活檢后期一致性提高水平有限,因而此3處病理組織組合更值得推薦。而宮健康等[18]的報道顯示,4處(胃竇大彎和小彎、胃體小彎、胃角)取材組合活檢漏診風險極低,且與“金標準”的一致性達99.0%和98.1%,相對于一致性為93.5%、93.1%的3處病理組織活檢明顯高,雖然與本研究結果存在一定出入,這可能由入選樣本量及患者的個體病變差異所致,但最終結論均更認可C2+B1+A2組合。此外,需指出的是,相較于OLGA分期,OLGIM分期評估胃黏膜病變的重復性更好,原因在于萎縮判定有主觀性,腸化生易于識別,故在臨床試劑診斷中建議優先考慮以胃竇小彎+胃角+胃體小彎組合活檢判斷OLGIM分期。
綜上所述,活檢時建議優先取胃竇小彎、胃角部位組織;鑒于胃竇小彎+胃角+胃竇大彎+胃體小彎組合取材數量多,風險和費用高,胃角+胃體小彎取材診斷準確性偏低、高危患者漏診風險高,認為選擇胃竇小彎+胃角+胃體小彎組合活檢判斷胃黏膜病變OLGA、OLGIM分期更合理。

