老年直腸癌保肛術后出現低位前切除綜合征風險預測模型的建立
鄭利
直腸癌是肛腸科常見的惡性腫瘤之一,近年來發病率有逐年增高趨勢,老年人是其好發人群。而隨著直腸癌多學科規范化診治的推廣,直腸癌治療效果較過去得到明顯改善,其5年生存率可達70%左右[1]。隨之而來除了患者對療效的需求外,保留完美肛門外觀的主觀訴求亦逐漸增加,因此接受保肛手術的患者數量越來越多[2]。低位前切除綜合征(low anterior resection syndrome,LARS)是直腸癌術后常見并發癥,本質上屬于主觀不適癥候群,常見癥狀包括排便失禁、次數增多,并伴有急迫感,給患者術后生活帶來極大不便[3]。為此,回顧性收集近年來我院收治的老年直腸癌病例,旨在建立術后LARS風險預測模型。現報告如下。
1 資料與方法
1.1 一般資料 回顧性收集2017年1月至2019年12月我院收治的老年直腸癌患者346例,直腸癌診斷參照《外科學》相關標準,全部患者均確診為惡性占位病變[4]。納入標準:年齡≥65歲;術前臨床分期Ⅰ~Ⅱ期;采用保肛手術方式治療;術后病理證實為直腸癌;術后未出現除LARS之外其他并發癥[5]。排除標準:合并其他結直腸器質性疾病;合并導致自主神經功能紊亂的疾病;長期服用影響腸道蠕動能力的藥物;與本研究有關的臨床資料不全者[6]。在剔除72例不合格病例后,本研究最終納入274例。
1.2 研究方法 依據患者是否出現LARS分為觀察組104例(LARS組,占37.96%)和對照組170例(非LARS組,占62.04%)。收集兩組患者的一般資料,如性別、年齡、體重指數(BMI);術前診斷,如腫瘤位置、病理類型、臨床分期;治療方案,如術前放療、手術方式、吻合口位置、術后恢復時間;骨盆形態學參數,如骨盆出口前后徑、坐骨結節間徑、坐骨棘間徑、骨盆入口前后徑、骶尾骨間徑。對兩組患者的各項數據進行比較,篩選發生LARS的危險因素,此基礎上建立LARS風險預測模型并對預測效能進行評價。
1.3 統計學方法 采用EpiData 2.4版本軟件錄入數據并建立數據庫,以SAS 10.0版本軟件進行分析。連續性計量資料以(±s)表示,組間比較采用t檢驗;非連續型計數資料以構成比表示,組間比較采用χ2檢驗;危險因素分析采用多元Logistic回歸分析法;風險預測模型效能評價采用受試者工作特征(ROC)曲線法。本研究檢驗水準統一設定為α=0.05。
表1 兩組患者各項數據單因素比較[n,(±s)]
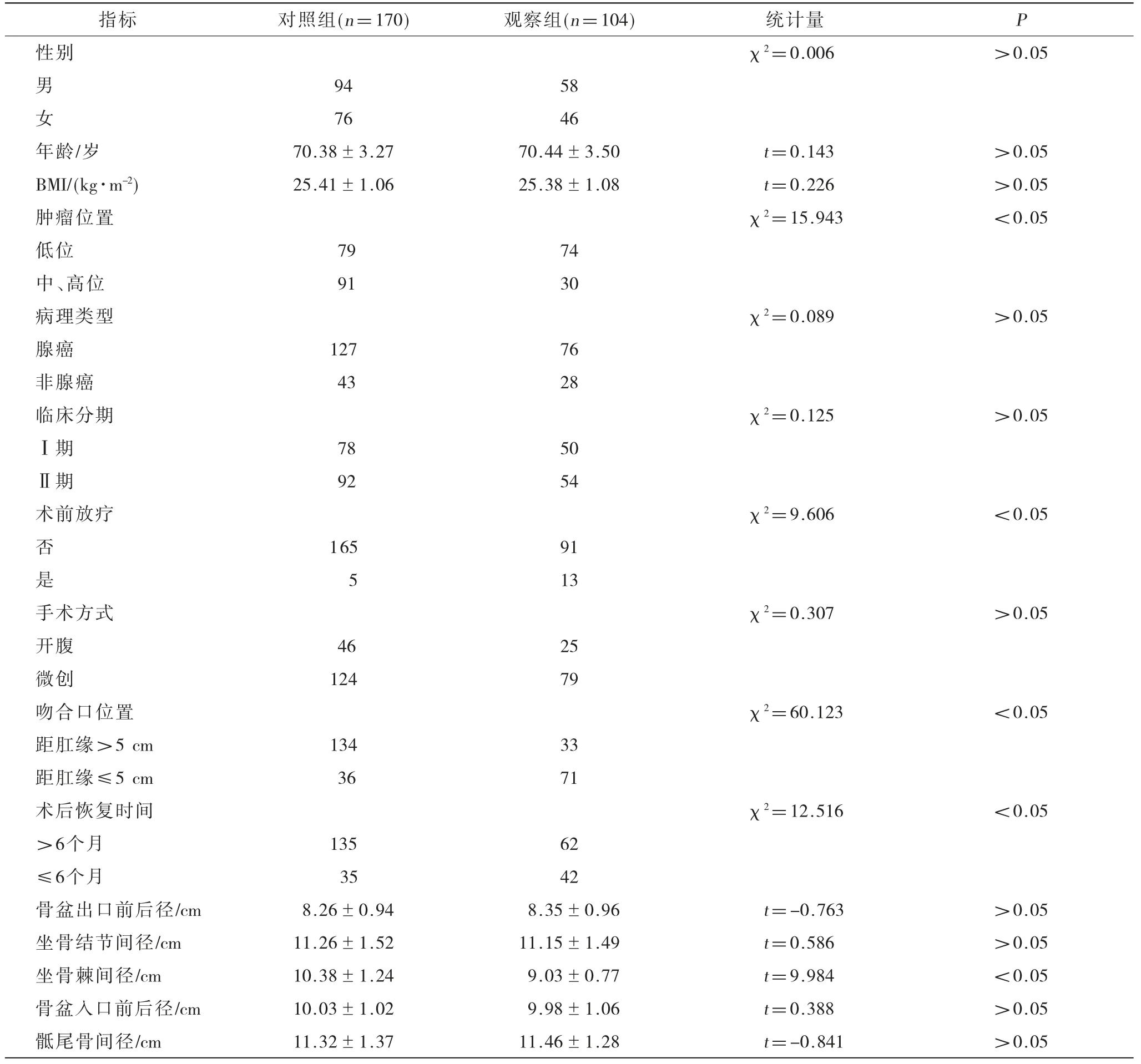
表1 兩組患者各項數據單因素比較[n,(±s)]
?指標對照組(n=170)觀察組(n=104)統計量P性別χ2=0.006>0.05男9458女7646年齡/歲70.38±3.2770.44±3.50t=0.143>0.05 BMI/(kg·m-2)25.41±1.0625.38±1.08t=0.226>0.05腫瘤位置χ2=15.943<0.05低位7974中、高位9130病理類型χ2=0.089>0.05腺癌12776非腺癌4328臨床分期χ2=0.125>0.05Ⅰ期7850Ⅱ期9254術前放療χ2=9.606<0.05否16591是5 13手術方式χ2=0.307>0.05開腹4625微創12479吻合口位置χ2=60.123<0.05距肛緣>5 cm13433距肛緣≤5 cm3671術后恢復時間χ2=12.516<0.05>6個月13562≤6個月3542骨盆出口前后徑/cm8.26±0.948.35±0.96t=-0.763>0.05坐骨結節間徑/cm11.26±1.5211.15±1.49t=0.586>0.05坐骨棘間徑/cm10.38±1.249.03±0.77t=9.984<0.05骨盆入口前后徑/cm10.03±1.029.98±1.06t=0.388>0.05骶尾骨間徑/cm11.32±1.3711.46±1.28t=-0.841>0.05
2 結果
2.1 兩組患者各項數據單因素比較 對兩組患者各項數據進行比較后發現,兩組患者腫瘤位置、術前放療、吻合口位置、術后恢復時間和坐骨棘間徑差異有統計學意義(P<0.05)。這說明低位直腸癌、術前接受放療、吻合口距肛緣近、術后恢復時間短和坐骨棘間徑小的老年直腸癌保肛手術患者術后易出現LARS,見表1。
2.2 LARS的多因素回歸分析 多因素Logistic回歸分析顯示,腫瘤位置、術前放療、吻合口位置、術后恢復時間和坐骨棘間徑是老年直腸癌保肛手術患者術后出現LARS的獨立危險因素(P<0.05),見表2。
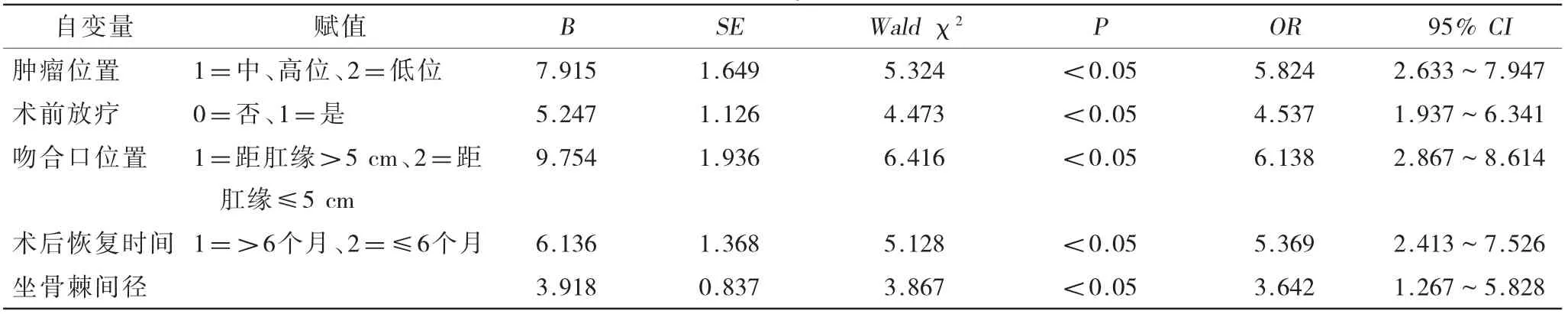
表2 LARS的多元Logistic回歸分析結果
2.3 LARS風險預測模型的建立和評價 將腫瘤位置(X1)、術前放療(X2)、吻合口位置(X3)、術后恢復時間(X4)和坐骨棘間徑(X5)的偏回歸系數分別定義為β1、β2、β3、β4、β5,以β1作為相對參數,構建聯合預測因子(F),F=(β1/β1)X1+(β2/β1)X2+(β3/β1)X3+(β4/β1)X4+(β5/β1)X5,即F =X1+0.663X2+1.232X3+0.775X4+0.503X5。經采用ROC曲線顯示,聯合預測指標的曲線下面積、敏感度、特異度均優于單一危險因素指標,見表3。
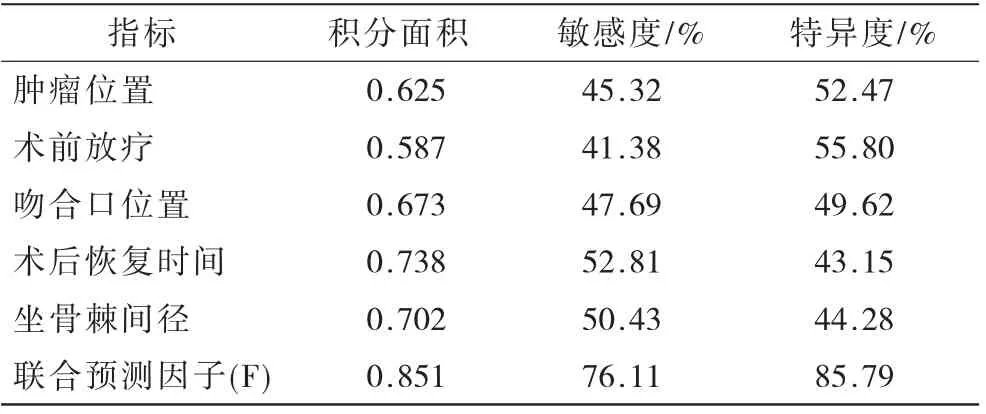
表3 聯合預測因子的風險預測效能
3 討論
LARS是保肛手術常見的并發癥之一,目前尚無針對性有效治療手段,臨床上多數以康復理療和飲食調整為主。盡管多數LARS癥狀會在術后1年內消失,但是其出現仍給患者生活帶來極大不便。尤其是對于老年人來說,由于其盆底承受能力下降,相比于其他年齡段群體術后更容易出現LARS[7]。因此,從臨床獲益角度來說應該在術前對患者出現LARS的風險進行預測,根據預測結果調整術后方案具備一定現實應用價值,這也是本研究的初衷。
本研究中,我們回顧性收集了274例老年直腸癌行保肛手術病例,其中104 例(占37.96%)出現LARS,與吳國舉等[8]的研究結果接近。首先,我們通過多因素回歸分析篩選LARS的相關危險因素。①低位直腸癌:該位置腫瘤被切除后,由于吻合口距離肛門較勁,因此術后吻合處張力較大,因此容易發生LARS。②術前接受放療:放療屬于一種創傷性治療手段,射線照射本身會對直腸周圍組織造成傷害,短期內由于照射區域內組織順應性降低,加之盆腔自主神經受照射和手術的雙重損傷,因此易發生LARS。③吻合口距肛緣近:有研究認為,吻合口與肛緣距離比低位腫瘤更容易導致LARS,這主要是由于吻合口越低手術時需要分離的組織越多,導致吻合口處損傷越大,LARS的發生風險隨之升高[9]。④術后恢復時間短:有研究認為,LARS隨著時間的推移癥狀會逐漸減輕,尤其是在6個月后LARS評分會較之前明顯降低,考慮其與肛門括約肌功能自我緩慢恢復有關[10]。⑤坐骨棘間徑小:對于直腸癌手術來說,術中操作空間小肛門括約肌及盆腔神經叢損傷風險增加,術后容易因去神經支配導致LARS出現并長期存在。在篩選出導致LARS的獨立危險因素后,我們進一步建立基于獨立危險因素的風險預測模型,并對其預測效能進行評價。結果顯示,風險預測模型的曲線下面積、敏感度和特異度均令人滿意,風險預測模型具備相當的應用價值。
然而,本研究亦存在不足之處,即研究深度優先未篩選出更多的風險預測因子,該風險預測模型涵蓋面仍較小,這有待在未來開展更為深入的研究來解決。

