核酸適配體sgc8 在急性白血病診斷中的應用研究
徐康力,馬亞妮,王筱金,苗彥彥,韓 達#,譚蔚泓#
1.上海交通大學醫學院附屬仁濟醫院分子醫學研究院,上海200127;2.上海交通大學醫學院附屬上海兒童醫學中心,衛生部兒童血液腫瘤重點實驗室,上海200127;3.上海交通大學醫學院臨床研究中心生物統計學教研室,上海 200025
急性白血病(acute leukemia,AL)是一類起源于造血系統的惡性疾病,主要包括急性髓系細胞白血病(acute myeloid leukemia,AML)和急性淋巴細胞白血病(acute lymphoblastic leukemia ,ALL),成人主要罹患AML,而兒童主要罹患ALL[1]。AL 的病死率較高[2],是一類對人類健康威脅較大的疾病。
多色流式細胞術具有高通量、高靈敏度、低檢測限等特點,是對白血病進行免疫分型和微小殘留病(MRD)監測的重要方法[3-4]。該方法主要用于尋找腫瘤細胞的特征性標志物,然而并非每個患者都能利用現有的抗體組合找到,而即便有特征性的抗原表達,也可能存在抗原漂移現象,即腫瘤細胞的免疫表型可能會在疾病發展過程中發生變化導致無法追蹤[3,5],但可通過增加抗體的數量來降低這種不利影響[6]。因此,許多新型抗體被開發出來用于流式細胞術的AL 診斷[7]。然而,這些抗體的數量有限,并且從發現到應用的周期很長,如用于AML 診斷的免疫分型抗體組合在過去20 年幾乎沒有改變,限制了流式細胞術在AL 診斷中的應用[7]。
核酸適配體是一類人工篩選、合成、可修飾的寡核苷酸鏈,它通過形成特定的空間結構與靶分子或目標細胞結合,具有類似抗體的特異性[8]。利用指數富集配體系統進化(systematic evolution of ligand and by exponential enrichment,SELEX)技術,可以將核酸適配體的篩選與生產時間控制在2 ~8 周,而抗體的生產時間長達6 個月以上,因此它代表了一種能夠快速開發針對靶標的新型配體技術[9-11]。與抗體相比,篩選出的核酸適配體具有化學性質穩定、批間差異小、易于修飾、生產成本低等優點,在多種診斷研究中備受關注[9]。Shangguan 等[12]利用細胞之間抗原表達的差異,篩選出具有T-ALL 細胞株CEM 細胞特異性的核酸適配體sgc8,其靶標為蛋白酪氨酸激酶7(protein tyrosine kinase,PTK7)[13-16]。Yu 等[14]利 用sgc8開發了一種高靈敏檢測器用于白血病早期診斷。Mironov等[15]用金屬同位素標記sgc8,用于質譜流式細胞術對白血病細胞的檢測。然而尚未見將核酸適配體作為診斷工具,直接用于流式細胞術對AL 樣本檢測的報道。本研究利用核酸適配體sgc8 在流式細胞儀上直接對AL 骨髓樣本進行檢測,以研究其對不同骨髓細胞群的識別能力,探究sgc8 在急性白血病診斷中的應用價值。
1 材料與方法
1.1 研究對象
人急性T 淋巴細胞白血病(T-ALL)細胞株CEM 細胞及人慢性髓系細胞白血病(chronic myeloid leukemia ,CML)細胞株K562 細胞購于中國科學院細胞庫。白血病骨髓樣本來自上海交通大學醫學院附屬上海兒童醫學中心,保存于肝素抗凝管中,骨髓樣本獲取和使用符合醫院倫理委員會要求。共收集4 組共83 例樣本,包括AML 樣本45 例、T-ALL 樣本19 例、B-ALL 樣本9 例,正常樣本10 例。所有樣本均進行了骨髓形態學分析和流式細胞白血病免疫分型鑒定。本研究經上海交通大學醫學院附屬仁濟醫院倫理委員會批準(編號:RA-2019-070)。
1.2 試劑與儀器
清洗液[ 含有4.5 g/L 葡萄糖及5 mmol/L MgCl2的杜氏磷酸緩沖液(Dulbecco's phosphate-buffered saline,DPBS) ],結合緩沖液[含有0.1 mg/mL 酵母轉移核糖核酸(tRNA)及1 mg/mL 牛血清白蛋白(BSA)的清洗液],均由實驗室配制。Gibco DPBS(1×)、Gibco RPMI-1640 培養基、胎牛血清(fetal bovine serum,FBS)均購自美國Thermo Fisher 公司。離心管、細胞培養瓶、一次性移液管均購自美國Corning 公司。單克隆抗體CD7 PE(phycoerythrin)、CD45 PerCP(peridinin-chlorophyllprotein complex)、CD19 APC(allophycocyanin)、CD33 APC、CD34 APC、IgG1 APC、HLA-DR APC-H7(allophycocyanin-Hilite?7)、細胞裂解液BD Pharm LyseTMLysing Buffer(主要成分為NH4Cl 溶液)以及流式細胞儀 BD FACS Canto II 購自美國BD 公司;單克隆抗體PTK7 APC 購自德國Miltenyi 公司;MgCl2溶液(濃度為1 mol/L)、葡萄糖、BSA 均購自美國Invitrogen 公司。酵母tRNA 購自上海邁基生物技術有限公司;離心機和微量加樣槍購自德國Eppendorf 公司;血細胞計數板購自上海市求精生化試劑儀器有限公司;3D 混勻器購自江蘇海門其林貝爾儀器制造有限公司 。
1.3 研究方法
1.3.1 核酸適配體的合成、保存及使用 核酸適配體sgc8 及其對照隨機文庫鏈(Lib)的核酸序列見表1。核酸適配體經5-羧基熒光素(5-carboxyfluorescein,FAM)標記,由生工生物工程(上海)股份有限公司合成。合成產物為粉末狀,用三蒸水將其溶解成濃度為10 μmol/L 的溶液,并根據使用量進行分裝,分裝的核酸適配體溶液保存于-20 ℃冰箱內,使用全程避光。

表1 適配體的核酸序列Tab 1 Aptamer nucleic acid sequence
1.3.2 白血病細胞株的培養及其與核酸適配體、PTK7 抗體的結合試驗 CEM 和K562 細胞均培養在含有10% FBS的 1640 培養基中,培養條件為 37 ℃、5% CO2。取培養的細胞,用清洗液洗滌2 次,離心條件為300×g5 min,再用結合緩沖液重懸,取3×105細胞加入EP 管中,再用結合緩沖液補足至194 μL 后,加入6 μL 10 μmol/L 核酸適配體溶液,使反應總體積為200 μL,核酸適配體終濃度為300 nmol/L。EP 管在4 ℃條件下置于3D 混勻器上避光孵育30 min 后,用清洗液洗滌2 遍,最后用200 μL 清洗液重懸,置于冰上避光,等待流式細胞儀檢測。
培養細胞洗滌后,用1×DPBS 溶液重懸后計數,取2×105細胞加入流式管中,再加入1 μL APC 標記的PTK7抗體,混勻后避光孵育15 min,用2 mL 1×DPBS 溶液洗滌1 遍后,離心沉淀用200 μL 1× DPBS 溶液重懸,置于冰上避光,等待流式細胞儀檢測。
1.3.3 骨髓樣本細胞與核酸適配體結合試驗 將模擬的白血病骨髓樣本細胞(白血病細胞CEM 或K562 分別與正常骨髓細胞,按照2:1 的比例混合)及不同組的骨髓樣本細胞計數后取一定量細胞,分別用1×紅細胞裂解液處理,室溫孵育15 min,300×g離心5 min 后,通過清洗液洗滌2 遍,去除紅細胞。獲得的骨髓有核細胞用結合緩沖液重懸,取3×105細胞加入EP 管中,再用結合緩沖液補足至188 μL,再加入6 μL 10 μmol/L 核酸適配體溶液及6 μL 骨髓樣本對應的骨架抗體組合(表2),使反應終體積為200 μL,核酸適配體終濃度為300 nmol/L。EP 管在4 ℃條件下置于3D 混勻器上避光孵育30 min 后,用清洗液洗滌2 次,去除未結合的抗體后,用200 μL 清洗液重懸,置于冰上等待。
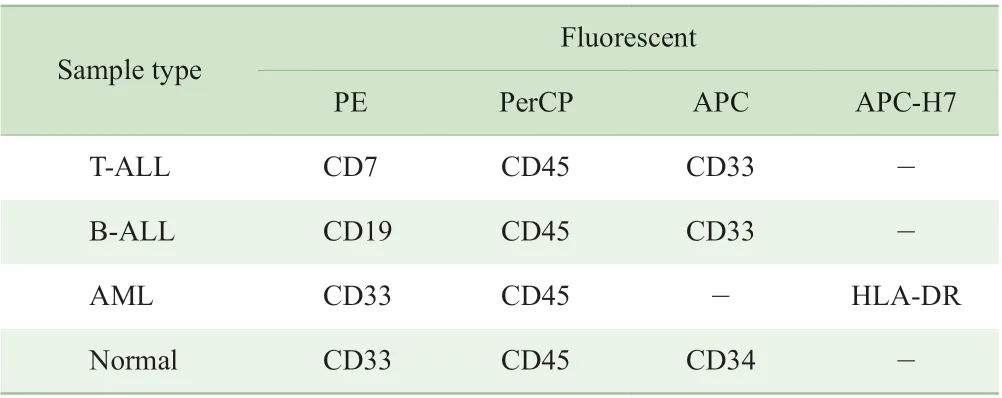
表2 不同骨髓樣本的骨架抗體組合Tab 2 Backbone antibody panels for bone marrow samples
1.3.4 流式細胞儀檢測與分析 用BD Canto II 流式細胞儀和BD FACS Diva 8.0 軟件獲取細胞,通過SSC/CD45 設門識別有核細胞:模擬及臨床急性白血病骨髓細胞樣本,收集有核細胞2 萬個;正常骨髓樣本,收集有核細胞5 萬個。流式細胞儀有3 種激光8 個通道,各通道設置的電壓和補償條件與臨床白血病免疫分型所采用的條件相同。BD FACS Diva 8.0 和Flowjo10.4 軟件進行流式細胞的數據分析。
因熒光素FAM 與異硫氰酸熒光素(FITC)發射光波長類似,收集的細胞經骨架抗體組合分群后,分別在含有核酸適配體sgc8 的實驗管(sgc8 管)及含有隨機文庫鏈Lib 的對照管(Lib 管)中,檢測其在FITC 通道中的信號。以細胞群在Lib 管的熒光信號為參照設置陽性門,使Lib 管中細胞群95%以上的細胞在該陽性門外,再記錄sgc8 管中陽性門內的細胞百分比。sgc8 結合陽性結果判斷標準:同一群細胞在sgc8 管與Lib 管內陽性門的百分比差值(d值) >20%。值得注意的是,同樣的標本在不同的檢測系統內,平均熒光強度(median fluorescence intensity,MFI)是不同的,不具備可比性,所以在本實驗中并未采用該值作為研究對象。
1.4 統計學分析
采用SAS 9.4 軟件對數據進行分析。定性數據用n(%) 表示,非正態分布的數據使用Kruskal-Wallis 檢驗。P<0.05認為差異有統計學意義。
2 結果
2.1 白血病細胞株PTK7 蛋白的表達水平
核酸適配體sgc8 識別的靶標為PTK7 蛋白[13],因此本研究使用了PTK7 蛋白高表達的CEM 細胞株和PTK7蛋白低表達的K562 細胞株。為了明確白血病細胞株CEM細胞和K562 細胞PTK7 蛋白的表達情況,本研究用PTK7抗體及同型對照對2 株細胞進行檢測。結果表明,CEM細胞高表達PTK7 蛋白,而K562 細胞低表達或不表達PTK7 蛋白(圖1)。
2.2 sgc8 對白血病細胞株的識別能力
為了研究核酸適配體檢測骨髓樣本方法的有效性,我們在正常骨髓細胞樣本中,分別加入PTK7 蛋白高表達的CEM 細胞及其陰性對照K562 細胞(PTK7 蛋白低表達),制成模擬的白血病骨髓樣本,來探究核酸適配體sgc8 在骨髓樣本中對2 種細胞是否仍具有不同的識別能力。本研究按照核酸適配體對骨髓樣本的檢測流程,對樣本用紅細胞裂解液進行處理,去除紅細胞;然后,洗滌制成細胞懸液,再將其與核酸適配體、對應骨架抗體組合一起置于4 ℃冰箱避光孵育30 min,利用流式細胞儀對洗滌后的細胞懸液進行檢測(圖2)。
我們通過骨架抗體組合區分腫瘤細胞群與正常細胞群,并檢測它們在Lib 管和sgc8 管內FITC 通道信號偏移情況。我們發現,在加有CEM 細胞的骨髓樣本中,腫瘤細胞(CD7+CD33-CD45strongSSCmedium)在sgc8 管較Lib 管有明顯的信號偏移,而樣本內其他細胞未見明顯偏移(圖3)。 同時,在加有對照細胞K562 細胞的骨髓樣本中,腫瘤細胞(CD7-CD33+CD45strongSSCmedium)與其他正常細胞在sgc8 管較Lib 管均未見明顯偏移(圖4)。結果顯示:sgc8 可以在骨髓細胞樣本中特異性識別靶細胞CEM 細胞,而不識別對照細胞K562 細胞及其他成熟細胞群。結果提示,核酸適配體sgc8 在骨髓樣本中對2 種細胞仍具有不同的識別能力。
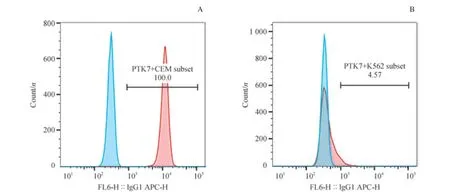
圖1 CEM 細胞與K562 細胞的PTK7 蛋白表達水平Fig 1 Expression level of PTK7 protein in CEM cells and K562 cells
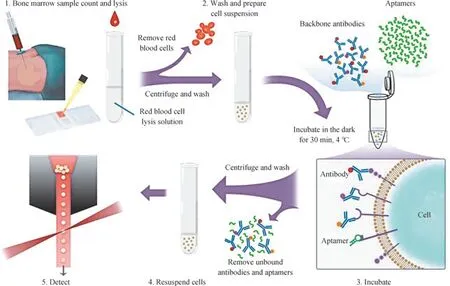
圖2 核酸適配體和抗體的骨髓樣本檢測流程Fig 2 Detection procedure of bone marrow samples using aptamers and antibodies
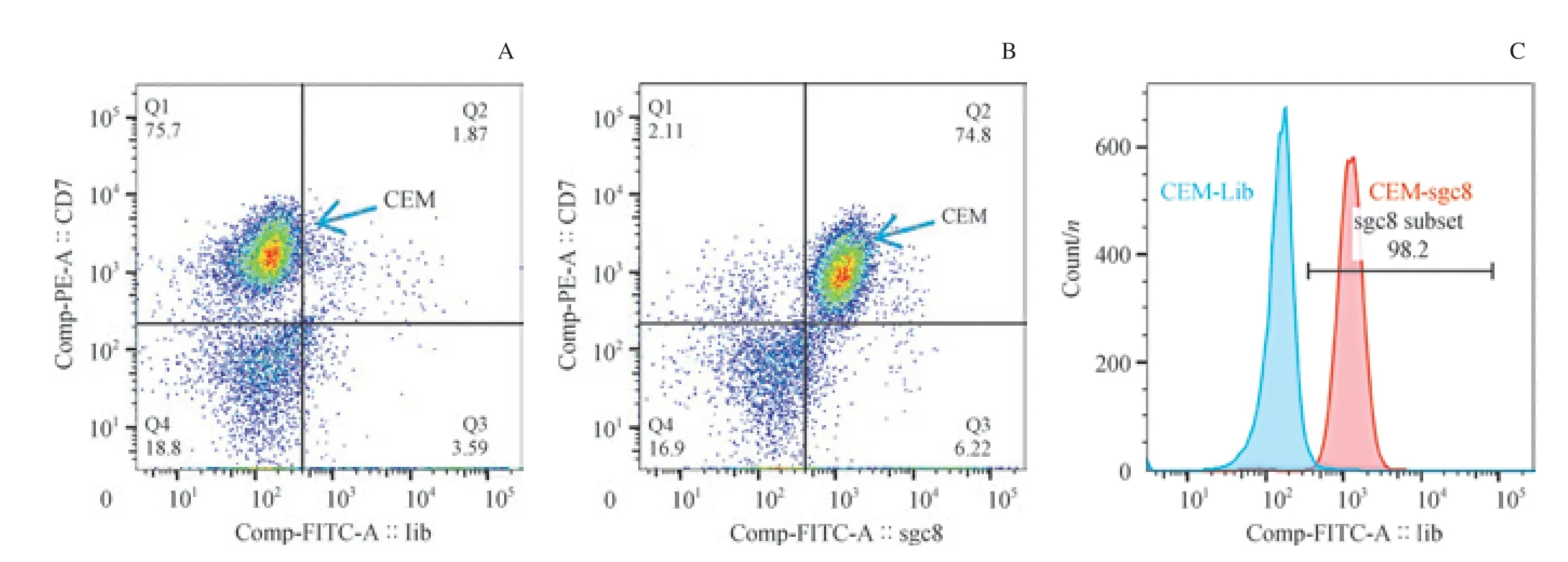
圖3 sgc8 在模擬白血病骨髓樣本中識別CEM 細胞的流式細胞術結果Fig 3 Recognition of sgc8 to CEM cells in the normal bone marrow sample mixed with CEM cells by flow cytometry
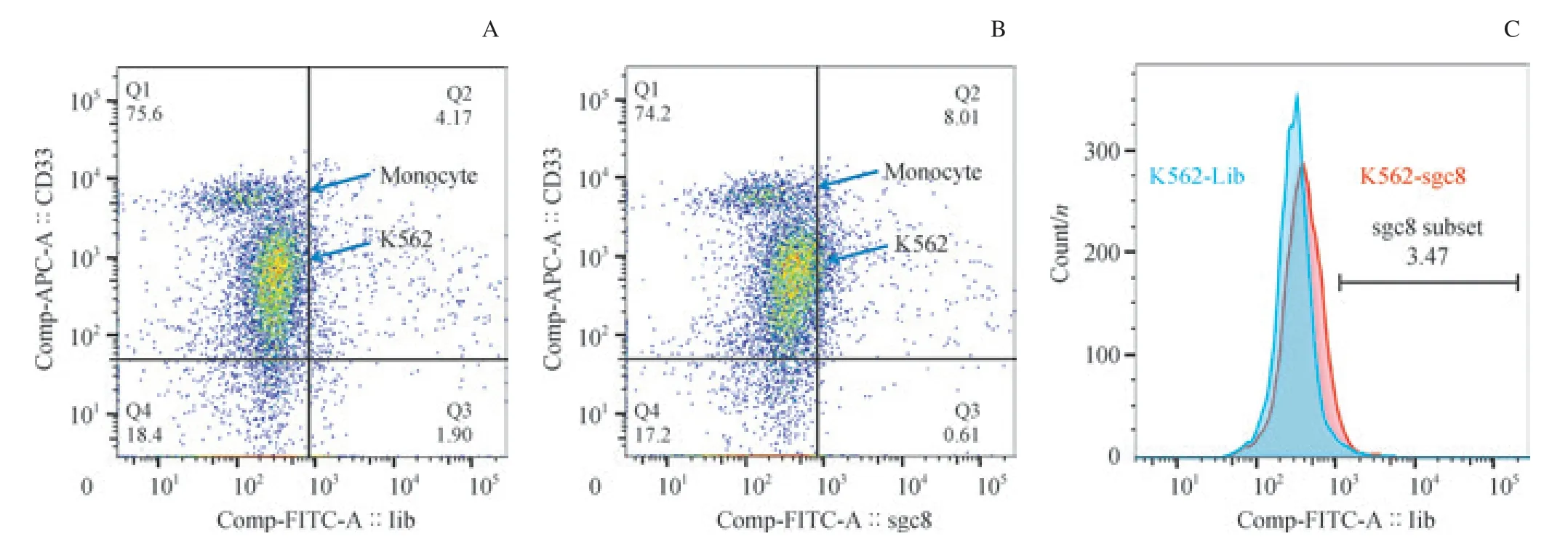
圖4 sgc8 在模擬白血病骨髓樣本中未識別K562 細胞的流式細胞術結果Fig 4 Recognition of sgc8 to K562 cells in the normal bone marrow sample mixed with K562 cells by flow cytometry
2.3 核酸適配體sgc8 對髓系原始細胞的特異性識別能力
本研究中,為了驗證sgc8 對正常骨髓樣本內各群細胞的識別能力是否存在差異,我們利用骨架抗體組合及SSC、FSC 2 個參數,對正常骨髓樣本中的細胞進行分群,如圖5A 所示,共分為6 群細胞:髓系原始細胞Blast 細胞(CD33+CD34+CD45-SSClow)、 早 前B 細 胞(Pro-B 細胞,CD19+CD33-CD34+CD45+SSClow)、前B 細胞(Pre-B細胞,CD19+CD33-CD34+CD45+SSClow)、成熟淋巴細胞(CD33-CD34-CD45strongSSClow)、成熟粒細胞(CD33+CD34-CD45+SSChigh)及單核細胞(CD33+CD34-CD45+SSCmedium)。然后,利用各群細胞在Lib 管FITC 通道設置陽性門,分別檢測其在sgc8 管及Lib 管內陽性門的百分比,結果如圖5B 所示,并計算兩者d值。如圖5C 所示,我們發現,正常骨髓樣本內,各群細胞d值的中位數分別為:Blast 細胞(65.85%) >Pro-B 細胞(9.45%) > 成熟單核細胞(3.60%)> 成熟粒細胞(1.30%) > Pre-B 細胞(0.60%) > 成熟淋巴細胞(0.35%),Blast 細胞的d值顯著高于其他細胞的d值,包括與它同為CD34+的Pro-B 細胞,且它們之間的差異有統計學意義(P=0.000)。同時,對sgc8 結合陽性率的研究顯示,Blast 細胞在10 個樣本中有9 個具有sgc8 結合陽性,具有較高陽性率(9/10,90.0 %),其余細胞僅1 例Pro-B 細胞出現陽性,該類細胞陽性率為(1/8,12.5%),而其他各群細胞均未見sgc8 結合陽性。結果顯示,sgc8在正常骨髓細胞樣本中,對Blast 細胞具備特異性識別能力,而對其他早期和成熟細胞無顯著識別能力。
2.4 核酸適配體sgc8 對AML 樣本內腫瘤細胞的特異性識別能力
為了研究sgc8 對AML 樣本內各群細胞的識別能力,我們對AML 骨髓樣本中的腫瘤細胞(AML 細胞)、成熟淋巴細胞、成熟粒細胞的結果進行了研究,并同時對比了AML 細胞與正常骨髓Blast 細胞(CD33+CD34+CD45+SSClow)的結果。利用在Lib 管FITC 通道設置的陽性門,我們分別檢測了各群細胞在sgc8 管及Lib 管內陽性門的百分比,結果如圖6A 所示;計算兩者d值,如圖6B 所示,我們發現,AML 樣本內各群細胞d值的中位數為:AML 細胞(37.50%) >成熟淋巴細胞(2.30%) >成熟粒細胞(1.70%)。AML 細胞的d值顯著高于與其樣本內的成熟淋巴細胞和成熟粒細胞的d值,且它與后兩者之間的差異有統計學意義(P=0.000)。盡管AML 細胞的d值與Blast 細胞的d值相比,后者的中位數(65.85%)要顯著高于前者的中位數,但它們之間的差異無統計學意義(P=0.067)。同時,針對sgc8 結合陽性率的研究也顯示,在45 個AML 骨髓樣本中,有36 個樣本的AML 細胞顯示出sgc8 結合陽性,陽性率為80.0%(36/45),接近正常骨髓Blast 細胞的結果(90.0%);而此結果也遠高于成熟淋巴細胞和成熟粒細胞的sgc8 結合陽性率,它們分別為2.2%和2.6%。結果表明,sgc8 在AML 骨髓細胞樣本中對AML 細胞具有特異性識別能力,而對其他細胞群未見明顯識別;但它對AML 細胞的識別能力與對正常骨髓Blast 細胞的識別能力之間沒有差別。
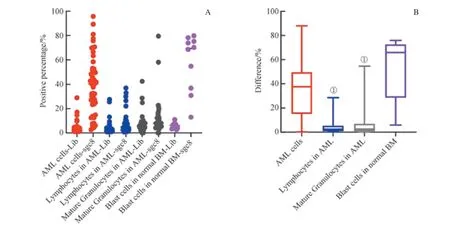
圖6 核酸適配體sgc8 對AML 骨髓樣本內各細胞群及正常骨髓Blast 細胞的識別Fig 6 Recognition of each cell population of AML samples and blast cells of normal bone marrow samples by aptamer sgc8
為了研究sgc8 對AML 各亞型腫瘤細胞的識別能力是否存在差異,我們根據骨髓形態學的結果,將AML 腫瘤細胞(AML 細胞)分為6 個亞型:急性粒細胞白血病未分化與部分分化型(M1/M2)、急性早幼粒細胞白血病(M3)、急性粒單核細胞白血病(M4)、急性單核細胞白血病(M5)、急性巨核細胞白血病(M7)及未明確類型(NK),我們比較了它們d值的差異。如圖7 所示,我們發現,各亞型AML 細胞d值的中位數為:M7(66.70%) > M4(56.25%) > NK(39.55%) > M3(29.60%) > M5(27.95%) > M1/M2(20.20 %)。為了研究這些數據之間的差異是否存在統計學意義,我們以M1/M2 細胞的d值為參照進行比較,結果發現,僅M7 細胞的d值與它之間的差異有統計學意義(P=0.006);而與其他AML 細胞亞型之間差異無統計學意義:M3(P=0.914),M4(P=0.233),M5(P=0.635),NK(P=0.102)。鑒 于M3、M4 細 胞 標本數較少,NK 細胞未明確類型,我們著重比較了M1/M2、M5、M7 之間d值的差異,發現它們三者之間的差異有統計學意義(P=0.027)。究其原因,我們又對M5、M7 的d值進行比較,結果顯示它們之間的差異有統計學意義(P=0.032)。結果表明,sgc8 對M7 細胞的識別能力顯著高于M1/M2 及M5 細胞,而后兩者之間無明顯差別。同時,我們也研究了各亞型AML 細胞的sgc8 結合陽性率,結果表明,除了樣本量較少的M3、M4 和不確定的NK 細胞均為100%外,sgc8 對M7 細胞的識別陽性率也為100 %,大于M5 細胞的68.8 %及M1/M2 細胞的53.3%(P≥0.05)。結果表明,除M7 外,sgc8 對其余亞型AML 細胞的識別無顯著差別,且對M7 的識別能力顯著高于M1/M2 及M5 細胞。
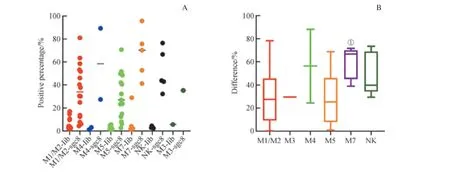
圖7 核酸適配體sgc8 對AML 各亞型腫瘤細胞的識別Fig 7 Recognition of cancer cells in various AML subtypes by aptamer sgc8
2.5 核酸適配體sgc8 對T-ALL 樣本內腫瘤細胞的特異性識別能力
為了研究sgc8 對T-ALL 骨髓樣本內各群細胞的識別能力是否存在差異,我們對樣本內的腫瘤細胞(T-ALL 細胞)、成熟淋巴細胞、成熟粒細胞的結果進行了研究,并同時對比了正常骨髓樣本中的成熟淋巴細胞。如圖8 所示,我們發現,各群細胞在sgc8 管與Lib 管陽性門內d值的中位數為:T-ALL 細胞(35.40%) > T-ALL 中成熟粒細胞(2.50%) > T-ALL 中成熟淋巴細胞(2.10%) > 正常骨髓成熟淋巴細胞(0.35%)。T-ALL 細胞的d明顯高于其樣本內的成熟淋巴細胞、成熟粒細胞及正常骨髓成熟淋巴細胞的d值,且它們之間的差異有統計學意義(P=0.000)。同時,在sgc8 結合陽性率方面,19 個樣本中,有14個樣本的T-ALL 細胞表現結合陽性,陽性率為78.9%(14/19),而其他細胞則未見sgc8 結合陽性。結果表明,sgc8 在T-ALL 骨髓細胞樣本中可以特異性識別T-ALL 細胞,而不識別樣本內的其他成熟細胞群。
為了研究sgc8 對不同亞型T-ALL 腫瘤細胞的識別能力是否存在差異,我們從T-ALL 中分出一類特別的亞型,即早前T 淋巴細胞白血病(early T-cell precursor lymphoblastic leukaemia,ETP)。 根 據WHO 的 分 類 標準,T-ALL 樣本免疫表型特征為CD7 陽性、胞質CD3陽性。ETP 腫瘤細胞的免疫表型為CD1a 和CD8 陰性,CD5 陰性或者弱陽性(弱陽性指的是腫瘤細胞陽性率低于75.00%),胞膜CD3 陰性(極少數情況CD3 陽性),同時至少表達1 種下列抗原:CD34、CD117、HLA-DR、CD13、CD33、CD11b、CD65[17]。我們比較了常規T-ALL與ETP 腫瘤細胞在sgc8 管及Lib 管內陽性門d值的情況。如圖9 所示,我們發現,ETP 中的腫瘤細胞(ETP 細胞)與T-ALL 中的腫瘤細胞(T-ALL 細胞)的d值差異無統計學意義(P≥0.05);且對sgc8 結合陽性率的研究也表明,ETP 細胞與T-ALL 細胞也有類似的陽性率,兩者分別為75.00%和73.30%。結果表明,sgc8 對不同亞型T-ALL 的識別能力沒有顯著差異。
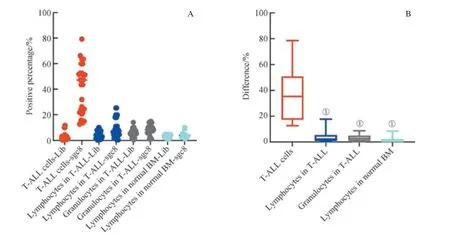
圖8 核酸適配體sgc8 對T-ALL 骨髓樣本內各細胞群及正常骨髓淋巴細胞的識別Fig 8 Recognition of each cell population in T-ALL samples and mature lymphocytes in normal bone marrow samples by aptamer sgc8
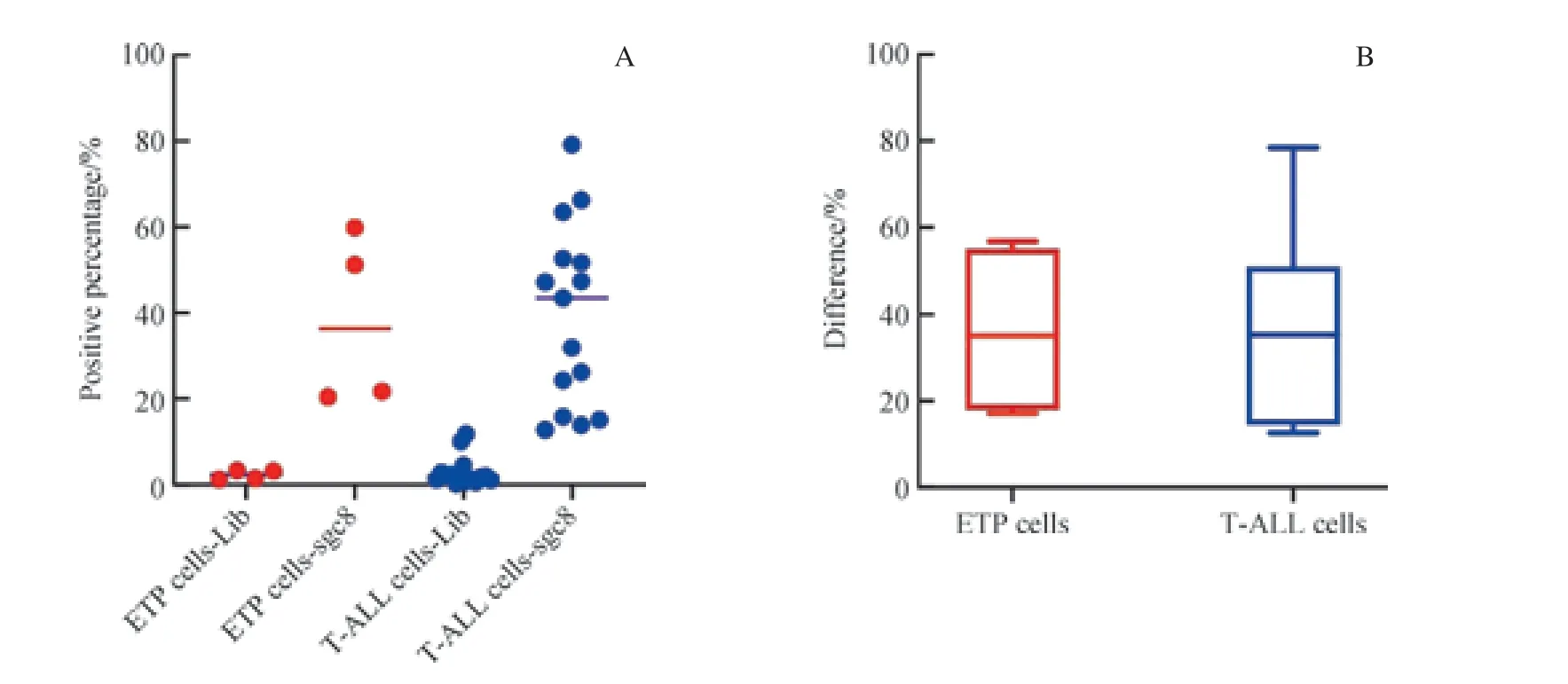
圖9 核酸適配體sgc8 對ETP 細胞與T-ALL 細胞的識別Fig 9 Recognition of ETP cells and T-ALL cells by aptamer sgc8
2.6 核酸適配體sgc8 對B-ALL 樣本內各群細胞的識別 能力
為了研究sgc8 對B-ALL 骨髓樣本內各群細胞的識別能力是否存在差異,我們對樣本內的腫瘤細胞(B-ALL 細胞)、成熟淋巴細胞、成熟粒細胞進行了比較研究,并同時對比了正常骨髓中的早期B 系細胞Pro-B 細胞和Pre-B 細胞。如圖10 所示,我們發現,各群細胞在sgc8 管與Lib 管陽性門內d值的中位數為:Pro-B 細胞(9.45%) > B-ALL 細胞(6.50%) >B-ALL 中的成熟淋巴細胞(1.20%) >Pre-B 細胞(0.60%) > B-ALL 中的成熟粒細胞(0)。B-ALL 細胞與其樣本內的成熟淋巴細胞和正常骨髓中的Pro-B 細胞d值之間的差異無統計學意義(P=0.102,P=0.386);而B-ALL與其樣本內的成熟粒細胞及正常骨髓Pre-B 細胞之間的d值差異有統計學意義(P=0.002,P=0.028)。然而,各群細胞sgc8 識別陽性率研究顯示,B-ALL 細胞、B-ALL 樣本內的成熟粒細胞均未見與sgc8 結合,而B-ALL 樣本中的成熟淋巴細胞僅有12.5 %的陽性率。結果表明,sgc8 對B-ALL骨髓樣本內的各群細胞無顯著識別能力。
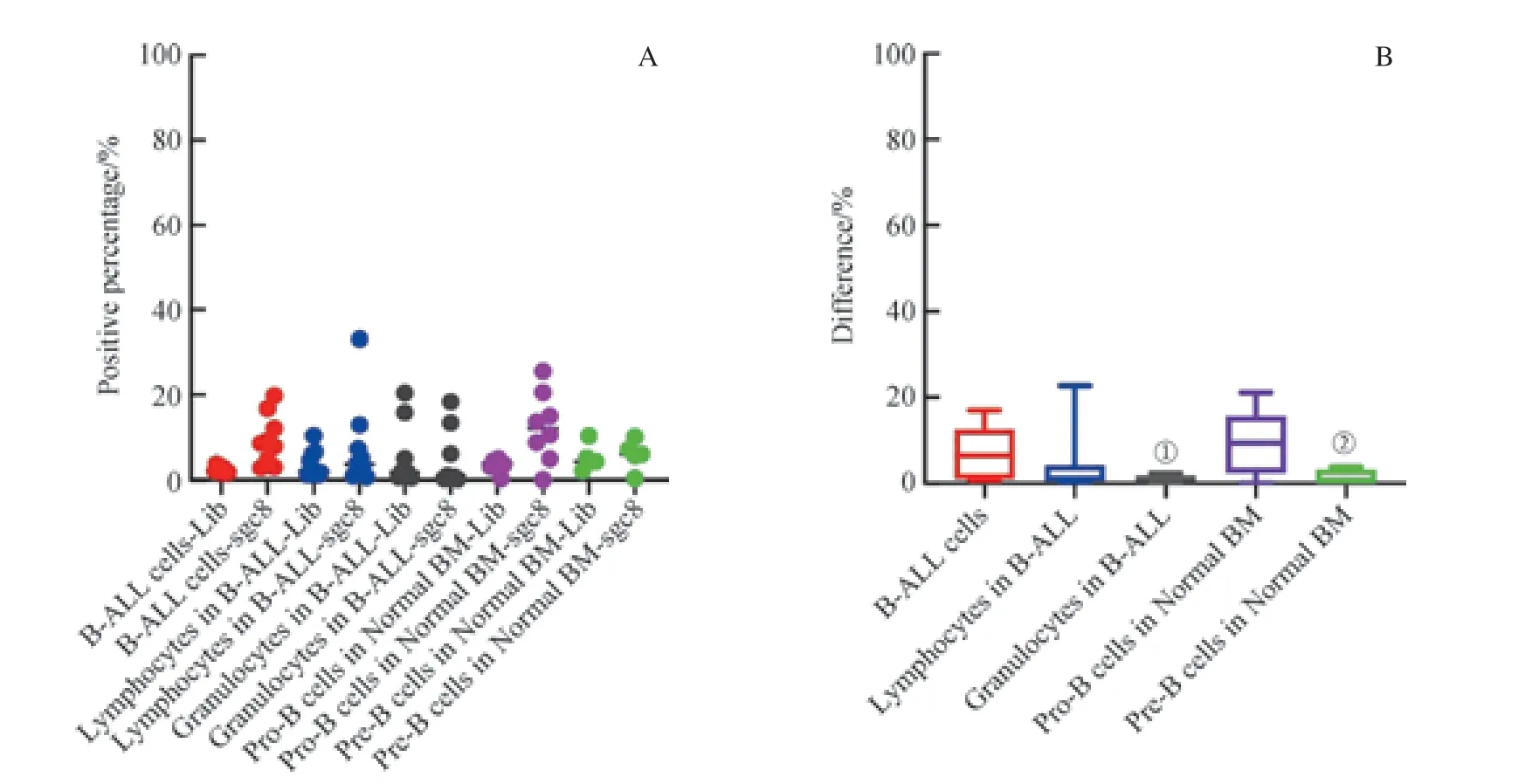
圖10 核酸適配體sgc8 對B-ALL 骨髓樣本內各細胞群及正常骨髓不成熟B 細胞的識別Fig 10 Recognition of each cell population in B-ALL samples and immature B cells in normal bone marrow samples by aptamer sgc8
2.7 核酸適配體sgc8 對不同AL 腫瘤細胞及正常骨髓(CD34+)早期細胞的識別能力差異
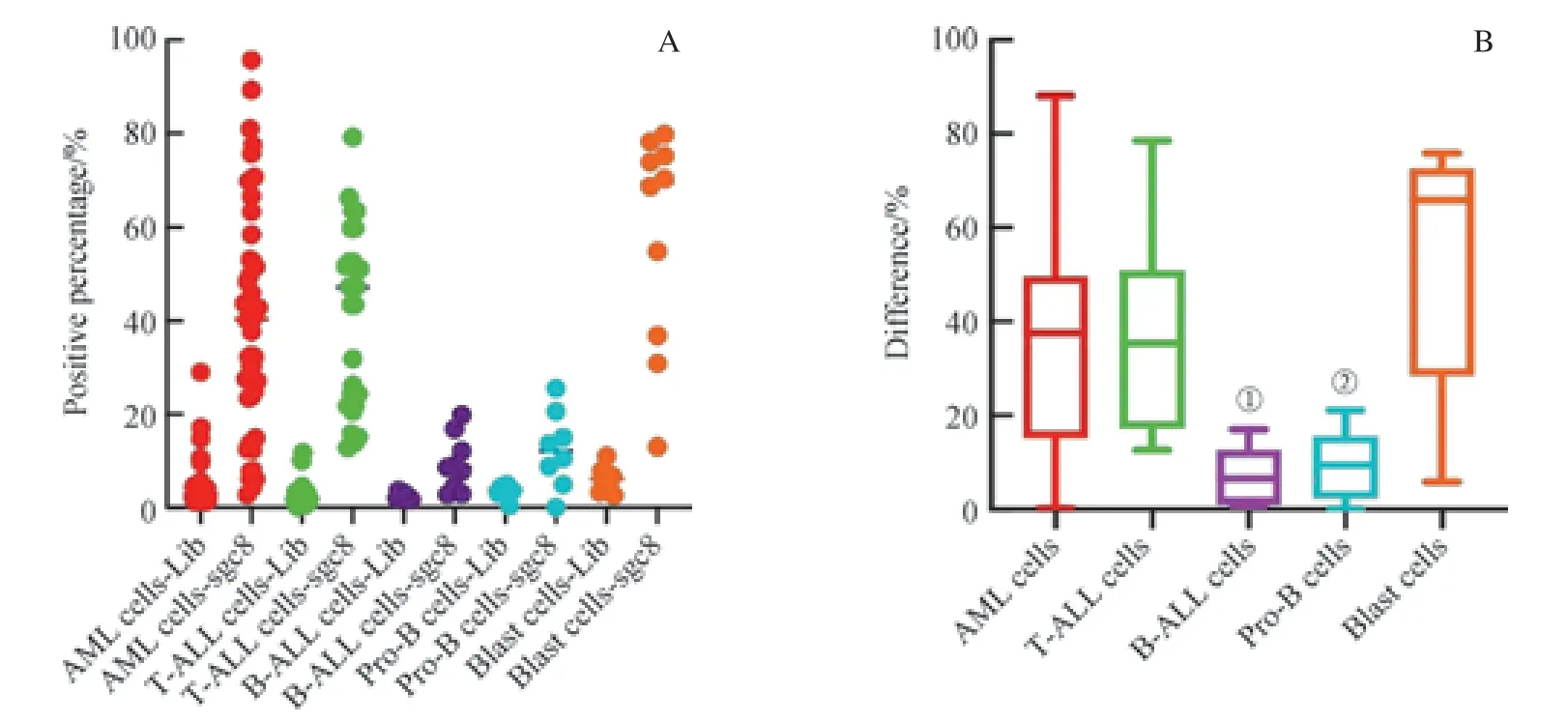
圖11 核酸適配體sgc8 對各類AL 腫瘤細胞及正常骨髓(CD34+)早期細胞的識別Fig 11 Recognition of cancer cells in various AL cells and CD34+ cells in normal bone marrow samples by aptamer sgc8
為了研究sgc8 在各類AL 細胞及正常骨髓(CD34+)早期細胞識別能力方面的差異,我們對AML 細胞、T-ALL 細胞、B-ALL 細胞及正常骨髓中CD34+的Blast細胞、Pro-B 細胞進行了研究。我們以Blast 細胞為對照,比較了各群細胞在sgc8 管與Lib 管陽性門內的d值。如圖11 所示,我們發現,各群d值的中位數為:Blast細 胞(65.85%) > AML 細 胞(37.50%) > T-ALL 細 胞(35.40%) > Pro-B 細胞(9.45%) > B-ALL 細胞(6.50%)。前三者的d值顯著高于后兩者,但在Blast 細胞與AML 細胞(P=0.067)和T-ALL 細胞(P=0.067)d值之間的差異無統計學意義;而T-ALL 細胞與B-ALL 細胞(P=0.000)及Pro-B 細胞(P=0.001)的d值之間的差異有統計學意義(P<0.05)。同時,針對sgc8 結合陽性率的研究顯示,AML 細胞、T-ALL 細胞及Blast 細胞均有較高的sgc8 識別陽性率,而B-ALL 細胞和Pro-B 細胞的陽性率較低。結果表明,sgc8 對AML 細胞、T-ALL 細胞及Blast 細胞具有較高的識別能力,且它們之間無顯著差異;而sgc8 對B-ALL 細胞及Pro-B 細胞無顯著識別能力。
3 討論
Shangguan 等[13]通過質譜分析的方法確定核酸適配體sgc8 主要靶標為PTK7 蛋白,并將PTK7 確定為T-ALL 的潛在生物標志物。Prebet 等[18]的研究表明,在AML 骨髓樣本中,有72%的AML 細胞表達PTK7 蛋白。Jiang 等[19]的后續研究表明,在正常骨髓中,PTK7 蛋白表達在髓系前體細胞(CD34+CD117+)上,而較少在不成熟的B 細胞上表達;在3 種主要的AL(AML、B-ALL、T-ALL)中均觀察到PTK7 蛋白表達的變化,且PTK7 蛋白的表達水平在AML 細胞和正常骨髓中的對照細胞(Blast 細胞)之間無差異,PTK7 蛋白的表達水平也同樣在B-ALL 細胞與正常骨髓不成熟B 細胞之間無差異,但PTK7 蛋白在T-ALL 上高表達,可與其他T 細胞標志物一起用作骨髓T-ALL 的檢測標志物。
本研究基于核酸適配體的流式細胞術,利用核酸適配體sgc8 對AL 樣本及正常的骨髓樣本各群細胞進行檢測。我們發現,sgc8 在T-ALL 和AML 骨髓樣本中,對腫瘤細胞具有特異性識別能力,而在B-ALL 骨髓中,對各類細胞均未見顯著識別;同時,在正常骨髓中,sgc8 對Blast細胞具有特異性識別能力,而對早期B 細胞(Pro-B 和Pre-B 細胞)及其他成熟細胞均無顯著識別能力;并且,sgc8 對AML 細胞和正常骨髓Blast 細胞的識別無顯著差異,對B-ALL 細胞和正常骨髓早期B 細胞的識別也無顯著差異。以上結果與既往報道的PTK7 抗體研究結果較為一致。此外,在AML 各亞型的腫瘤細胞中,sgc8 對M7細胞的識別陽性率要高于其他亞型細胞,而在其他亞型腫瘤細胞之間,sgc8 的識別能力并沒有差異。
我們的研究提示,核酸適配體sgc8 在AML、T-ALL和正常骨髓樣本中具有特異性識別能力,而對B-ALL 樣本無顯著識別,且對不同AML 亞型可能具有不同的診斷價值,可以考慮作為AL 的輔助診斷標志。本研究是第一次將核酸適配體應用到AL 臨床樣本檢測,研究表明核酸適配體sgc8 在臨床樣本中的檢測結果與報道的PTK7 抗體的檢測結果較為一致。與抗體相比,核酸適配體有較短的開發和生產周期、較低的生產成本、易于人工合成和修飾、批間差異小、化學性質穩定等特點[9],使它更易于被臨床應用,而成為一類具有臨床應用前景的診斷工具。近年來可用于白血病相關診療的核酸適配體也不斷出現,如Cibiel 等[20]篩選出針對膜聯蛋白A2(Annexin A2)的適配體。據報道,Annexin A2 在急性早幼粒細胞白血病[21]和MLL 重排的嬰兒ALL[22]中都高度表達。Joo等[23]報道了核仁蛋白(nucleolin,NCL)的特異性適配體AS1411,可能用于高表達NCL 的急性前體B 淋巴細胞白血病(pre-B ALL)的治療。可見,核酸適配體不僅可以作為診斷工具用于白血病免疫分型和MRD 監測,還可以開發成為靶向治療藥物。由于樣本和時間的限制,本研究僅涉及了核酸適配體sgc8,但實驗結果表明這種新型診斷工具在應用前景上具有價值。未來將會有更多具有特異性靶標的核酸適配體用于AL 的流式細胞學診斷,并結合患者的復發風險分級和預后評估,以期發現其更多的臨床應用價值。
參·考·文·獻
[1] 林果為, 王吉耀, 葛均波. 實用內科學[M]. 北京: 人民衛生出版社, 2017.
[2] 鄭榮壽, 孫可欣, 張思維, 等. 2015 年中國惡性腫瘤流行情況分析[J]. 中華腫瘤雜志, 2019, 41(1): 19-28.
[3] Griesinger F, Pirò-Noack M, Kaib N, et al. Leukaemia-associated immunophenotypes (LAIP) are observed in 90% of adult and childhood acute lymphoblastic leukaemia: detection in remission marrow predicts outcome[J]. Br J Haematol, 1999, 105(1): 241-255.
[4] Wood BL. Principles of minimal residual disease detection for hematopoietic neoplasms by flow cytometry[J]. Cytometry B Clin Cytom, 2016, 90(1): 47-53.
[5] Oelschl?gel U, Nowak R, Schaub A, et al. Shift of aberrant antigen expression at relapse or at treatment failure in acute leukemia[J]. Cytometry, 2000, 42(4): 247-253.
[6] Campana D, Coustan-Smith E. Minimal residual disease studies by flow cytometry in acute leukemia[J]. Acta Haematol, 2004, 112(1/2): 8-15.
[7] Costa AFO, Menezes DL, Pinheiro LHS, et al. Role of new immunophenotypic markers on prognostic and overall survival of acute myeloid leukemia: a systematic review and meta-analysis[J]. Sci Rep, 2017, 7(1): 4138.
[8] Liu J, You MX, Pu Y, et al. Recent developments in protein and cell-targeted aptamer selection and applications[J]. Curr Med Chem, 2011, 18(27): 4117-4125.
[9] Ali MH, Elsherbiny ME, Emara M. Updates on aptamer research[J]. Int J Mol Sci, 2019, 20(10): 2511.
[10] Zhang Y, Lai BS, Juhas M. Recent advances in aptamer discovery and applications[J]. Molecules, 2019, 24(5): 941.
[11] Morita Y, Leslie M, Kameyama H, et al. Aptamer therapeutics in cancer: current and future[J]. Cancers, 2018, 10(3): 80.
[12] Shangguan D, Li Y, Tang Z, et al. Aptamers evolved from live cells as effective molecular probes for cancer study[J]. Proc Natl Acad Sci U S A, 2006, 103(32): 11838-11843.
[13] Shangguan DH, Cao ZH, Meng L, et al. Cell-specific aptamer probes for membrane protein elucidation in cancer cells[J]. J Proteome Res, 2008, 7(5): 2133-2139.
[14] Yu YT, Duan SL, He J, et al. Highly sensitive detection of leukemia cells based on aptamer and quantum dots[J]. Oncol Rep, 2016, 36(2): 886-892.
[15] Mironov GG, Bouzekri A, Watson J, et al. Aptamer-facilitated mass cytometry[J]. Anal Bioanal Chem, 2018, 410(13): 3047-3051.
[16] Tan Y, Li YJ, Tang FQ. Nucleic acid aptamer: a novel potential diagnostic and therapeutic tool for leukemia[J]. Oncotargets Ther, 2019, 12: 10597-10613.
[17] Swerdlow SH, Campo E, Harris NL, et al. World Health Organization classification of tumours of the haematopoietic and lymphoid tissues, 4th[M]. Lyon: International Agency for Research on Cancer, 2017: 212.
[18] Prebet T, Lhoumeau AC, Arnoulet C, et al. The cell polarity PTK7 receptor acts as a modulator of the chemotherapeutic response in acute myeloid leukemia and impairs clinical outcome[J]. Blood, 2010, 116(13): 2315-2323.
[19] Jiang GH, Zhang M, Yue BH, et al. PTK7: a new biomarker for immunophenotypic characterization of maturing T cells and T cell acute lymphoblastic leukemia[J]. Leuk Res, 2012, 36(11): 1347-1353.
[20] Cibiel A, Nguyen Quang N, Gombert K, et al. From ugly duckling to swan: unexpected identification from cell-SELEX of an anti-annexin A2 aptamer targeting tumors[J]. PLoS One, 2014, 9(1): e87002.
[21] Menell JS, Cesarman GM, Jacovina AT, et al. Annexin Ⅱ and bleeding in acute promyelocytic leukemia[J]. N Engl J Med, 1999, 340(13): 994-1004.
[22] Spijkers-Hagelstein JAP, Mimoso Pinhan?os S, Schneider P, et al. Src kinaseinduced phosphorylation of annexin A2 mediates glucocorticoid resistance in MLL-rearranged infant acute lymphoblastic leukemia[J]. Leukemia, 2013, 27(5): 1063.
[23] Joo EJ, Wasik BR, Parrish C, et al. Pre-B acute lymphoblastic leukemia expresses cell surface nucleolin as a 9-O-acetylated sialoglycoprotein[J]. Sci Rep, 2018, 8(1): 17174.

