非酒精性脂肪肝病患者血清LAC、FFA與胰島素抵抗的關系研究
鄂建飛,何 訸,賀 勇,羅 薇,李貴星△
(1.德陽市人民醫院檢驗科,四川德陽 618000;2.四川大學華西醫院實驗醫學科,四川成都 610041)
近年來,非酒精性脂肪肝病(NAFLD)已經成為全球重要的公共衛生問題,并成為我國第一大慢性肝病[1]。來自北京、上海等地區的流行病學調查結果顯示,NAFLD患病率近10年從15.0%增加到31.0%[2]。四川成都地區普通成人NAFLD的患病率為17.1%,代謝綜合征(MS)患者的NAFLD患病率更是達到了58.0%[3]。BALLESTRI等[4]研究顯示,NAFLD患者發生糖尿病的風險較非NAFLD者高,同時,NAFLD患者發生MS的風險也高于非NAFLD患者(P<0.05)。ALLEN等[5]使用多態模型研究NAFLD對病死率的影響,結果顯示NAFLD患者10年病死率為10.2%,明顯高于對照組的7.6%,NAFLD患者預期壽命縮短了4年。因此,探討NAFLD發病機制對于延長患者的生命具有重要意義。本研究探討了NAFLD患者血清乳酸(LAC)和游離脂肪酸(FFA)與胰島素抵抗(IR)的關系,現報道如下。
1 資料與方法
1.1一般資料 選取2018年10月至2019年10月就診于四川大學華西醫院的NAFLD住院患者102例作為病例組,年齡16~69歲。NAFLD的診斷符合《非酒精性脂肪性肝病防治指南》中的臨床診斷標準[1]。選取同期四川大學華西醫院體檢中心100例體檢健康者作為對照組,年齡20~70歲。排除標準:(1)重癥感染、手術、外傷等引起的繼發性肝功能損傷者;(2)有過量飲酒史,男性攝入的乙醇量每周≥140 g,女性每周≥70 g;(3)有下列任何一項可導致肝臟脂肪沉積的特定疾病,包括病毒性肝炎、自身免疫性肝炎、藥物性肝病、肝豆狀核變性病等;(4)服用保肝藥、降脂藥或可造成肝臟脂肪沉積的藥物者;(5)不符合納入標準、臨床數據資料不完整影響判斷者。病例組與對照組性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。
1.2方法 通過調查問卷收集研究對象基本信息。研究對象于檢測前3 d內避免高脂飲食,檢測前1 d 24:00后禁食。抽取所有研究對象空腹靜脈血,放置30 min后,置于離心機以3 000 r/min離心15 min,上機檢測。采用羅氏Cobas 8000全自動生化分析儀及配套試劑檢測總膽固醇(TC)、三酰甘油(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、空腹血糖(FBG)、LAC。FBG和LAC檢測使用氟化鈉抗凝采血管采集標本。采用北京利德曼試劑檢測FFA;采用羅氏Cobas E601化學發光分析儀及配套試劑檢測空腹胰島素(FINS)。檢測相關指標所用方法:(1)TC采用氧化酶法;(2)TG采用氧化酶法;(3)HDL-C采用氧化酶法;(4)LDL-C采用氧化酶法;(5)ALT采用酶法;(6)AST采用酶法;(7)FBG采用己糖激酶法;(8)LAC采用氧化酶法;(9)FFA采用氧化酶法;(10)FINS采用化學發光法。依據FBG和FINS計算穩態模型評估胰島素抵抗指數(HOMA-IR):HOMA-IR=FBG(mmol/L)×FINS(mIU/L)/22.5。

2 結 果
2.1兩組間生化指標比較 病例組FBG、FINS、HOMA-IR、TG、ALT、AST、FFA、LAC水平均高于對照組,差異有統計學意義(P<0.05);病例組HDL-C水平低于對照組,差異有統計學意義(P<0.05);病例組和對照組TC、LDL-C水平差異無統計學意義(P>0.05),見表1。
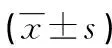
表1 病例組和對照組間生化指標的比較

組別nHDL-C(mmol/L)LDL-C(mmol/L)FFA(mmol/L)LAC(mmol/L)ALT(U/L)AST(U/L)病例組1021.18±0.332.86±0.851.35±0.552.01±0.8862.0±38.037.0±17.0對照組1001.66±0.352.67±0.560.95±0.481.08±0.5322.0±10.021.0±6.00t-9.8811.8385.4299.1487.6057.748P<0.0010.068<0.001<0.001<0.001<0.001
2.2NAFLD患者血清LAC、FFA水平與各因素相關性分析 Pearson相關分析顯示,血清LAC與HOMA-IR、TG、FFA呈正相關(r=0.714、0.349、0.408,P<0.05)。血清FFA與HOMA-IR、TG、LAC呈正相關(r=0.521、0.260、0.408,P<0.05),與HDL-C呈負相關(r=-0.349,P<0.05),見表2。

表2 血清LAC、FFA水平與各因素相關性分析
2.3多元逐步回歸分析 以LAC為因變量,以FBG、FINS、HOMA-IR、TG、HDL-C、ALT、AST、FFA為自變量進行多元逐步回歸分析。結果顯示,LAC與HOMA-IR、FFA呈正相關(P<0.05),見表3。以FFA為因變量,以FBG、FINS、HOMA-IR、TG、HDL-C、ALT、AST、LAC為自變量進行多元逐步回歸分析。結果顯示,FFA與HOMA-IR、TG、LAC呈正相關(P<0.05),見表4。

表3 血清LAC與各變量關系的多元逐步回歸分析

表4 血清FFA與各變量關系的多元逐步回歸分析
3 討 論
本研究結果顯示,病例組患者LAC水平明顯高于對照組,差異有統計學意義(P<0.05),同時,Pearson相關分析顯示,血清LAC與HOMA-IR呈正相關(r=0.714,P<0.05),表明IR與NAFLD患者血清LAC升高密切相關。QVISTH等[6]發現在注射胰島素后,LAC水平增加,并且在脂肪組織中比骨骼肌組織中增加得更為明顯,表明在高胰島素狀態下,LAC水平是由肌肉以外葡萄糖代謝率決定的。研究表明,IR使線粒體丙酮酸利用減少,糖無氧酵解作用增加,導致LAC生成增多[7]。當機體出現IR,機體能量供應由紅細胞葡萄糖酵解補充,秦永軍等[8]報道,脂肪肝組紅細胞水平較非脂肪肝組顯著增加,紅細胞利用葡萄糖增加,LAC水平升高。另外,研究發現LAC可以通過絲裂素活化蛋白激酶(MAPK)誘導白細胞介素(IL)-6、腫瘤壞死因子(TNF)-α等炎性因子的表達,引起氧化應激,進而引起脂肪變性的肝細胞反生炎癥、壞死甚至纖維化,加重NAFLD患者的病情[9]。本研究結果顯示,病例組患者FFA水平為(1.35±0.55)mmol/L,對照組FFA 水平為(0.95±0.48)mmol/L,病例組患者血清FFA水平明顯高于對照組,差異有統計學意義(P<0.05),表明FFA與NAFLD的發生密切相關。Pearson相關分析顯示,血清FFA水平與HOMA-IR呈正相關(r=0.521,P<0.05),與張旭艷等[10]提出IR與血清FFA升高密切相關結果一致。SANYAL等[11]利用高胰島素正常葡萄糖鉗夾試驗觀察到IR出現時伴有血清FFA升高。另外,LAGATHU等[12]發現,增多的FFA可通過使胰島素的信號轉導抑制因子3高表達而加重IR。FFA代謝異常貫穿于NAFLD的整個發病過程[13]。FFA在NAFLD的發生、發展中起著重要的作用,FFA水平增加是NAFLD的特征表現,也是引起脂質過氧化、肝細胞損傷、炎癥激活、能量代謝障礙、脂肪細胞凋亡等的關鍵因素。
本研究以LAC為因變量進行多元逐步回歸分析,結果顯示,LAC與HOMA-IR、FFA呈正相關(P<0.05),表明LAC水平升高與IR、FFA密切相關。以FFA為因變量進行多元逐步回歸分析,結果顯示,FFA與HOMA-IR、LAC呈正相關(P<0.05),表明FFA水平升高與IR和LAC密切相關。其可能的機制為IR導致LAC水平升高,LAC通過乳酸脫氫酶轉化為丙酮酸,丙酮酸通過丙酮酸脫氫酶復合體生成乙酰輔酶A(CoA),乙酰CoA在乙酰CoA羧化酶催化下轉化成丙二酸單酰CoA,再經過縮合、還原、脫水,再還原基本反應循環合成脂肪酸。催化反應的乙酰CoA羧化酶是脂肪酸合成的關鍵酶,并且胰島素能夠通過蛋白磷酸酶的去磷酸化作用,使磷酸化的乙酰CoA羧化酶脫磷酸激活,高濃度胰島素促進乙酰CoA向丙二酸單酰CoA轉化[14]。MUOZ等[15]通過動物實驗發現,IR后葡萄糖酵解通量增加,導致LAC釋放增加,并指出間接途徑(葡萄糖-乳酸-3-磷酸甘油)是脂肪沉積的重要途徑。
4 結 論
NAFLD患者血清FFA、LAC水平顯著增加,與IR密切相關。臨床工作者在綜合治療的同時關注血清LAC、FFA水平,糾正脂代謝紊亂,可減緩NAFLD患者的病情發展。

