苦參堿對大鼠肝缺血再灌注損傷后肝功能及MAPK通路的影響
袁芳,楊智承
(廣東藥科大學藥學院,廣東 廣州 510006)
肝移植、肝切除術中,需分次、分段阻斷肝臟血流,達到控制術中出血的目的,該過程會造成肝臟的缺血再灌注損傷(hepatic ischemic reperfusion injury ,HI/R)[1]。研究顯示,HI/R可造成肝竇內細胞損傷,并誘導活性氧自由基,釋放促炎癥反應細胞因子,引發肝細胞壞死、誘導肝細胞凋亡,最終導致肝功能異常,是肝臟手術的常見死亡原因[1-2]。近年來研究顯示,肝細胞凋亡在HI/R的病理過程中發揮重要作用[3]。
目前,針對肝缺血再灌注損傷,臨床以對癥支持治療為主,仍缺乏有效措施,亟待尋求預防HI/R的有效手段。國內外多項研究顯示,中藥單體苦參堿(matrine,MT)有抗氧化、抗炎和護肝等作用[4-5],對于缺血再灌注有保護作用[6-8],但MT對于肝缺血再灌注的作用和機制仍需進一步闡明。本研究在建立大鼠HI/R模型[9]的基礎上觀察 MT對HI/R的作用并探討相關機制。
1 材料與方法
1.1 藥物與試劑
苦參堿(質量分數≥99%) 購于中國藥品生物制品檢定所,生產批號:110805-201509;BCA蛋白濃度檢測試劑和NE-PERTM細胞核和胞漿提取試劑盒均購于Pierce Biolab 公司;MAPK家族一抗:ERK1/2、p38、JNK、MKK7抗體及內參GAPDH購于Cell Sigaling Technology公司;TUNEL染色試劑盒由美國Promega公司生產;丙二醛(MDA)和超氧化物歧化酶(SOD)試劑盒購于南京建成生物工程公司。
1.2 儀器與設備
Hitachi7180臨床分析儀、5810冷凍離心機(Eppendorf);OlympusCKX41倒置顯微鏡(奧林巴斯);-80 ℃超低溫冰箱(Thermo Scientific);免疫印跡系統(BioRad);680XHR凝膠成像系統(GBOX)。
1.3 實驗動物
清潔級SD雄性大鼠,體質量200~250 g,購于南方醫科大學實驗動物中心,生產許可證號: SCXK(粵)2019-0005。
1.4 分組與給藥
健康成年雄性SD大鼠24只,隨機分為4組,每組6只:(1)肝缺血再灌注組(I/R組):連續7 d腹腔注射含1%吐溫80生理鹽水;(2)苦參堿(MT組):給藥劑量分別為20、40 mg/kg,溶解于含1%吐溫80生理鹽水,連續7 d腹腔注射。該劑量由臨床常用苦參堿劑量折算[10- 11],并通過預實驗確定給藥天數。(3)假手術組(Sham組):連續7 d腹腔注射含1%吐溫80的生理鹽水。
1.5 模型建立
大鼠術前禁食12 h,自由飲水。I/R組和MT組分別給予溶媒和苦參堿30 min后,經腹腔注射4%(φ)戊巴比妥鈉(40 mg/kg)麻醉,固定,常規消毒。取上腹正中切口入腹,用無創血管夾阻斷肝門靜脈和肝動脈,造成約70%肝臟缺血。1 h后去除血管夾,恢復缺血肝的血流,縫合腹腔,繼續再灌注4 h,取左葉肝臟組織標本和下腔靜脈血待測;Sham組給予同體積生理鹽水溶媒腹腔注射30 min后,開腹及暴露肝蒂處理后,關腹,不阻斷肝血流,然后縫合腹腔,4 h后同上取樣本待測[9]。
1.6 標本處理
所有血漿樣本,常溫離心15 000 r/min×15 min,取上清-80 ℃凍存。肝組織用PBS清洗后,凍存于液氮中,待測。檢測時,解凍肝組織,稱重,用1∶10(v∶v)的冰浴PBS勻漿,4 ℃,14 000×g離心15 min。分離上清,分別測定酶活性和蛋白定量。肝組織10%(φ)甲醛固定,石蠟包埋制成蠟塊備用。將包埋肝組織蠟塊進行修塊、脫水、包埋、切片等處理后,按照說明,分別進行HE染色和TUNEL染色。另取5 g肝組織,破碎離心后,用于Western blot檢測。
1.7 谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、MDA和SOD的檢測
血清ALT、AST用Hitachi7180臨床分析儀進行檢測。按照說明書,利用酶比色法試劑盒測定組織中MDA、SOD的含量。
1.8 組織病理學檢測
HE染色后,在光學顯微鏡下進行肝組織的病理形態學觀察。
1.9 TUNEL法檢測肝細胞凋亡
每個切片隨機選取10個陽性視野,以細胞內出現棕色顆粒者為凋亡細胞,計算每張切片中的凋亡細胞數目。
1.10 Western blot檢測
肝臟組織在冰上用含有10 mmoL/L Tris (pH 7.5),1.5 mmoL/L MgCl2,10 mmoL/L KCl 和0.1% Trition X-100的緩沖液中混懸、勻漿裂解,12 000 r/min,4 ℃離心15 min,取上清收集總蛋白。5×上樣緩沖液混合煮沸5 min。垂直板電泳分離條帶,轉膜,分別加入GADD45Β、MMK7、MAPK家族蛋白ERK1/2、磷酸化ERK1/2、磷酸化p38、p38、磷酸化JNK和JNK一抗(1∶1 000)4 ℃孵育過夜,洗膜后用辣根過氧化物酶(HRP)標記的二抗(1∶2 000,HRP標記)孵育2 h,利用化學發光儀器曝光,采集目標蛋白條帶。Western blot圖像灰度值采用Quantity One2.4軟件分析。
1.11 統計學處理
采用SPSS18.0軟件處理數據,各組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 各組血漿ALT、AST和組織中MDA、SOD的比較
血清學檢測結果提示:與假手術組比較,I/R組血清ALT、AST水平均顯著升高(P<0.01);MT(20、40 mg/kg)組血清ALT、AST水平與I/R組比較顯著降低(P<0.01),且高劑量組的降低程度較低劑量組更顯著(見表1 )。
與假手術組比較,I/R組組織中MDA、SOD含量均顯著增加(P<0.01); MT(20、40 mg/kg)組組織中MDA與I/R組比較顯著降低、SOD含量增高(P<0.01或P<0.05)(見表1)。
2.2 各組肝組織病理學變化
HE染色肝組織,顯微鏡下可見:Sham組肝索排列規則,肝竇不擴張,僅少量炎性細胞浸潤。I/R組肝組織腫脹、肝竇擴張,肝細胞空泡變性和點狀壞死,周圍有大量紅細胞和炎性細胞浸潤,伴有空泡變性和點狀壞死。 MT 20、40 mg/kg組肝細胞結構清楚,肝細胞腫脹程度和炎性細胞浸潤情況,均較I/R組有所減輕(見圖1)。
2.3 TUNEL檢測各組肝細胞凋亡情況
TNUEL檢測結果顯示,I/R組、MT 20、40 mg/kg組均有一定數量的TUNEL陽性細胞。較之I/R組,MT 40 mg/kg組降低明顯(P<0.01),見圖2。
2.4 Western blot結果
2.4.1 各組ERK1/2、p-ERK1/2、JNK、p-JNK、p38和p-p38的表達情況 與Sham組比較, I/R組和MT組的p-JNK和p-p38蛋白表達顯著增加 (P<0.01);與I/R組比較,MT 20、40 mg/kg組p-JNK、p-p38表達顯著降低(P<0.05),對于p-ERK1/2則無明顯影響,見圖3。
2.4.2 各組MKK7的表達情況 Sham組僅有少量MKK7表達;與Sham組比較,I/R組MKK7的表達顯著升高(P<0.01),MT組可以顯著降低MKK7表達(P<0.05),見圖4。
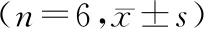
表1 各組ALT、AST、MDA和SOD水平比較Table 1 Comparison of the levels of ALT,ALT,MDA and SOD in each group

A. Sham 組; B. I/R組; C.MT 20 mg/kg組;D. MT 40 mg/kg組。
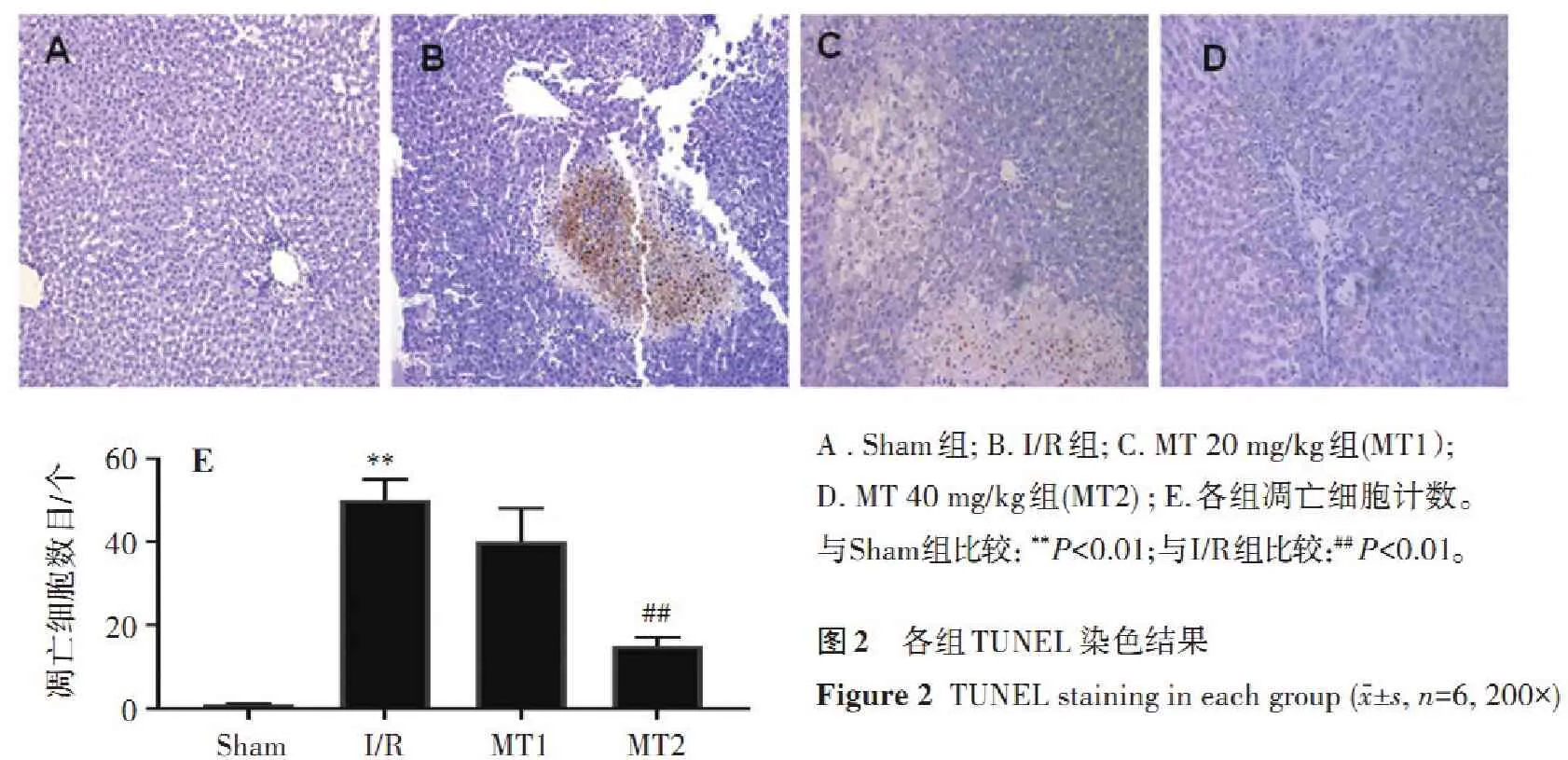
p-ERK1/2ERK1/2p-JNKJNKp-p38p381234p-ERK1/2p-JNKp-p38543210****####1234AB蛋白相對表達量
3 討論
中藥單體苦參堿具有抗氧化[12]、抗炎、抗代謝等一系列作用[7,13],有報道苦參堿術前單次靜脈注射,可以通過TRAIL/BAX途徑抑制大鼠肝缺血-再灌注損傷后的肝細胞凋亡[13]。但報道多為一次性術前預防給藥,與臨床治療模式不符,且苦參堿對于凋亡的作用機制仍有待進一步闡明。因此本研究在建立大鼠HI/R模型的基礎上,將臨床常用苦參堿劑量折算成動物給藥劑量[10-11],大鼠連續7 d給予苦參堿(20、40 mg/kg)腹腔注射后,實施肝缺血再灌注術,術后立即采樣,保存標本。肝功能各項指標顯示:苦參堿組AST和ALT的含量,肝組織中脂質過氧化反應產物MDA含量明顯低于肝缺血再灌注組(P<0.01),肝組織中的抗氧化酶SOD含量,則高于肝缺血再灌注組(P<0.01)。病理學檢查發現,肝缺血再灌注組的肝組織標本可見大量炎性細胞浸潤,肝竇擴張,肝細胞空泡變性并有多處壞死灶;苦參堿高劑量組的肝小葉結構基本正常,肝細胞壞死、炎癥細胞浸潤均較肝缺血再灌注組明顯減少;苦參堿低劑量組的肝組織損傷也較肝缺血再灌注組輕。結果提示苦參堿連續給藥預處理,有助于緩解肝缺血再灌注損傷,具有護肝作用。
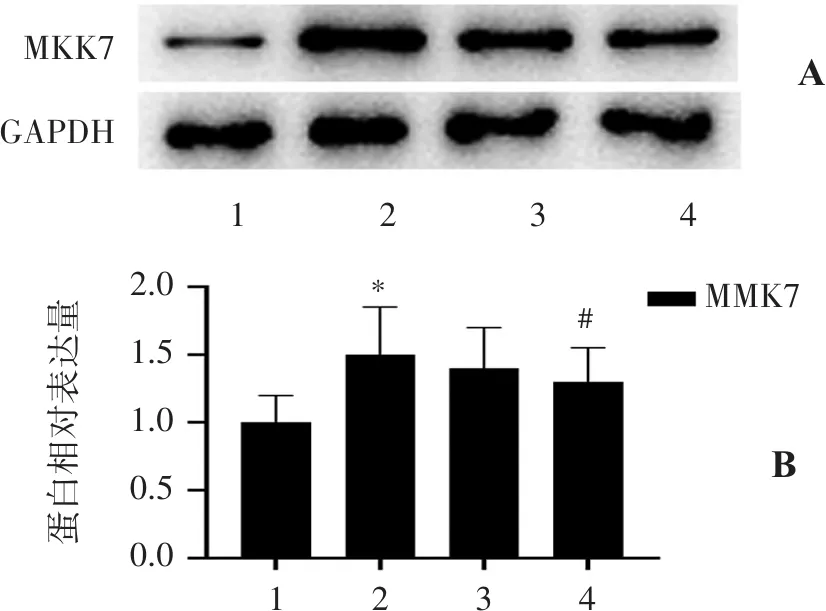
蛋白相對表達量1234AB2.01.51.00.50.0MMK71234MKK7GAPDH#*
本研究同時檢測了各組肝細胞的凋亡情況,結果顯示,苦參堿高劑量組能夠明顯減少缺血再灌注后的肝細胞凋亡,低劑量組對凋亡也有改善趨勢。
多項研究均顯示,在肝缺血再灌注損傷引發的肝壞死、術后死亡等一系列問題中,誘導肝細胞凋亡發揮著至關重要的作用[2],而絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路在調控肝細胞凋亡的作用已被諸多研究證實[1,14-15]。MAPK是一組能被不同的細胞外刺激如:細胞因子、神經遞質、激素等激活的絲氨酸、蘇氨酸蛋白激酶,包括ERK、JNK、p38 MAPK和ERK5四個亞族[16],其中p38和C-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)通路的磷酸化激活和細胞凋亡與應激時的多種病理生理過程有關[17-18]。
為探討苦參堿發揮肝缺血再灌注保護作用的機制,進一步研究了苦參堿預處理對于肝缺血再灌注肝組織中MAPK通路的JNK、p38和ERK表達的影響。研究顯示,苦參堿預處理可顯著降低肝缺血再灌注肝組織中磷酸化JNK、p38表達,且對磷酸化JNK的表達影響最為顯著。JNK在多種組織中均有表達,能被MAPK激酶MKK7特異性激活[18-19]。反之,抑制MKK7的特異位點,可以最終達到抑制JNK磷酸化,發揮抗凋亡的作用[20]。本研究進一步觀察了苦參堿預處理對于調控JNK磷酸化的MKK7表達,結果顯示,苦參堿預處理可以顯著降低JNK的調控激酶MKK7的表達,因此苦參堿抗肝缺血再灌注的機制可能與抑制MKK7表達,降低JNK磷酸化有關。
綜上所述,苦參堿預處理對大鼠肝缺血再灌注損傷有一定的保護作用,其可能機制與抑制MAPK通路的MKK7/JNK磷酸化以及p38磷酸化,發揮抗肝細胞凋亡作用有關,對于苦參堿預防肝缺血再灌注損傷的臨床意義有待進一步研究,其相關信號通路的上游調控機制也有待進一步明確。

