HBx-MALAT-XB130通路對肝癌細胞生長和遷移的影響機制
黃超群,劉微,高文娟,段體龍,王丹丹
肝細胞癌為惡性腫瘤,對患者的生活質量和生命安全造成了嚴重威脅[1-2]。臨床上對肝癌的發病原因尚未完全清楚,但眾多學者一致認為其是受多種因素影響的復雜過程[3-4]。肝癌發生早期并沒有明顯的癥狀,當被發現時,肝癌已屬晚期,耽誤了疾病的最佳治療時機,嚴重威脅患者的生命安全[5-6]。臨床上將上皮組織和間葉組織起源的肝癌稱為原發性肝癌,其在我國具有高發性和高危險性[7-8]。現探究HBx-MALAT-XB130通路對肝癌細胞生長和遷移的影響機制,報道如下。
1 材料與方法
1.1 材料 (1)人肝癌細胞株:購于中國醫學科學院。(2)藥物、試劑:MTT試劑盒(艾美捷科技有限公司);PBS緩沖液、SSC溶液、多聚甲醛(上海酶聯生物科技有限公司),DAPI染色劑(北京富百科生物技術有限公司)。(3)儀器設備:Transwell小室(上海國藥集團化學試劑有限公司);離心機(杭州川一實驗儀器有限公司,型號TG16-WS)、酶標儀(濟南歐萊博科學儀器有限公司,型號F50)。
1.2 實驗方法 2019年6—10月于解放軍聯勤保障部隊第962醫院實驗室進行實驗,本實驗獲醫院倫理委員會批準。
1.2.1 人肝癌細胞培養:于40℃時對凍存的肝癌細胞進行火浴處理,之后充分搖晃,將混合均勻的肝癌細胞置于培養基[10%PBS、1%雙抗(青鏈霉素)RPMI-1640培養基]2 ml中,之后離心處理,進行重懸處理后將細胞傳代,使用CO2培養箱對培養基培養24 h、換液,細胞融合率達90%后傳代。
1.2.2 慢病毒載體構建:引物序列根據質粒特點進行引物設計,引入SacⅠ酶切位點(由上海生工生物工程技術服務有限公司完成)。正反鏈混合后加入退火緩沖液,96℃反應4 min,室溫冷卻,生成雙鏈。使用Eco31Ⅰ酶切線性化質粒pGenesil-1,100倍稀釋退火產物之后與其連接,20℃下水浴孵育過夜,使用大腸桿菌DH5α轉化,第2天選擇單克隆菌落,在Kana的LB培養液(30 μg/ml)中接種,離心處理,37℃下震蕩混勻,孵育過夜。少量抽提質粒后使用SacⅠ酶切進行鑒定[由寶生物工程(大連)有限公司完成],分為低阻斷組、中阻斷組、高阻斷組。重懸處理后分別加入DAPT 1 ml、5 ml、10 ml中,電擊處理后室溫下存放120 min,將各組細胞加入6孔、96孔培養板中,置于培養箱內進行培養,取出后加入含G418的培養基800 μg/ml中再次培養。
1.3 觀測指標與方法
1.3.1 MTT法檢測細胞生長能力:將各組細胞加入96孔板中,分別于12、24、48、72 h后在每孔中加入MTT液30 μl,37℃孵育4 h,棄培養液,加入DMSO 150 μl ,酶標儀在498 nm波長處檢測每孔的OD值,檢測肝癌細胞生長情況。
1.3.2 TUNEL法檢測細胞凋亡:常溫下使用蛋白酶K 20 μg/ml培養0.5 h后去除蛋白,使用PBS緩沖液進行徹底清洗,加入平衡緩沖液100 μl,室溫環境中平衡10 min,然后滴入TdT酶反應液100 μl,避光、室溫下孵育1 h,之后加入 SSC溶液100 μl,常溫下靜置20 min后進行清洗3次,使用DAPI進行復染,避光培養10 min后再次進行浸洗,封片觀察。DAPI復染細胞核呈藍色,凋亡細胞核呈綠色,每張切片取3個視野進行觀察,計算細胞凋亡率,取其平均值。
1.3.3 流式細胞儀檢測細胞周期:將各組細胞傳代至5孔板,并將其置于5% CO2、37℃下培養,添加0.25%胰蛋白酶進行消化,離心處理10 min,使用PBS緩沖液進行清洗,再次離心處理,之后添加PI染液1 ml,置于常溫、避光環境60 min,進行特異熒光標記后按照流式細胞儀操作方法檢測細胞周期分布。
1.3.4 Transwell小室實驗檢測細胞侵襲:檢測前2 h濕化小室,上室加入細胞懸液200 μl ,在下室加入含10%胎牛血清的細胞培養液,在培養箱中培養24 h。用PBS沖洗2次后置于4%多聚甲醛中30 min。染色后在顯微鏡下觀察計數。
1.3.5 細胞劃痕實驗檢測細胞遷移:使用胰酶消化細胞制成細胞懸液,接種于6孔板。使用10槍尖垂直于孔板底部畫直線,PBS緩沖液清洗3次。常溫培養24 h拍照計算劃痕。
1.3.6 Western-blot法檢測Bcl-2、Bax、Caspase3、p53表達:使用PBS緩沖液對標本沖洗之后裂解30 min,測定蛋白濃度。取20 μg/孔蛋白質,添加蛋白緩沖液后進行電泳,10 min后將電轉膜置于10%牛奶中浸泡,常溫環境下封閉90 min。之后結合一抗、稀釋,孵育1 d,取出后使用TBST液沖洗,結合二抗,60 min后清洗、顯色,對Bcl-2、Bax、Caspase3、p53相對表達量進行檢測。
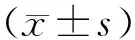
2 結 果
2.1 各組不同時間點肝癌細胞生長率比較 在24 h、48 h、72 h時進行肝癌細胞生長率比較,低阻斷組<中阻斷組<高阻斷組,差異均有統計學意義(P<0.01),見表1。
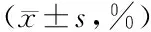
表1 3組不同時間點肝癌細胞生長率比較
2.2 各組不同時間點肝癌細胞凋亡率比較 在24 h、48 h、72 h時進行肝癌細胞凋亡率比較,低阻斷組>中阻斷組>高阻斷組,差異均有統計學意義(P<0.01),見表2。
2.3 各組肝癌細胞侵襲、遷移能力比較 肝癌細胞侵襲和遷移細胞數比較,低阻斷組<中阻斷組<高阻斷組,差異均有統計學意義(P<0.01),見表3、圖1~2。
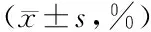
表2 3組不同時間點肝癌細胞凋亡率比較
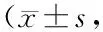
表3 3組肝癌細胞侵襲、遷移能力比較個)
2.4 各組肝癌細胞周期分布比較 G1、S、G2期肝癌細胞比例比較,低阻斷組<中阻斷組<高阻斷組,差異均有統計學意義 (P<0.01),見表4。
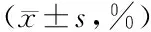
表4 3組肝癌細胞周期分布比較

圖1 3組肝癌細胞侵襲情況(結晶紫染色,×100)

圖2 3組肝癌細胞遷移情況(Giemsa 染色,×100)
2.5 各組Bcl-2、Bax、Caspase3、p53相對表達量比較 Bcl-2相對表達量比較,低阻斷組>中阻斷組>高阻斷組, Bax、Caspase3、p53相對表達量比較,低阻斷組<中阻斷組<高阻斷組,差異均有統計學意義(P<0.01),見表5。
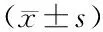
表5 3組Bcl-2、Bax、Caspase3、p53相對量表達比較
3 討 論
由于臨床上對肝癌的發病機制尚未研究透徹,所以有越來越多的學者投入到對肝癌的研究之中[9-10]。由于肝癌早期并沒有明顯的臨床癥狀,導致許多患者不能得到有效的早期治療,耽誤了最佳的治療時機[11-12]。肝癌發展的過程通常伴隨著各種臨床癥狀和危害,其臨床癥狀主要有肝區疼痛、乏力、納差等,也會經常伴隨上消化道出血、肝衰竭、腎衰竭等,當肝癌發展嚴重時,會造成患者死亡。肝癌患者的生活質量嚴重下降,對患者家庭和社會造成一定的影響[13-14]。HBx作為乙肝病毒X基因,是HBV基因組的一員,HBx-MALAT-XB130通路的作用在學術界得到了一致的認可,在肝癌的表達中起到了重要的作用[15-16]。
肝癌組織中的細胞生長變化與肝癌的發生和發展具有密切的聯系[17-18]。有學者研究表明,對肝癌細胞的生長率進行調控,能夠起到抑制肝癌細胞發展的作用。本研究結果顯示,阻斷HBx-MALAT-XB130通路導致肝癌細胞生長率出現明顯上升,說明HBx-MALAT-XB130通路與肝癌細胞的生長關系密切,調控該通路能夠影響肝癌細胞生長情況,為肝癌的臨床治療起到一定的參考作用。
肝癌的發生和發展與肝癌細胞的凋亡具有密切聯系[19-20]。XB130和HBx的共同表達能夠對60Co-γ射線所導致的細胞凋亡情況進行抵抗,并且其共同表達能夠對細胞周期起到阻滯作用。本研究結果顯示,阻斷HBx-MALAT-XB130通路導致肝癌細胞凋亡能力下降,說明HBx-MALAT-XB130通路表達與肝癌細胞凋亡能力具有密切聯系,調控該通路能夠影響癌細胞凋亡能力,從而干預癌細胞的生長。
大量臨床研究資料表明,肝癌的發展與癌細胞的侵襲、遷移能力具有密切聯系。對細胞的侵襲和遷移能力進行抑制,能夠抑制肝癌細胞的發展。有學者在研究中表明,對胃癌細胞的侵襲和遷移能力進行抑制,能夠對胃癌進行調控[21]。本研究對肝癌細胞的侵襲和遷移能力進行了檢測,發現阻斷HBx-MALAT-XB130通路導致肝癌細胞侵襲、遷移能力上升,說明HBx-MALAT-XB130通路與癌細胞侵襲、遷移密切相關,調控該通路能夠影響癌細胞侵襲、遷移能力,從而起到抑制肝癌細胞發展、擴散的作用。
細胞周期作為一個連續不斷的過程,是機體細胞活動的基礎生物學行為,與細胞增殖和凋亡能力有著密切的聯系。細胞分期可分為合成前期、合成期、合成后期3個時期,分別以G1、S、G2來表示。研究表明,在合成前期對癌細胞進行阻滯,能夠對其凋亡能力進行調控[22]。本研究對肝癌細胞中細胞周期分布情況進行了檢測,發現阻斷HBx-MALAT-XB130通路導致肝癌細胞處于G1期的細胞比例出現上升,從而影響細胞凋亡能力,說明HBx-MALAT-XB130通路與肝癌細胞周期分布具有密切聯系,調控該通路能夠對肝癌細胞周期分布起到阻滯作用。
綜上所述,HBx-MALAT-XB130通路與肝癌細胞生長、凋亡、侵襲、遷移及肝癌細胞的細胞周期分布情況有密切的聯系,能夠為肝癌的臨床治療起到一定的參考作用。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
黃超群:設計研究方案,實施研究過程,論文撰寫;劉微:提出研究思路,分析試驗數據,論文審核;高文娟:進行統計學分析;段體龍:實施研究過程,資料搜集整理,論文修改;王丹丹:課題設計,論文撰寫

