茄子小孢子再生體系的優化
朱朝輝,趙瑞麗,曾小玲,陳繼兵,徐同偉
(福州市蔬菜科學研究所,福建 福州 350111)
【研究意義】茄子(Solanum melongena)屬常異花作物,天然雜交率低,雜種優勢明顯。但是采用常規雜交育種選育一個新品種所需群體大、年限較長、耗費大量人力物力、品種更新換代慢。單倍體育種可以快速固定優良性狀、縮短育種周期、獲得純合雙單倍體,而且還方便用于誘變突變體離體選擇和基因工程。獲得植株單倍體的方法很多,如配子體的離體誘導[1-2]、遠緣雜交[3]和單倍體誘導系[4]等,其中利用小孢子培養獲得純合雙單倍體植株是常用、有效的方法之一。【前人研究進展】1996年,Miyoshi[5]研究發現在不含糖的培養基中,茄子小孢子在35℃條件下3 d完成脫分化。連勇等[6]利用KM培養基對茄子體細胞融合的雜種小孢子進行培養,獲得大量再生植株。宋彥平等[7]以附加7.5%葡萄糖的KM培養基為基本培養基,對茄子雜交種單核靠邊期小孢子進行游離培養試驗獲得愈傷組織,但不同基因型之間小孢子愈傷組織誘導率差異顯著。朱朝輝等[8]采用不同培養基分段暗培養茄子游離小孢子方法獲得愈傷組織。佟曦然等[9]研究發現,不同游離方式獲得的茄子小孢子的發育途徑不同,經擠壓法獲得的小孢子只形成愈傷組織,而采用自然散落法獲得的小孢子則產生胚狀體。范適等[10]研究結果顯示,基因型對小孢子誘導頻率影響大,對露地生長的花藥進行變溫處理有利于愈傷組織誘導。【本研究切入點】目前,關于茄子小孢子培養的研究主要集中在供體植株基因型、小孢子發育時期和預處理、植株生長環境、培養基種類和培養方式、細胞學觀察等方面,但是二倍體茄子游離小孢子發育同步性差,小孢子愈傷組織誘導率低、難分化成苗等因素制約著該技術的廣泛應用[11]。【擬解決的關鍵問題】本研究以二倍體茄子游離小孢子為材料,對影響小孢子發育同步性、愈傷組織誘導率、生長速度、活力、轉綠率(成熟)、芽分化的若干因素進行研究,以期建立一個再生頻率高的茄子游離小孢子再生體系,為茄子小孢子培養技術在育種中的廣泛應用提供參考。
1 材料與方法
1.1 試驗材料
試驗于2016-2018年在福州市蔬菜科學研究所進行,供試材料為荷蘭茄子品種HLB,采自本所試驗基地。選取長勢良好、無病蟲害的植株取樣,茄子小孢子的游離方法參考朱朝輝等[8]。
1.2 試驗方法
1.2.1 不同培養方式對愈傷組織誘導的影響 (1)靜止和振蕩培養對愈傷組織誘導的影響。將游離出的茄子小孢子添加至N3液體培養基(參考朱朝輝等[8]進行改良)中25℃恒溫培養,培養過程采用以下方式多次添加培養基:A0,不添加(CK);A1,直接添加;A2,先吸除部分原來培養基,再添加等體積新鮮培養基;A3,將原來培養基連同孢子、小愈傷組織一起均分兩皿,添加相應體積新鮮培養基。培養方式為黑暗振蕩培養(轉速為80 r/min)和黑暗靜止培養,每個處理設置10皿,培養8 d時統計愈傷組織數量,并觀察其生長速度。
(2)培養基不同更換方式對愈傷組織誘導的影響。在黑暗靜止培養條件下,比較多次添加N3培養基對愈傷組織誘導及生長的影響,設以下處理:B0,不添加培養基(CK);B1,直接添加等體積培養基;B2,先吸除部分培養基,再添加等體積N3培養基;B3,先平均分成2皿,再添加N3培養基至原體積。每個處理設置5皿,每皿5個愈傷組織,每隔8 d添加1次,共添加2次。培養8、16、24 d時(添加前)統計新生愈傷組織數量,并觀察其生長速度,
1.2.2 愈傷組織大小及固液共培對其成活率和質量的影響 分別將長至1~2 mm、2~4 mm、>4 mm的愈傷組織接種至以下4種培養基中:M0(MS+0.8%瓊脂+3%蔗糖+36 g/L甘露醇)培養基、M1(M0+1 mL N3)培養基、M2(M0+2 mL N3)培養基、M3(M0+3 mL N3)培養基。每個處理接種5皿,每皿接種5個同類型愈傷組織,培養20 d后統計愈傷組織成活率。
1.2.3 不同誘導時間及培養基類型對愈傷組織分化的影響 (1)不同誘導時間對愈傷組織分化的影響。將培養16、24、32 d誘導獲得的>2 mm的愈傷組織轉接至M2培養基上培養,每個時間段誘導的愈傷組織均接種5皿,每皿5個,培養50 d后統計成活率。(2)不同甘露醇質量濃度對愈傷組織轉綠(成熟)的影響。將>2 mm的愈傷組織分別接種在添加0、18、36、54 g/L甘露醇的MS固體培養基中進行培養,每個處理接種30瓶,每瓶接種1個愈傷組織,培養50 d后統計轉綠和變褐愈傷組織數量。(3)不同激素組合對愈傷組織芽分化的影響。將轉綠愈傷組織接種于附加不同激素的MS固體培養基中進行芽分化試驗,ZT、KT、NAA、IAA采用兩兩組合區組設計,共16個處理(表1),每個處理接種30瓶,每瓶接種1個愈傷組織,培養30 d后統計芽分化率。培養溫度25(±1)℃,光照時間14 h/d,光強3 000~4 000 lx。
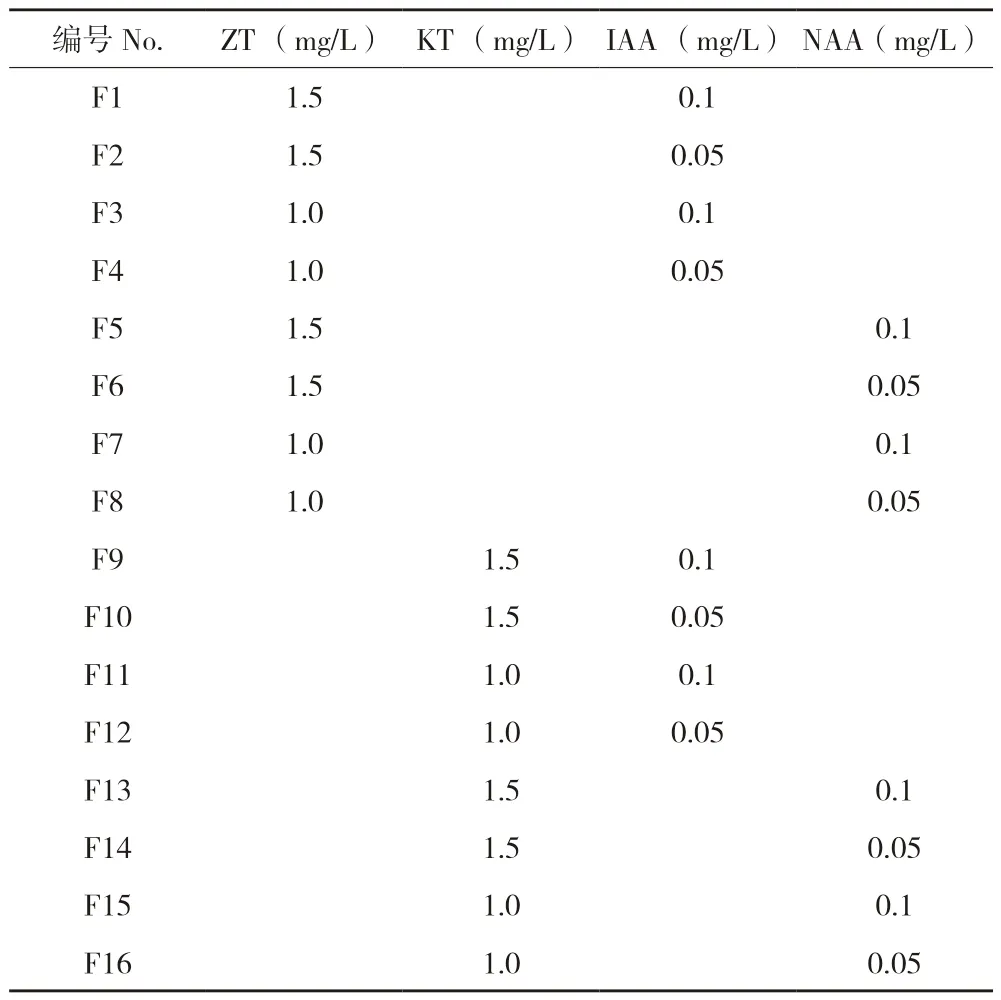
表1 茄子小孢子愈傷組織芽分化的試驗設計Table 1 Test design of bud differentiation of eggplant microspores callus
1.2.4 再生植株倍性鑒定 從愈傷組織上分離2~3 cm的芽,轉入生根培養基(MS+蔗糖30 g/L+瓊脂7 g/L+NAA 5 mg/L+IAA 0.5 mg/L)中培養30 d分化出發達根系,形成完整植株。采用Accuri C6 Plus流式細胞儀鑒定再生植株的倍性。
試驗數據采用Excel 2003進行統計分析,采用SPSS 17.0進行極差分析,采用Duncan’s法進行差異顯著性檢驗。
2 結果與分析
2.1 不同培養方式對愈傷組織誘導的影響
2.1.1 靜止和振蕩培養對愈傷組織誘導的影響 靜止培養和振蕩培養對愈傷組織誘導和生長影響較大。振蕩培養條件下,不同處理間新生愈傷組織數量差異不顯著,平均0.2~0.6個/皿,且生長速度較快;靜止培養條件下,A1、A2、A3處理誘導的愈傷組織數量達3.2~3.8個/皿,顯著高于A0處理,且生長速度較快,A0處理誘導的愈傷組織數量為1.4個/皿(表2),其生長速度較慢。此結果顯示,靜止培養有利于茄子愈傷組織誘導,振蕩培養有利于愈傷組織生長。
2.1.2 培養基不同更換方式對愈傷組織誘導的影響 在靜止培養條件下,N3培養基的不同更換方式和更換時間對茄子愈傷組織誘導率產生了顯著影響。第1次添加后,B0處理中愈傷組織生長緩慢,新增愈傷組織數量顯著低于B1、B2、B3處理。B1、B2、B3處理中愈傷組織的生長速度和新生愈傷組織數量差異均不明顯,表現愈傷組織生長快,平均每皿新生愈傷組織3.3~3.6個。第2次添加后,不同處理新生愈傷組織數量差異較大,B2和B3處理間差異不顯著,分別有3.6、3.4個/皿,但顯著高于B0(0.4個/皿)和B1(0.8個/皿)處理。第3次添加后,新生愈傷組織的數量只有B2處理是3.6個/皿,其他處理顯著降低。B0、B1處理第1次添加后新生愈傷組織數量顯著高于第2、3次添加,B2處理3次添加后新生愈傷組織數量差異不顯著,B3處理第1、2次添加后新生愈傷組織數量差異不顯著,顯著高于第3次添加。此結果顯示,多次部分更換新鮮培養基(B2處理)效果最好,表現為單皿誘導的愈傷組織總量增加(表3)。

表2 不同培養方式對愈傷組織發生及誘導的影響Table 2 Effect of different culture methods on callus formation and induction
2.2 愈傷組織大小及固液共培對其成活率和質量的影響
本研究結果表明,茄子愈傷組織直接在固體培養基(M0)上分化培養時,成活的愈傷組織均呈白色緊實狀,其成活率與大小關系密切:1~2 mm的愈傷組織成活率只有34.67%,褐化死亡多;2~4 mm與>4 mm的愈傷組織成活率差異不顯著,分別為85.33%和82.67%(表4)。
在固體培養基中添加N3液體培養基進行固液共培,愈傷組織成活率可達82%以上,且與其大小關系不大。但液體培養基的體積對愈傷組織質量影響較大:當添加1~2 mL N3培養基進行固液共培時,愈傷組織緊實、呈白色;當添加的N3培養基大于2 mL時,愈傷組織成活率雖然較高,但呈透明水浸狀,這種愈傷組織在后續芽誘導過程中褐化死亡率高。可見,進行固液共培所添加的N3液體培養基以1~2 mL最適宜。
2.3 不同誘導時間及培養基類型對愈傷組織分化的影響
2.3.1 不同誘導時間對愈傷組織分化的影響 小孢子愈傷組織誘導時間對后期分化培養影響較大,培養16 d誘導的愈傷組織分化培養時成活率最高,達93.33%,與培養24 d的(86.00%)差異不顯著。培養16 d、24 d誘導的愈傷組織分化培養時成活率均顯著高于32 d,培養32 d誘導的成活率最低,為42.67%。
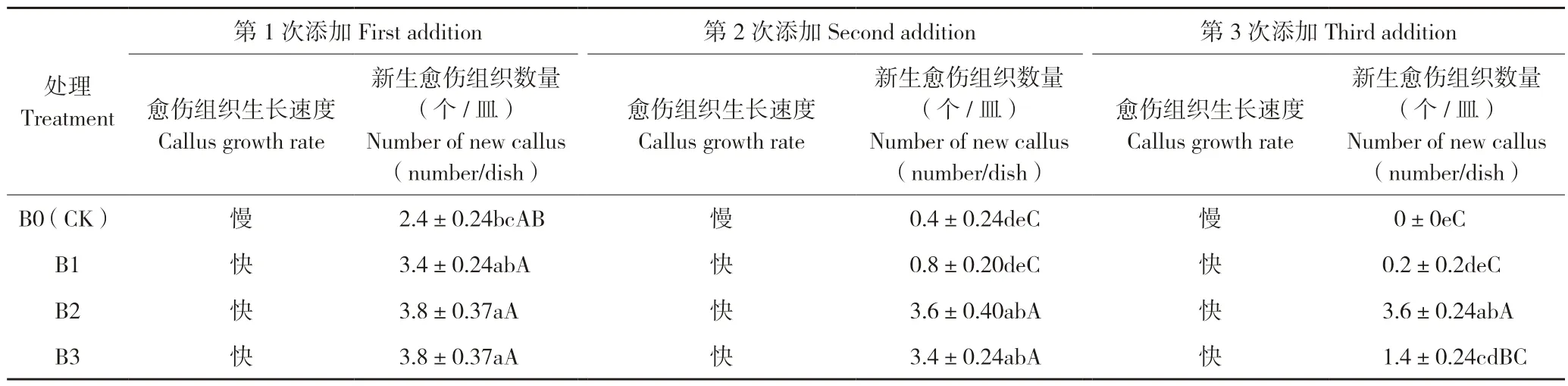
表3 新鮮培養基添加方式和次數對愈傷組織誘導和生長的影響Table 3 Effects of addition method and frequency of fresh culture medium on callus induction and growth
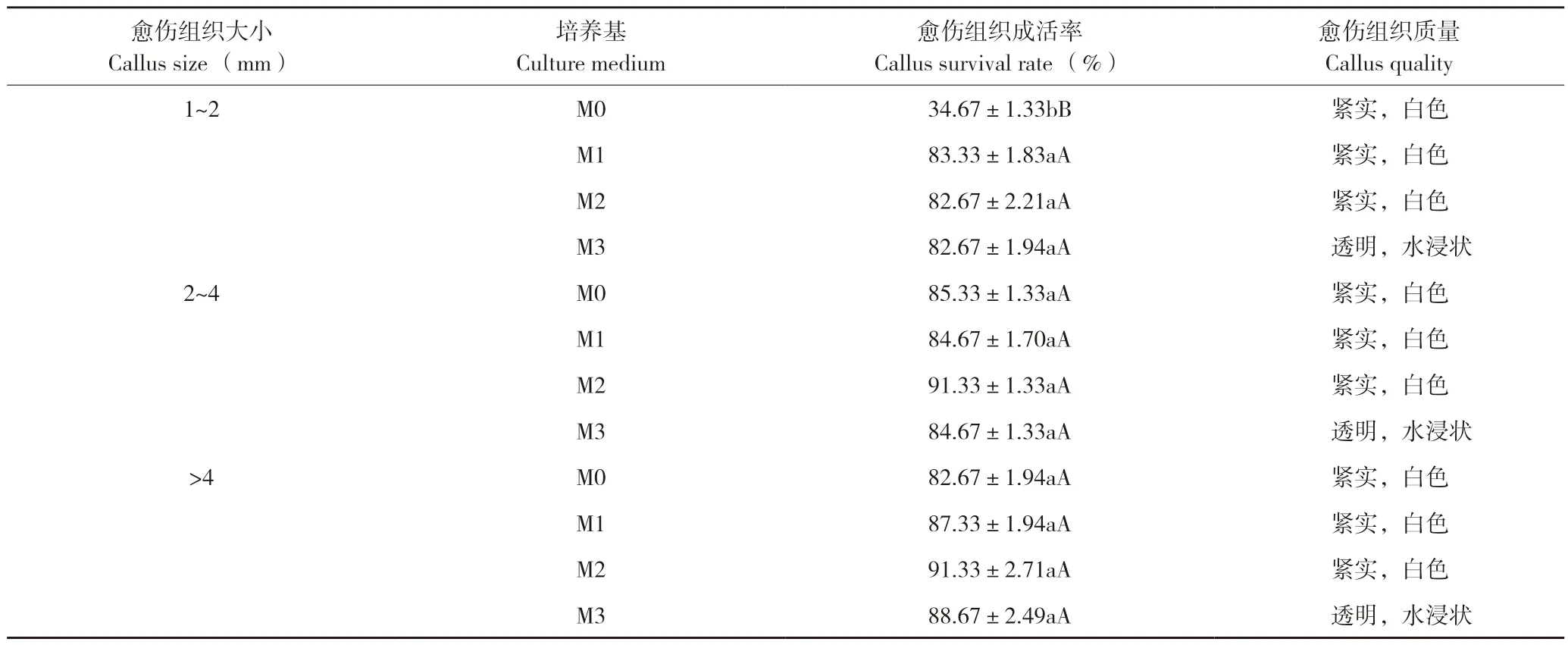
表4 愈傷組織大小及固液共培對其成活率和質量的影響Table 4 Effects of callus size and solid-liquid co-culture on survival rate and quality of callus
2.3.2 不同甘露醇質量濃度對愈傷組織轉綠(成熟)的影響 愈傷組織轉綠是進一步分化的前提,在固體培養基中添加適量甘露醇有利于其轉綠,在不含甘露醇的培養基上培養時轉綠率僅52.00%;當甘露醇質量濃度為18 g/L時,愈傷組織轉綠率為81.33%;甘露醇質量濃度為36 g/L時,其轉綠率最高達94.64%;但甘露醇過高濃度會增加愈傷組織褐化數量,當甘露醇質量濃度增高至54 g/L時,其轉綠率降為45.67%。
2.3.3 不同激素組合對愈傷組織芽分化的影響 在16種不同激素配方中,F6組合的芽分化率最高、達57.78%(表5),與其他組合的差異達到極顯著水平,芽分化率第二的是F5組合(36.66%),F10組合最低只有3.3%。觀察芽生長勢,F6組合芽長勢好,葉片呈綠色、舒展,莖節正常粗壯。因此,F6組合(ZT 1.5 mg/L+NAA 0.05 mg/L)最適合茄子愈傷組織芽分化。
2.7 再生植株倍性鑒定
當芽長至2~3 cm即可從愈傷組織上分離,轉入生根培養基(MS+蔗糖30 g/L+瓊脂7 g/L+NAA 5 mg/L+IAA 0.5 mg/L)培養30 d,分化出發達根系,形成完整植株(圖1)。經馴化、移栽成活率可達96%。本試驗獲得37株再生植株,采用流式細胞儀檢測出32株為二倍體,5株為單倍體。

圖1 愈傷組織分化及植株再生Fig.1 Callus differentiation and plant regeneration
3 討論
3.1 愈傷組織誘導的影響
茄子小孢子培養本身有一些機制尚不明確,小孢子發育同步性低,愈傷組織誘導率不高。本研究結果發現,振蕩培養有利于小孢子愈傷組織生長,這與前人的結論[12-13]一致,但振蕩培養不利于愈傷組織誘導,而靜止培養條件下愈傷組織誘導率較高。培養基添加方式對愈傷組織誘導影響大,本試驗發現,在靜止培養條件下,采用部分更換方式添加N3培養基可以提高愈傷組織單皿誘導總量。隨著培養時間延長,有害物質不斷積累[14],處理B1和B3中新生愈傷組織數量迅速下降。B2采用部分更換培養基的方法,不但為細胞分裂提供充足的營養物質,而且還減少或稀釋了培養基中的有害物質[15],有利于新愈傷組織的誘導和生長,所以在2次更換培養基新生的愈傷組織數量基本穩定。
固液共培時,添加1~2 mL N3液體培養基能使愈傷組織部分暴露在空氣中更容易獲得氧氣,成活率高,質量好;當N3液體培養基體積達到3 mL以上時,茄子小孢子愈傷組織浸沒在液體中,獲得氧氣較少,含水量高,玻璃化趨重,降低愈傷組織質量。這與袁素霞等[16]觀察到“結球甘藍(Brassica oleracea L.)和青花菜(Brassica oleraceaL.var.italicPlanch)小孢子胚在液體培養基中滯留時間越長、玻璃化程度越重”的結果相似。因此,添加1~2 mL N3培養基進行固液共培,是茄子小孢子愈傷組織分化培養的適宜方式。
3.2 愈傷組織分化的影響
添加較高質量濃度的甘露醇可以提高培養基滲透壓,使愈傷組織生長緩慢、結構致密,為分化積累必要營養物質,從而提高轉綠(成熟)率,縮短分化時間。本研究中茄子愈傷組織在含36 g/L甘露醇的培養基中培養時轉綠率最高,這與前人“培養基添加甘露醇可以提高馬鈴薯(Solanum tuberosum)原生質體愈傷組織分化率、縮短分化期”的結果[17-18]一致。但過高質量濃度的甘露醇(50 g/L)會造成培養基滲透壓過高,加重茄子愈傷組織褐化率,這與賴鐘雄[19]在龍眼(Dimocarpus longgana Lour)幼胚成熟培養中發現“較高濃度蔗糖有利幼胚成熟、但過高蔗糖濃度則會加重外植體褐變”的結果相似。
在不同激素處理中,ZT 1.5 mg/L+NAA 0.05 mg/L的激素組合有利于茄子愈傷組織芽分化,這與連勇等[6]在茄子體細胞雜種游離小孢子培養研究中的結果有所不同,其原因可能是基因型、小孢子游離方法、培養環境等不同所致。
4 結論
通過對茄子游離小孢子培養體系進行優化試驗,結果表明茄子游離小孢子在黑暗靜止條件下培養,愈傷組織的誘導效果較好;2次更換部分N3液體培養基可以獲得更多高質量愈傷組織;添加1~2 mL N3液體培養基進行固液共培有利于愈傷組織生長和成活,但過多液體培養基會降低愈傷組織質量;早誘導的愈傷組織分化培養成活率高;在添加36 g/L甘露醇的MS固體培養基中培養的愈傷組織轉綠率最高,達94.64%;ZT 1.5 mg/L+NAA 0.05 mg/L激素組合有利于愈傷組織芽分化,分化率達57.78%。

