TCR-T新曙光
李惠琳
5月底,在美國臨床腫瘤學會2020年會上,一項新型TCR-T細胞療法ADP-A2M4的I期臨床試驗數據,引起了全球醫療界的關注。
這項臨床試驗包括38名平均接受過3種全身治療的癌癥患者,結果顯示,9例患者(23.7%)病情得到緩解或腫瘤縮小,18例患者(47.4%)病情穩定。其中入組的16例滑膜肉瘤患者,在接受ADP-A2M4 T細胞治療后,客觀緩解率為43.8%,疾病控制率為90%以上,患者的中位反應持續時間為28周。
ADP-A2M4療法由美國MD安德森癌癥中心領導,與英國生物技術公司Adaptimmune聯手研發,是一種以癌癥抗原MAGE-A4為靶點的TCR-T細胞療法。
ADP-A2M4在臨床試驗中取得的重大突破,讓TCR-T的療效得到進一步驗證,也給癌癥患者帶來了曙光。根據已公布的臨床試驗數據,TCR-T在滑膜肉瘤、多發骨髓瘤、卵巢癌、肺癌等多種惡性腫瘤中取得了良好療效。
第四療法
免疫細胞療法因為療效顯著,逐步發展成為除了手術、放療、化療之外的第四種腫瘤治療方式。2013年,《科學》雜志將免疫細胞療法評為年度十大科技突破之首。
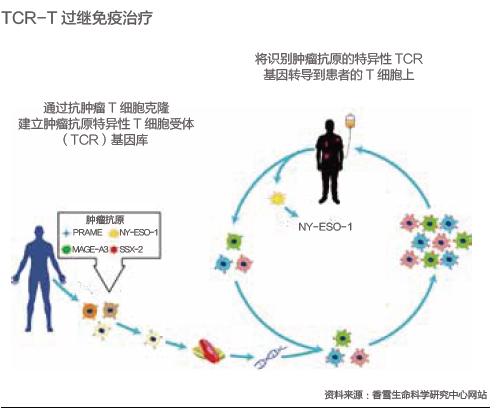
在細胞免疫療法中有一個重要分支——過繼性細胞療法,是當前癌癥精準醫療中的一大熱點,其中有代表性的是CAR-T(嵌合抗原受體T細胞)和TCR-T (T細胞受體嵌合型T細胞)兩大新技術。
根據美國專業期刊《Nature Reviews Drug Discovery》發布的報告,截至2020年3月,全球癌癥細胞療法管線包括1483種活躍療法,比2019年同期增加了472種,其中CAR-T類療法增加最多,同比增加了290種;TCR-T則增加了31種。
CAR-T和TCR-T都屬于經基因工程技術改造的T細胞療法,其中CAR-T是通過識別腫瘤細胞表面抗原靶點而發揮作用,目前僅被批準用于治療白血病、淋巴瘤等少數腫瘤,對治療實體瘤效果不佳。
相比之下,TCR-T能夠識別腫瘤內外多種抗原靶點,可廣泛用于治療包括實體瘤在內的多種惡性腫瘤細胞,因此被寄予厚望。
TCR-T療法的技術關鍵在于提升T細胞的識別率。廣東香雪精準醫療創始人李懿曾做過一個生動的比喻:T細胞就是監視著人體健康動態的“公檢法”系統,不僅能識別人體細胞的“好”與“壞”,而且能夠建立對“壞”細胞的重復打擊模式。而腫瘤細胞可以借助逃逸機制“騙過”T細胞,最終便可能發展成癌癥。
TCR-T治療機制,是提取患者自身的T細胞,通過基因修飾的方式增強識別親和性,然后回輸到患者體內攻擊腫瘤,并最終達到清除體內腫瘤細胞的效果。目前,國內外針對TCR-T免疫治療較為常見的適應癥是滑膜肉瘤,這是一種惡性軟組織腫瘤,當前并無有效的藥物和治療手段, 生存率極低。
研究活躍
美國與中國是開發細胞免疫治療產品最為活躍的兩個國家,上述《Nature Reviews Drug Discovery》報告指出,美國和中國在癌癥細胞療法管線中占主導地位,美國在研療法數量有600個,中國有508個。
近年來,國內外涌現了不少專注于TCR-T領域的企業,目前相關研究仍處于臨床試驗階段,未有產品被批準上市。
成立于2008年的Adaptimmune是國際上專注于TCR-T療法的佼佼者,開發了對T細胞改造的技術平臺SPEAR T,目前已進入臨床試驗的Spear T細胞療法,包括以MAGE-A10、MAGE-A4以及AFP為靶點的針對多種實體瘤的TCR-T療法。
2016年4月,Adaptimmune開發的NY-ESO靶向T細胞療法獲得美國FDA授予的孤兒藥資格,適應癥為軟組織肉瘤(包括滑膜肉瘤、黏液樣圓形脂肪肉瘤等)。2017年,葛蘭素史克(GSK)與Adaptimmune達成合作,獲得了靶向NY-ESO Spear T細胞療法獨家研發權。根據已公布的NY-ESO-1 SPEAR T療法治療滑膜肉瘤的Ⅰ/Ⅱ期臨床數據,12位患者入組,第1組緩解率達50%。
據Adaptimmune透露,目前ADP-A2M4的研究正在進行針對MAGE-A4滑膜肉瘤的Ⅱ期試驗,基于Ⅰ期試驗的數據,Adaptimmune預計相關產品有望于2022年在美國上市。
而在國內,包括復星凱特、優瑞科、香雪精準、藥明巨諾等在內的多家本土藥企也展開了布局,針對多種腫瘤類型研發TCR-T療法和相關藥物,但進展緩慢。
香雪精準醫療是其中取得階段性進展的企業之一。作為香雪制藥旗下的控股子公司,香雪精準醫療成立于2015年,開展以TCR技術為主的新一代抗腫瘤新藥和過繼免疫治療臨床應用技術。
2018年,美國生物制藥公司Athenex與香雪精準成立合資企業Axis Therapeutics,以開發和商業化香雪擁有的高親和力TCR-T技術。2019年3月,香雪精準獲得國內首個TCR-T產品臨床試驗許可批文。
根據公司公告,香雪精準已建立TCR-T完整的技術平臺及工藝,具有完整的自主知識產權。TAEST16001注射液是香雪精準研發管線的第一個產品,針對的靶點是HLA-A*02:01及NY-ESO-1抗原肽組成的復合物。
現有臨床研究數據表明,采用TAEST16001治療腫瘤的病人,其回輸的T細胞在體內能夠長時間維持,并體現較好的治療效果,已開展I期臨床試驗。
難題待解
隨著技術的不斷突破,TCR-T細胞療法的前景令人期待。不過,目前來看,該療法要進入臨床應用,仍面臨不少挑戰。
北京可瑞生物科技有限公司CEO謝興旺透露,制約TCR-T發展的技術瓶頸有兩個:一是臨床可用TCR(T細胞受體)的獲取難度高,需要建立更加高效的親和力優化體系,以獲得足夠的臨床級別TCR;二是親和力改良后,TCR攻擊脫靶風險大。
具體風險包括腫瘤微環境的抑制影響、脫靶毒性、神經毒性,以及和細胞因子釋放綜合征等。比如,在日本,一項關于親和力增強型NY-ESO-1 TCR-T的臨床研究已發現脫靶毒性。
不良反應也體現在Adaptimmune公布的ADP-A2M4療法的I期臨床試驗上,數據顯示,97.4%患者經歷了一些治療相關的不良事件,最常見的是低血細胞計數,比如淋巴細胞減少、白細胞減少等,半數患者出現細胞因子釋放綜合征,兩名患者出現了與臨床試驗相關的死亡。
總體來看,在ADP-A2M4療法臨床試驗中觀察到的副作用,與接受清除淋巴細胞的化療以及接受細胞療法的癌癥患者所經歷的副作用,基本一致。
另外,TCR-T療法需要突破的難題是,癌癥患者個體之間存在極大的治療反應差異,比如,靶向一個抗原的藥物殺死了相應細胞之后,有的患者可以實現抗原信號擴散,進而清除所有的腫瘤細胞,有的卻不能。
“同樣是癌癥晚期,總不能說有的患者免疫力強,有的患者免疫力弱,所以造成治療效果的差異吧?”李懿認為,這暴露了業界在基礎研究上的不足,目前包括TCR-T在內的腫瘤免疫治療領域,仍面臨因為對治療機制的不完全了解而產生的研究障礙。
對于TCR-T新藥研發的風險,香雪制藥也在公告中提到,由于可能涉及技術、工藝等一系列的難題與創新,研發周期長、投入大,過程中不可預測因素較多、風險較大,后續能否獲得國家藥品監督管理局的批準上市,尚存在諸多不確定性。
在李懿看來,腫瘤免疫治療的誕生是對免疫系統本身功能的加強,免疫治療與其他治療方式相結合,可以為醫生和患者提供更多治療方案。

