電針“委中”穴對腰多裂肌損傷大鼠MC、HGF及相關因子影響*
李欣怡,許 玥,魯 曼,張佳怡,陳 潔,陳 莉,徐 菁,白玉琢,陳玉佩,張 莉△,劉 通
(1.北京中醫藥大學,北京 100029; 2.中國中醫藥出版社,北京 100027;3.北京市昌平區南口醫院,北京 102202; 4.廣州中醫藥大學第五臨床醫學院,廣東 廣州 510095)
多裂肌是脊柱最內側的椎旁肌,對抗脊柱過度旋轉及滑動,維持脊柱穩定性影響腰痛。多裂肌損傷后局部微環境發生一系列變化,間充質干細胞(Mesenchyal Stem Cells,MSCs)可通過肌源性分化外機制——旁分泌作用促進骨骼肌再生修復。肝細胞生長因子(Hepatocyte Growth Factor,HGF)是MSCs旁分泌因子之一,作用于組織修復與再生。肥大細胞(Mast cell,MC)廣泛分布于機體各個部位,受組織微環境影響終止分化,參與調節天然及適應性免疫反應[1]。然旁分泌因子HGF與MC的關系尚不明確。本研究擬復制大鼠多裂肌損傷模型,甲苯胺藍法染色觀察多裂肌周圍肥大細胞變化,ELISA法檢測多裂肌HGF及相關蛋白HGFA、c-Met受體的表達情況。從而觀察造模后干預手段電針對損傷的多裂肌修復的影響,研究旁分泌HGF在多裂肌損傷修復過程中的作用機理。
1 材料與方法
1.1 動物
SPF級雄性SD大鼠56只,體質量(300±20)g,由北京維通利華實驗動物中心提供,許可證號SCXK(京)2016-0006。隨機分籠飼養,自由飲食水,明暗周期12 h,環境溫度24 ℃,濕度40%~50%,于動物房適應10 d飼養。
1.2 試劑與儀器
1.2.1 主要試劑 布比卡因鹽酸鹽(美國Sigma公司,80-477-DK);10%水合氯醛(北京歐北生物科技有限公司,780379);4%多聚甲醛溶液(北京雷根生物技術有限公司,90090525);甲苯胺藍染色液(北京索萊寶科技有限公司,201900520);大鼠肝細胞生長因子HGF酶聯免疫試劑盒96T(上海酶聯生物科技有限公司);大鼠肝細胞生長因子激活物HGFA酶聯免疫試劑盒96T(上海酶聯生物科技有限公司);大鼠原癌基因c-Met蛋白酶聯免疫試劑盒96T(上海酶聯生物科技有限公司,m1362210)。
1.2.2 主要儀器 半自動化石蠟切片機(德國萊卡儀器有限公司,RM2245);電熱恒溫鼓風干燥箱(黃石市恒豐醫療器械有限公司);全自動組織脫水機(德國徠卡儀器有限公司,ASP300S);正置智能型顯微鏡及采集系統(奧林巴斯中國有限公司,BX53);韓式電針儀(北京思盛達醫療器械中心,HANS200A);標準規格酶標儀(賽默飛世爾科技公司,Multiskan MK3);自動洗板機(北京拓普分析儀器有限公司,DEM-3);電熱恒溫培養箱(黃石市恒豐醫療器械有限公司,SKP-02.600);離心機(美國sigma公司,3K18)。
1.3 分組與模型制備
56只大鼠采用完全隨機法將其分空白組、模型組、電針組。大鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉,背部備皮后選擇L4~5水平脊柱雙側4點,使用一次性注射器緊貼脊柱進針,針達骨面回抽無血即注射,每點注射0.5%的布比卡因溶液100 μL,共400 μL,旋轉針頭拔出,操作過程保持無菌,模型制作完成。
1.4 干預方法
各電針組造模24 h后開始干預,將大鼠固定在操作臺上,暴露背部和后肢,參照大鼠解剖圖[2]和最新國家標準穴位圖[3],于大鼠膝關節背面正中取雙側干預。針刺前75%乙醇消毒,選用0.25 mm×13 mm華佗牌一次性針灸針垂直刺入委中穴表面皮膚約5 mm,針刺后連接韓式電針儀HANS-200A,2/100 Hz的疏密波,電流強度1 mA,持續干預20 min,1次/d。模型組與電針組同步抓取、固定,模型組不做其他處理。空白組不做任何干預。3組分別治療后1 d、3 d和7 d同步取材(每時間點各6只)。腹腔麻醉選用10%水合氯醛(350 mg/kg)。大鼠深度麻醉后固定,充分暴露背部。剪開大鼠背部皮膚,以組織剪、鑷子剝離腰部筋膜,于 L4~5兩側取下大鼠的腰部多裂肌,左側置于-80 ℃冰箱保存,右側置4%多聚甲醛溶液用于固定。
1.5 檢測指標與方法
1.5.1 甲苯胺藍染色 觀察腰多裂肌周圍肥大細胞變化:分別于L4~5水平脊柱右側取下大鼠腰部多裂肌(包含皮膚、皮下結締組織)經4%多聚甲醛固定48 h后,使組織脫水機脫水,石蠟包埋,進行組織切片的制作,切片厚度為4 pm,切片方向為皮膚和肌肉組織塊縱切面,隨后將各部分進行脫蠟、脫氫和染色,采用0.5%甲苯胺藍染色30 min,自來水沖洗,二甲苯透明,中性樹膠封固。將甲苯胺藍染色的切片置于自動化智能型正置研究級顯微鏡上進行圖像拍攝,拍攝倍數為400倍。
1.5.2 酶聯免疫吸附法(ELISA) 采用雙抗體夾心ELISA方法檢測HGF、HGFA和c-Met含量,參照試劑盒說明書進行。
1.6 統計學方法
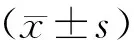
2 結果
2.1 腰多裂肌周圍縱切面組織肥大細胞形態學變化
MC甲苯胺藍染色結果示,3組鏡下可見MC,呈圓形、橢卵圓形或不規則形,核小而圓,染色較深,細胞質內富含嗜堿性紫色顆粒,部分切片可觀察到脫出于細胞質外的嗜堿性顆粒。3組中多裂肌MC細胞數量比多裂肌周圍組織少。多裂肌周圍組織切片中,模型組MC數及脫顆粒較其他兩組明顯。見圖1~3。

圖1 治療1 d后大鼠腰多裂肌及皮下組織MC染色(甲苯胺藍染色,400×)

圖2 治療3 d后大鼠腰多裂肌及皮下組織MC染色(甲苯胺藍染色,400×)

圖3 治療7 d后大鼠腰多裂肌及皮下組織MC染色(甲苯胺藍染色,400×)
2.2 ELISA測量HGF、HGFA和c-Met表達
2.2.1 3組大鼠腰多裂肌HGF表達比較 治療后模型組、電針組多裂肌HGF表達與空白組比較,差異均無統計學意義(P>0.05)。與模型組比較治療1 d、電針組腰多裂肌HGF表達高于模型組(P<0.01),電針組3 d和7 d多裂肌HGF表達與模型組比較,差異無統計學意義(P>0.05)。見表1。
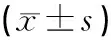
表1 各組大鼠干預后多裂肌中HGF比較
2.2.2 3組大鼠腰多裂肌HGFA表達比較 治療1 d后,模型組多裂肌HGFA表達高于空白組(P<0.01);電針組多裂肌HGFA 表達與空白組比較,差異無統計學意義(P>0.05);電針組多裂肌HGFA表達低于模型組(P<0.01)。治療3 d后, 模型組、電針組與空白組3組之間多裂肌HGFA表達比較,差異均無統計學意義(P>0.05)。治療7 d后,模型組多裂肌HGFA表達低于空白組(P<0.05);電針組多裂肌HGFA表達高于空白組(P<0.01);電針組多裂肌HGFA表達高于模型組(P<0.01)。見表2。
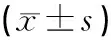
表2 各組大鼠干預后多裂肌中HGFA比較
2.2.3 3組大鼠腰多裂肌c-Met表達比較 治療1 d后,模型組多裂肌c-Met表達低于空白組(P<0.05);電針組多裂肌c-Met表達低于空白組(P<0.01);電針組多裂肌c-Met表達與模型組比較,差異無統計學意義(P>0.05)。治療3 d后,模型組多裂肌c-Met表達與空白組比較,差異無統計學意義(P>0.05);電針組多裂肌c-Met表達均高于空白組、模型組(P<0.01)。治療7 d后,模型組多裂肌c-Met表達低于空白組(P<0.05);電針組多裂肌c-Met表達低于空白組(P<0.05);電針組多裂肌c-Met表達與模型組比較,差異無統計學意義(P>0.05)。見表3。
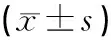
表3 各組大鼠干預后多裂肌中c-Met比較
3 討論
多裂肌與腰椎緊密連接,腰部深層多裂肌萎縮和功能失調影響脊柱穩定性, 是慢性腰痛(chronic Low Back Pain, cLBP) 的發生、進展及復發的關鍵因素[4]。研究發現慢性腰痛患者深層多裂肌表面肌電信號時頻異常[5],腰部多裂肌對L4~5節段穩定性的貢獻高達2/3。前期大量研究發現電針“委中”穴可促相關炎癥因子IL-10、生長因子VEGF、IGF、bFGF、Myod和自噬相關因子p-Akt、mTOR等表達[6-10],進而實現多裂肌再生修復。但電針“委中”穴的旁分泌效應研究較少。“委中”穴位于足太陽膀胱經循行上,具有疏經活絡、涼血解毒的作用,電針通過控制干預條件,觀察“委中”穴遠端腰部變化,闡釋針刺對腰痛治療的部分機理。故本研究電針“委中”穴干預損傷多裂肌大鼠模型,觀察多裂肌HGF旁分泌因子及相關細胞、因子的動態變化。
肥大細胞(MC)是組織損傷微環境的關鍵組成部分,從炎癥反應到重塑細胞外基質(Extracellular matrix,ECM)[11],參與所有步驟的組織修復。其中干細胞旁分泌因子——肝細胞生長因子(Hepatocyte Growth Factor,HGF)對于組織損傷后修復再生至關重要[12]。
針刺對細胞外環境的改變是針刺效應產生的基礎。研究證明電針直接刺激神經感受器啟動信號,肥大細胞伴隨脫顆粒[13]。肥大細胞(Mast cell,MC)廣泛分布于全身結締組織,尤以接受外來刺激較多部位的皮下、黏膜下等處居多[14]。吳美玲針刺大鼠“百會”“三陰交”“合谷”穴區,發現MC呈匯聚狀態分布并伴隨脫顆粒現象發生,脫出的物質聚集在周圍且數量明顯增多[15]。研究發現局部病灶MC聚集與疾病的發生程度成正相關,針灸可影響循經部位MC脫顆粒現象[16]。本研究通過電針”委中”穴觀察多裂肌及周圍組織肥大細胞變化,發現模型組肥大細胞及脫顆粒改變較其他兩組明顯,提示電針有抑制多裂肌損傷的可能。
HGF以無活性沉寂形式駐留在細胞外基質[17],通過對不同細胞類型施加旁分泌作用影響微環境,實現組織保護、修復和再生。張安寧等發現電針骨骼肌鈍挫傷大鼠健側“足三里”及患側阿是穴對應的健側處,HGF蛋白表達量隨時間升高,認為 HGF在電針干預骨骼肌損傷模型的早期已大量分泌[18]。本研究發現,腰多裂肌損傷大鼠治療后1 d電針組HGF表達量高于模型組。電針組整體趨勢均高于模型組,肯定了電針干預腰部多裂肌損傷大鼠后,HGF對骨胳肌修復的作用,且干預早期效果顯著。
凝血因子XII樣絲氨酸蛋白酶——肝細胞生長因子激活劑(Hepatocyte growth factor activation,HGFA)以無活性的酶原存在,發生組織損傷修復時被凝血酶等蛋白激活, 與Matriptase可剪切單鏈形式的前體HGF(Pro-HGF),使其轉變成具有活性的異二聚體形式HGF,發揮HGF/c-Met信號通路活性[19-21]。本實驗結果顯示,模型早期腰多裂肌HGFA表達增多,7 d組出現較空白組表達減少,提示多裂肌損傷早期HGFA對環境反應敏感故被激活。治療后1 d電針組HGFA表達低于模型組(P<0.01),電針組3 d表達量較模型組增高,差異無統計學意義(P>0.05),電針組7 d腰多裂肌HGFA表達量高于模型組(P<0.01)。電針組與模型組比較早期HGFA表達量少,干預后3 d開始升高,提示電針干預后期HGFA發揮激活HGF的作用,隨時間激活作用越發顯著。
HGF與特異性受體c-Met結合而被激活,整合生長、存活和遷移,促進組織重塑[22]。研究發現c-Met滿足闌尾發育中成肌祖細胞的遷移, 同時也影響胸骨舌骨肌和后椎后肌再生[23]。常紅梅等發現HGF變體NK4分子,由于其α鏈C末端丟失了16個氨基酸,導致NK4分子雖競爭性與c -Met結合,卻不能激活受體[24]。本研究結果顯示,治療后1 d、7 d模型組c-Met均低于空白組(P<0.05),提示多裂肌損傷致正常肌細胞減少,隨之肌細胞表面受體通道減少,c-Met受體減少。治療后1 d、7 d電針組c-Met表達低于模型組,治療后3 d電針組高于模型組,提示電針干預后3 d肌衛星細胞表面的受體通道開放增加,隨之肌衛星細胞表面的c-Met增加;壞死時間延長,多裂肌組織再生,隨之肌衛星細胞減少,部分受體通道開始閉合,c-Met減少[25]。
目前針刺治療腰痛效果得到一定認可,針刺作用機制研究尚未明確。研究發現干細胞移植促進大鼠損傷模型骨骼肌再生,但細胞并未分化為骨骼肌纖維[26]。因此通過肌源性分化以外機制——旁分泌作用,促進骨骼肌的再生得到重視。研究發現旁分泌活性多對心肌[27]、腎[28]、肝[29]和肺[30]的組織損傷具有治療作用,但作為骨骼肌的多裂肌損傷研究較少。本實驗旨在探求電針“委中”穴對于腰多裂肌損傷后修復的部分機制,觀察MC、HGF及相關因子表達變化,結果發現電針降低多裂肌周圍肥大細胞數及脫顆粒數,有抑制多裂肌損傷可能。肥大細胞脫顆粒使多裂肌周圍環境改變,旁分泌因子HGF及肥大細胞同存于細胞外基質中,因而細胞外環境改變引起HGF被HGFA激活,后與c-Met受體結合,促進多裂肌損傷修復。但HGF的旁分泌作用機制仍需進一步探究。本實驗開展為針刺作用機制研究提供思路。

