蛋白質對蒙脫石基藥物緩釋及其生物效應影響*
潘璧瑩,魏均曼,夏覓真,吳琳梅
(安徽醫科大學生命科學學院,安徽 合肥 230032)
粘土礦物(如蒙脫石、高嶺石和海泡石等)是層狀含水鋁硅酸鹽礦物,作為一種天然的納米材料,其有大比表面積,豐富孔隙率,良好吸附性能,較高吸附容量和離子交換能力。因而,可作為多種藥物的載體材料,具有載藥容量高,緩釋性能好等特點[1-2]。雖然將藥物負載到粘土礦物基納米材料上展現出了眾多優勢,但是納米材料由于其特殊的物理化學性質,如大的比表面積和高的吸附活性,很容易和生命體系中的蛋白質發生相互作用,在納米材料表面形成蛋白質冠,這層蛋白冠的形成不僅會影響蛋白質分子本身的結構和生物功能,也可能會改變納米材料的生物學行為、藥物釋放和藥效情況[3-6]。因此,本實驗以蒙脫石為模型粘土礦物,5-氟尿嘧啶(抗癌藥物)為模型藥物,制備5-氟尿嘧啶/蒙脫石(5-Fu/Mt)緩釋藥物;以BSA為模型蛋白質,考察BSA濃度、反應時間等因素對藥物釋放的影響;并采用肺癌A549細胞體外培養的方法,觀察BSA存在情況下5-Fu/Mt緩釋藥物對細胞增殖情況的影響。
1 實 驗
1.1 實驗材料
主要試劑和儀器:蒙脫石與5-氟尿嘧啶由上海麥克林生化科技有限公司提供;肺癌A549細胞由安徽醫科大學生物工程實驗室提供;牛血清白蛋白BSA、1640培養基、噻唑藍(MTT)、二甲基亞砜(DMSO)、透析袋(分子量8000~14000)、考馬斯亮藍等試劑均購于北京索萊寶科技有限公司;UV-5200紫外-可見分光光度計,上海元析儀器有限公司;酶標儀(Infinite M200, Tecan, Austria)。
1.2 5-Fu/Mt緩釋藥物的制備
燒杯中加入50 mL NaOH,2 g Mt與0.4 g 5-Fu,并在加熱至80 ℃的油浴鍋中攪拌4 h,去離子水洗滌,離心過濾取上清,在265 nm處測定其平均吸光度。沉淀干燥,研磨得到5-Fu/Mt緩釋藥物[7]。緩釋藥物中5-Fu的含量通過吸附前后溶液吸光度的變化,對照5-Fu標準曲線后計算得出。
1.3 BSA分子的吸附
用50 mL 0.01 mol/L pH=7.4的PBS緩沖液配制濃度為0.2、0.4、0.6、0.8和1.0 mg/mL 的BSA溶液,并向其中分別加入200 mg上述方法制備的5-Fu/Mt,于37 ℃條件吸附一定時間(1 h、2 h、4 h、6 h、10 h、16 h、24 h)。而后,取出離心,取上清液利用考馬斯亮藍在595 nm測蛋白質的吸光度,并計算蛋白質吸附量。蛋白質吸附量Qe=[(C0-Ce)×V]/m,Qe為5-Fu/Mt藥物對BSA的吸附量,mg/g;C0為吸附前BSA溶液的濃度,mg/mL;Ce為吸附平衡后溶液中BSA的濃度,mg/mL;V為BSA溶液的體積,mL;m為5-Fu/Mt藥物的加入量,g。
1.4 藥物體外釋放
用PBS(0.01 mol/L,pH=7.4)緩沖液配置0.2 mg/mL與1 mg/mL的BSA溶液。實驗組:透析袋中加入200 mg 5-Fu/Mt 及 5 mL上述BSA溶液;對照組:透析袋中加入200 mg 5-Fu/Mt及5 mL PBS溶液。將以上透析袋放入裝有100 mL PBS的燒杯中,37 ℃水浴下反應。分別于反應10 min、30 min、1 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h后從燒杯中取樣5 mL,并將事先預熱好的5 mL PBS加入補充。取樣液體經過濾后,測其265 nm處吸光度,計算累計釋放量(Er)[8]。
式中:Er為5-Fu的累積釋放量,%;Ve為釋放介質置換體積,mL;V0為起始釋放液體積,mL;pi為第i次置換時,釋放液中藥物濃度,mg/mL;n為置換釋放介質的次數;mdrug為起始5-Fu/Mt藥物的質量,mg。載藥量(D)=蒙脫石所載藥物(5-Fu)質量/蒙脫石載藥復合物(5-Fu/Mt)質量×100%。
1.5 細胞培養
取肺癌A549細胞在含有10%胎牛血清的1640培養基中,于培養箱內進行培養(5% CO2,37 ℃)。細胞每2天進行傳代和換液,取對數生長期細胞開展各項實驗。
1.6 MTT檢測
處于對數期的肺腺癌A549細胞,用1640培養基(含10%胎牛血清)調整細胞濃度為3.3×104個/mL接種于96孔板,每孔150 μL,于培養箱(37 ℃,5% CO2)培養24 h,每組設置5個復孔。細胞貼壁后棄去培養基,每個孔用PBS清洗兩遍。5-Fu/Mt使用前于15 mL離心管中高壓蒸汽滅菌(121 ℃,25 min)。
(1)無BSA時5-Fu/Mt對肺癌A549細胞的影響:PBS清洗后,96孔板中分別加入150 μL不同濃度的5-Fu/Mt懸液(10、30、50、100、250、500 μg/mL,無血清1640培養基配制);(2)BSA存在條件下5-Fu/Mt對肺癌A549細胞的影響:分別用25、50、100、200、400 μg/mL的BSA溶液(無血清1640培養基配制,過濾滅菌)為溶劑,配制濃度為30 μg/mL的5-Fu/Mt懸液。PBS清洗后,96孔板中分別加入上述配制的5-Fu/Mt懸液150 μL。為消除5-Fu/Mt對吸光度的影響,設置空白對照組,僅加入150 μL的5-Fu/Mt懸液不接種細胞;陰性對照組則是在含細胞孔中僅加入150 μL的無血清1640培養基;調零孔只加入同體積無血清的1640培養基不接種細胞。
按照上述方法孵育24 h后,棄上清,每孔中加入5 mg/mL MTT試劑20 μL,繼續孵育4 h,而后棄MTT試劑,加入200 μL DMSO,震蕩處理5 min,保證結晶充分溶解,經酶標儀在490 nm處測定每孔的OD值。細胞存活率=(實驗組OD值-對應空白組OD值)/(陰性對照OD值-調零孔OD值)×100%,采用SPSS統計軟件進行數據處理,對比采取t檢驗,在P<0.05時,視為差異存在統計學意義。
2 結果與討論
2.1 5-Fu/Mt緩釋藥物對BSA的吸附
圖1a為在pH=7.4,37 ℃,吸附24 h條件下,5-Fu/Mt藥物對BSA的吸附等溫線。結果表明:BSA在5-Fu/Mt緩釋藥物上吸附等溫線形狀呈S型。S型吸附等溫線是常見的等溫線,以表面吸附為主[9]。吸附等溫線中,平衡濃度升高時吸附量平緩變化部分表示固體表面已經被溶質單層飽和;濃度再增加,吸附量再增大,可能是溶質分子發生了多層吸附或者溶質分子形成更密集地排列。圖1b顯示,在吸附開始階段,BSA快速吸附到5-Fu/Mt表面,并在4 h達到吸附極值。而后,隨著吸附的進行,BSA脫附速率大于吸附速率,部分吸附的蛋白質重新回到溶液中,吸附量減小,并在吸附10 h后,達到平衡,使得5-Fu/Mt表面的BSA吸附量基本保持恒定。蒙脫石對蛋白質或氨基酸的吸附主要是通過蒙脫石表面電荷與蛋白質分子發生靜電吸引完成[10-11]。蒙脫石為2:1型層狀硅酸鹽礦物,表面電荷以永久負電荷為主。BSA分子的等電點為4.8,吸附在pH=7.4的PBS緩沖液中進行,因此BSA分子所帶的負電荷增加,BSA分子和蒙脫石之間的靜電引力減弱,隨著吸附時間的增加,BSA分子容易從蒙脫石表面脫附出來[12-14],造成BSA吸附量減小。
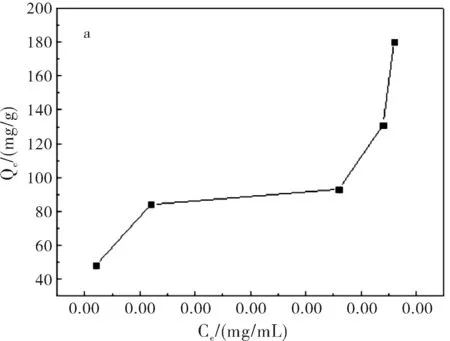
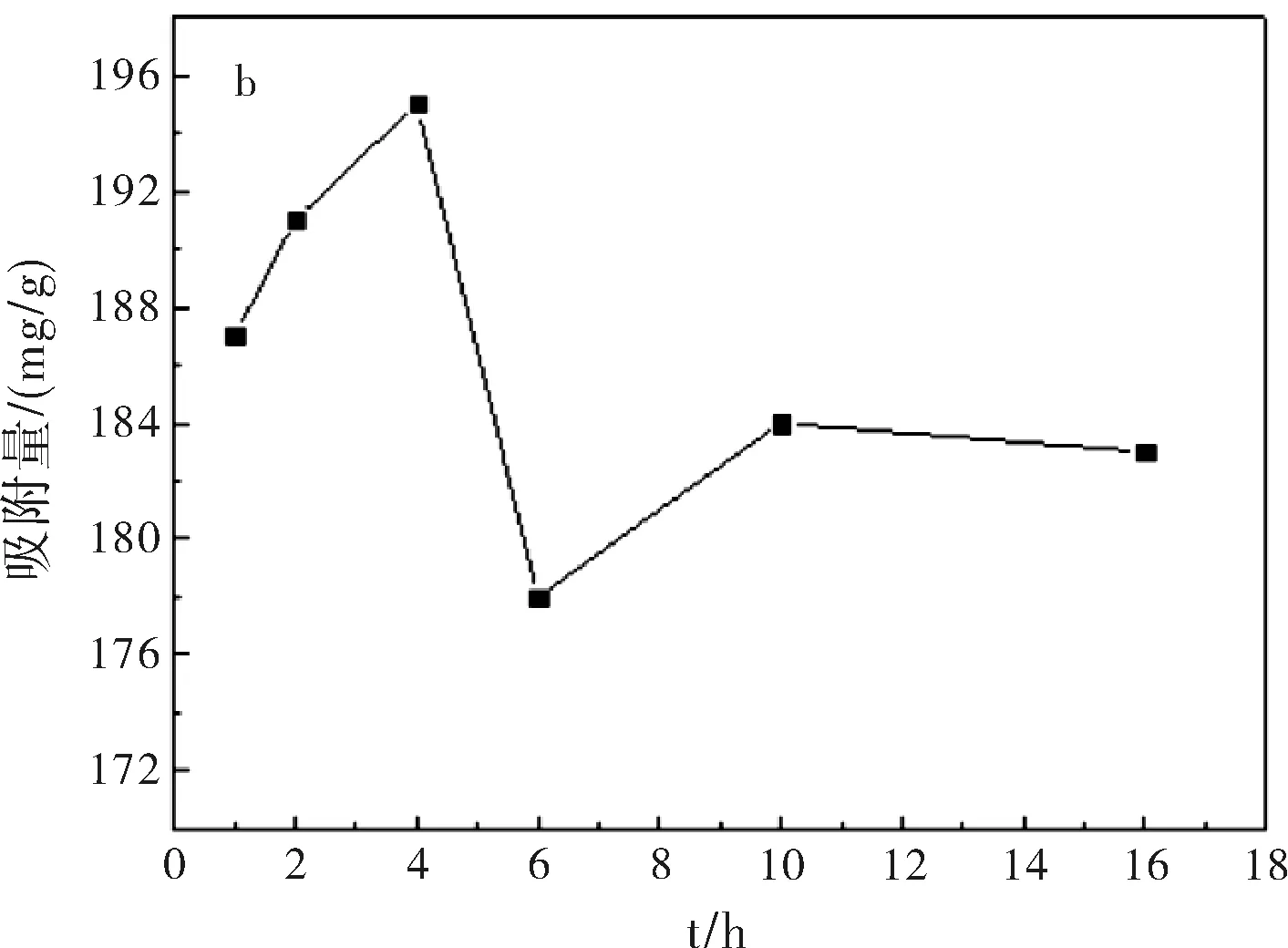
圖1 5-Fu/Mt緩釋藥物對BSA吸附等溫線(a)及時間對BSA(1 mg/mL)吸附量的影響(b)
2.2 BSA對5-Fu/Mt藥物體外緩釋的影響
BSA對5-Fu/Mt藥物體外釋放的影響如圖2所示:0~4 h階段,BSA的存在明顯抑制了5-Fu的釋放,且BSA的濃度越大,抑制程度越大;4~12 h階段,BSA對5-Fu釋放的抑制作用減弱,低濃度BSA(0.2 mg/mL)存在時5-Fu的釋放量與對照組(0 mg/mL BSA)幾乎相等。結合BSA的吸附實驗數據(圖1b)推測造成這一現象的原因可能是:BSA分子在0~4 h內大量吸附到5-Fu/Mt表面,與5-Fu發生相互作用,從而影響其從Mt載體中釋放,且BSA的濃度越大,吸附量越多(圖1a),抑制作用越明顯;4 h后,由于大量吸附的BSA從5-Fu/Mt上脫附出來,因此BSA對5-Fu釋放的抑制作用減弱。
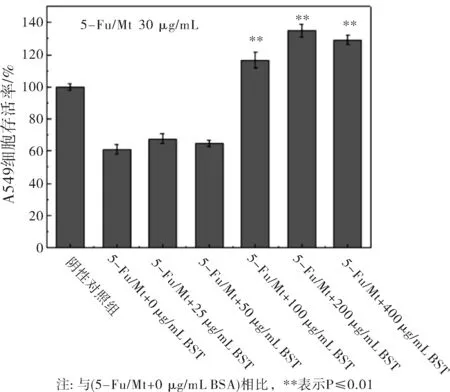
利用DDSolver軟件對5-Fu/Mt藥物在不同BSA濃度下的釋放數據進行Peppas方程(Q=Ktn)擬合,研究藥物釋放機制。式中,Q為累積釋放百分率,t為釋放時間,n為釋放機制表征參數。當n≤0.45時,藥物的釋放機制為Fick擴散;當0.45 圖2 BSA濃度對5-Fu/Mt藥物體外緩釋的影響 圖3 5-Fu/Mt藥物濃度作用下A549細胞的存活率 5-Fu可引起細胞的自噬或者凋亡以此來抑制細胞的生長,從而導致細胞的存活率降低[16]。當5-Fu負載到Mt上時,其對細胞的影響如圖3所示:無BSA情況下,5-Fu/Mt對肺癌A549細胞的存活有一定的抑制作用,且5-Fu/Mt濃度越大,抑制作用愈明顯(P<0.01)。肺癌A549細胞與不同濃度(10、30、50、100、250、500 μg/mL)5-Fu/Mt藥物作用24 h后,細胞形態的變化如圖4所示:陰性對照組的肺癌A549細胞貼壁生長,細胞呈多邊形或者梭形,視野下細胞數量較多。低濃度(<50 μg/mL)5-Fu/Mt藥物作用下,隨著濃度的增加,視野下細胞數量減少,并且細胞固縮變圓,體積變小,呈半貼壁狀態;然而,進一步增大藥物濃度到100和250 μg/mL時,由于藥物濃度過大,視野下只看到懸浮在培養基里的5-Fu/Mt藥物,幾乎看不到細胞。由改良寇式法計算得出的半數抑制濃度(IC50)=27.67 μg/mL。綜合考慮,在后續實驗中,5-Fu/Mt藥物的濃度設置為30 μg/mL。 當體系中BSA存在時,其濃度是影響5-Fu/Mt藥效的重要因素。如圖5所示:低濃度(25 μg/mL、50 μg/mL)BSA分子的加入,并未能顯著引起細胞存活率的改變(P>0.05)。但是,當BSA濃度大于100 μg/mL時,5-Fu/Mt藥物對肺癌A549細胞的抑制作用失效,細胞存活率顯著提高(P<0.01)。 圖4 無BSA存在時顯微鏡下A549的細胞形態隨5-Fu/Mt 圖5 BSA存在條件下5-Fu/Mt對A549細胞存活率的影響 5-Fu/Mt藥物能夠吸附大量的BSA分子,并在10 h后達到吸附/脫附平衡。吸附上的BSA分子影響5-Fu/Mt藥物的緩釋,0~4 h階段,BSA顯著抑制了5-Fu的釋放,且BSA的濃度越大,抑制程度越高,4 h后由于大量吸附的BSA分子脫附出來,BSA的抑制釋放作用減弱。數據擬合結果顯示5-Fu/Mt藥物在不同BSA濃度下的釋放機制均為Fick擴散。5-Fu/Mt對肺癌A549細胞的半數抑制濃度為27.67 μg/mL,高濃度BSA的存在減弱了5-Fu/Mt對肺癌A549細胞的生長抑制作用。
2.3 BSA存在時5-Fu/Mt對肺癌A549細胞的影響


3 結 論

